Pakkausseloste
ACTILYSE injektio/infuusiokuiva-aine, liuosta varten 2 mg
Actilyse 2 mg injektio-/infuusiokuiva-aine liuosta varten
alteplaasi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Actilyse on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin sinulle annetaan Actilyse-valmistetta
- Miten Actilyse-valmiste annetaan
- Mahdolliset haittavaikutukset
- Actilyse-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Actilyse-valmisteen vaikuttava aine on alteplaasi. Se kuuluu trombolyyttisten lääkeaineiden ryhmään. Nämä lääkkeet vaikuttavat liuottamalla verihyytymiä.
| Actilyse 2 mg käytetään liuottamaan verihyytymien tukkimia katetreja. |
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinulle ei anneta Actilyse-valmistetta
- jos olet allerginen (yliherkkä) alteplaasille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Lääkäri on erityisen varovainen Actilyse-valmisteen suhteen
- jos olet saanut jonkin muun allergisen reaktion kuin äkillisen henkeä uhkaavan allergisen reaktion (vakavan yliherkkyysreaktion) vaikuttavasta aineesta alteplaasista tai jostain muusta tämän lääkkeen aineesta (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on verenvuoto jossakin kehosi osassa
- jos sinulla on viimeisen 48 tunnin aikana ollut verenvuodon riskiä lisäävä tila kuten esim.:
- leikkaus
- biopsia (sinulta on otettu kudosnäyte)
- verisuonipunktio
- synnytys
- jos sinulla on verenvuotohäiriö tai verenvuototaipumus
- jos sinulla on vakava maksa- tai munuaissairaus
- jos katetrin lähellä olevassa verisuonessa on verihyytymä (laskimotukos)
- jos katetrissa on tai saattaa olla infektio
Muut lääkevalmiseet ja Actilyse
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt. On erityisen tärkeää, että kerrot lääkärille, jos parhaillaan käytät tai olet äskettäin käyttänyt:
- verenohennuslääkkeitä, kuten
- asetyylisalisyylihappo
- varfariini
- kumariini
- hepariini
- tiettyjä korkean verenpaineen hoitamiseen käytettäviä lääkkeitä (ACE-estäjät)
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä. Lääkäri antaa sinulle Actilyse-valmistetta vain, jos mahdollinen hyöty on suurempi kuin mahdollinen riski vauvallesi.
Miten valmistetta käytetään
Lääkäri tai terveydenhoidon ammattilainen laittaa Actilyse-valmisteen käyttökuntoon ja antaa sen sinulle. Sitä ei oteta itse.
Sinulle annettava annos riippuu painostasi. Enimmäisannos Actilyse-valmistetta on 2 mg, mutta annos on pienempi, jos painat alle 30 kg.
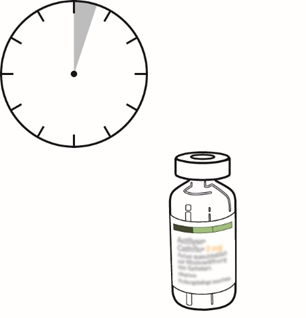
Actilyse laitetaan tukkeutuneeseen katetriin. 30 minuutin kuluttua lääkäri tarkistaa, onko katetri jo auennut. Jos tukkeutuma on liuennut, Actilyse-hoito lopetetaan. Jos katetri on vielä tukossa, Actilyse jää katetriin vielä 90 minuutiksi.
Hoidon jälkeen Actilyse poistetaan katetrista. Katetri huuhdellaan steriilillä keittosuolaliuoksella.
Jos ensimmäisen Actilyse-hoidon jälkeen katetrisi on vielä tukossa, menettely saatetaan toistaa kerran.
Actilyse-valmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Jos sinulla on kysymyksiä tämän valmisteen käytöstä, käänny lääkärin tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Alla kuvattuja haittavaikutuksia on ilmennyt henkilöillä, joille on annettu Actilyse-valmistetta:
Melko harvinaiset (alle 1 potilaalla sadasta)
- infektion kulkeutuminen katetrista verisuoniin aiheuttaen verenmyrkytyksen (sepsis)
- katetrin vahingoittuminen, kuten:
- tukkeutuminen
- vuotaminen
- repeäminen
Harvinaiset (alle 1 potilaalla tuhannesta)
- kuume
Periaatteessa kaikkia haittavaikutuksia, joita on havaittu käytettäessä Actilyse-valmistetta sydänkohtauksen, keuhkoembolian tai aivohalvauksen hoidossa (10, 20, 50 mg alteplaasipakkaukset), voi ilmetä myös tukkeutuneiden katetrien hoidossa. Tämä on kuitenkin mahdollista vain tapauksissa, joissa Actilyse-valmistetta (2 mg alteplaasia) pääsee verenkiertoon. Seuraavia haittavaikutuksia voi esiintyä: esim. verenvuoto, verisuonen yhtäkkinen tukkeutuminen (embolia), allergiset (yliherkkyys-/anafylaktiset) reaktiot, alentunut verenpaine, pahoinvointi, oksentelu, kohonnut kehon lämpötila. Näitä haittavaikutuksia ei ole kuitenkaan toistaiseksi havaittu Actilyse 2 mg -valmisteen käytön yhteydessä. Koska lääkeainetta käytetään pieniä määriä, näiden haittavaikutusten esiintyminen Actilyse 2 mg -valmisteen käytön yhteydessä on epätodennäköistä, lukuun ottamatta allergisia reaktioita, joiden ilmenemiseen pienikin lääkeainemäärä voi olla riittävä. Actilyse-valmisteen (10 mg, 20 mg ja 50 mg) käytön yhteydessä allergisia reaktioita on havaittu harvoin.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Sinun ei yleensä tarvitse säilyttää Actilyse-valmistetta, koska lääkäri antaa sen sinulle.
Ei lasten ulottuville eikä näkyville.
Säilytä jääkaapissa (2–8 °C). Säilytä alkuperäispakkauksessa. Herkkä valolle.
Älä käytä tätä lääkettä pakkauksessa ja injektiopullossa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Käyttökuntoon saatettu liuos
Käyttökuntoon saatetun liuoksen on osoitettu säilyvän enimmillään 24 tunnin ajan 2–8 °C:ssa ja 8 tunnin ajan 25 °C:ssa.
Mikrobiologiselta kannalta valmiste pitää käyttää heti käyttökuntoon saattamisen jälkeen. Ellei sitä käytetä heti, käytönaikainen säilytysaika ja käyttöä edeltävät olosuhteet ovat käyttäjän vastuulla, ja aika ei yleensä ole yli 24 tuntia 2–8°C:ssa.
Pakkauksen sisältö ja muuta tietoa
Mitä Actilyse sisältää
- Vaikuttava aine on alteplaasi. Yksi injektiopullo sisältää 2 mg alteplaasia (vastaten 1 160 000 IU). Alteplaasi tuotetaan yhdistelmä-DNA-tekniikalla käyttäen kiinalaisen hamsterin munasarjasolulinjaa.
- Muut aineet ovat arginiini, fosforihappo (pH:n säätöön) ja polysorbaatti 80.
Lääkevalmisteen kuvaus ja pakkauskoot
Actilyse on injektio-/infuusiokuiva-aine liuosta varten. Yksi pakkaus sisältää viisi injektiopulloa, joista jokainen sisältää 2 mg alteplaasia.
Myyntiluvan haltija
Boehringer Ingelheim International GmbH
Binger Strasse 173
55216 Ingelheim am Rhein
Saksa
Valmistaja
Boehringer Ingelheim Pharma GmbH & Co. KG
Birkendorfer Strasse 65
88397 Biberach/Riss
Saksa
Lisätietoja antaa:
Suomessa:
Boehringer Ingelheim Finland Ky
Tammasaarenkatu 5
00180 Helsinki
Puh: +358 10 310 2800
Ruotsissa:
Boehringer Ingelheim AB
Box 92008
120 06 Stockholm
Tel: +46 (0)8 721 21 00
Tämä pakkausseloste on tarkistettu viimeksi 13.02.2024
Ohjeet terveydenhuollon ammattilaiselle
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Käyttökuntoon saattaminen
Alteplaasin 2 mg:n injektiopulloja ei ole tarkoitettu käytettäväksi akuutin sydäninfarktin, akuutin keuhkoembolian tai akuutin iskeemisen aivohalvauksen hoitoon (suuresta aliannostuksen riskistä johtuen). Ainoastaan 10, 20 tai 50 mg injektiopullot on tarkoitettu näihin käyttöaiheisiin.
2 mg:n injektiopullon sisältö (sisältää ylimäärän) liuotetaan 2,2 ml:aan steriiliä injektionesteisiin käytettävää vettä, jolloin liuoksen lopulliseksi alteplaasipitoisuudeksi tulee 1 mg/ml.
| 1 | Saata käyttökuntoon juuri ennen lääkkeen antamista. |  |
| 2 | Poista Actilyse-kuiva-ainetta sisältävän injektiopullon muovinen repäisysuojus kääntämällä sitä ylöspäin peukalon avulla. | 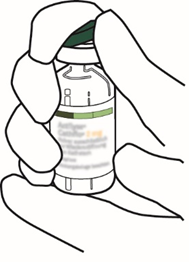 |
| 3 | Pyyhi injektiopullon kumitulpan pinta alkoholipyyhkeellä. | 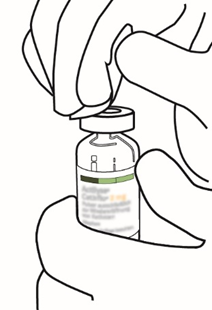 |
| 4 | Vedä aseptisesti 2,2 ml steriiliä injektionesteisiin käytettävää vettä ruiskuun, jossa on riittävä mittaustarkkuus. | 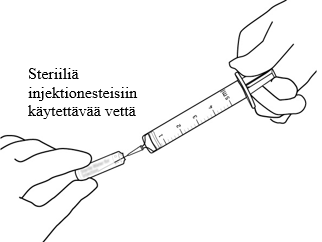 |
| 5 | Siirrä 2,2 ml steriiliä injektionesteisiin käytettävää vettä Actilyse-injektiopulloon työntämällä neula kohtisuoraan kumitulpan keskustan läpi. Ruiskuta liuotin suoraan kuiva-aineeseen. | 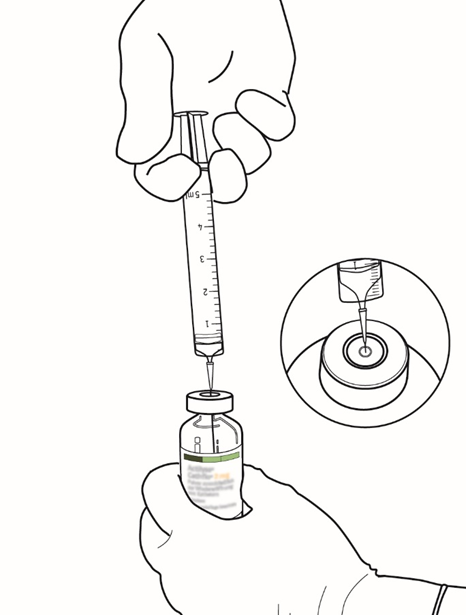 |
| 6 | Ota käyttökuntoon saatettua Actilyse-valmistetta sisältävä injektiopullo ja pyörittele sitä kevyesti, jotta kaikki kuiva-aine liukenee. Älä ravista, jotta liuos ei vaahtoudu.
Jos liuoksessa on kuplia, anna sen olla paikoillaan muutaman minuutin ajan, jotta kuplat katoavat. |
|
| 7 | Käyttökuntoon saatettu liuos sisältää 1 mg/ml alteplaasia. Liuoksen tulee olla kirkasta ja väritöntä tai vaaleankeltaista, eikä se saa sisältää minkäänlaisia partikkeleita. | |
| 8 | Ota tarvittava määrä liuosta käyttämällä neulaa ja ruiskua. | 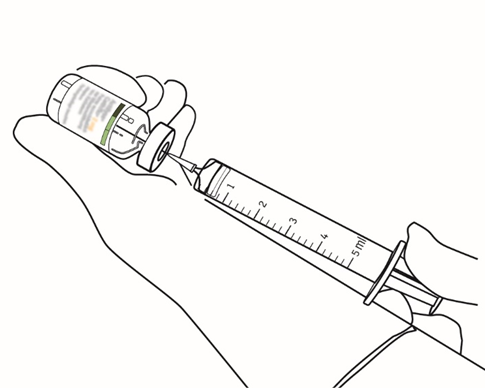 |
| 9 | Käytä välittömästi. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. | |
Käyttökuntoon saatettu liuos injisoidaan tukkeutuneeseen keskuslaskimokatetriin. Se voidaan edelleen laimentaa steriilillä injektionesteisiin käytettävällä natriumkloridiliuoksella 9 mg/ml (0,9 %) siten, että pitoisuus on vähintään 0,2 mg/ml, koska käyttökuntoon saatetun liuoksen samentumista ei voida poissulkea. Käyttökuntoon saatetun 1 mg/ml liuoksen edelleen laimentamista steriilillä injektionesteisiin käytettävällä vedellä tai yleisesti hiilihydraattipitoisten infuusioliuosten, kuten esim. glukoosiliuoksen, käyttöä ei suositella, koska käyttökuntoon saatetun liuoksen sameus lisääntyy. Actilyse-valmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa samaan katetriin (ei edes hepariinin kanssa).
Yhteensopimattomuudet, ks. valmisteyhteenvedon kohta 6.2.
Säilytysolosuhteet, ks. tämän pakkausselosteen kohta Valmisteen säilyttäminen.
Ohjeet liuoksen käytöstä tukkeutuneisiin keskuslaskimokatetreihin, mukaan lukien hemodialyysissa käytetyt katetrit
- Sekoita injektiopullon sisältö käyttökuntoon niin, että sen alteplaasipitoisuus on 1 mg/ml. Jos katetrin luumenin tilavuus on suurempi kuin 2 ml, käyttökuntoon saatettu liuos voidaan vielä laimentaa steriilillä 9 mg/ml (0,9 %) natriumkloridi-injektionesteellä haluttuun tilavuuteen. Esimerkiksi jos katetrin tilavuus on 2,5 ml, Actilyse-valmisteen kokonaisannos on 2,0 mg 2,5 ml:ssa.
- Injisoi sopiva annos Actilyse-valmistetta tukkeutuneeseen keskuslaskimokatetriin.
- Tarkista katetrin toimivuus 30 minuutin jälkeen yrittämällä aspiroida verta. Jos katetri toimii, siirry vaiheeseen 6. Jos katetri ei toimi, siirry vaiheeseen 4.
- Tarkista katetrin toimivuus 120 minuutin jälkeen yrittämällä aspiroida verta ja katetrin sisältöä. Jos katetri toimii, siirry vaiheeseen 6. Jos katetri ei toimi, siirry vaiheeseen 5.
- Jos katetri ei ole alkanut toimia ensimmäisen annoksen jälkeen, voidaan antaa toinen vastaava annos. Toista menettely vaiheesta 1 alkaen. Jos katetri ei ole alkanut toimia toisenkaan annoksen jälkeen, harkitse katetrin vaihtamista.
- Jos katetri on alkanut toimia, aspiroi 4–5 ml (jos potilas painaa yli 10 kg) tai 3 ml (jos potilas painaa alle 10 kg) verta poistaaksesi Actilyse-valmisteen ja jäljelle jääneen tukoksen, ja huuhtele katetri varovasti steriilillä 9 mg/ml (0,9 %) natriumkloridi-injektionesteellä.