Pakkausseloste
SIMBRINZA ögondroppar, suspension 10 mg/ml+2 mg/ml
Tilläggsinformation
SIMBRINZA 10 mg/ml + 2 mg/ml ögondroppar, suspension
brinzolamid/brimonidintartrat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, optiker eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, optiker eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad SIMBRINZA är och vad det används för
- Vad du behöver veta innan du använder SIMBRINZA
- Hur du använder SIMBRINZA
- Eventuella biverkningar
- Hur SIMBRINZA ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
SIMBRINZA innehåller två aktiva substanser, brinzolamid och brimonidintartrat. Brinzolamid tillhör en grupp läkemedel som kallas karbanhydrashämmare och brimonidintartrat tillhör en grupp läkemedel som kallas alfa-2-adrenerga receptoragonister. Båda substanserna verkar tillsammans för att sänka ögontrycket.
SIMBRINZA används för att sänka trycket i ögonen hos vuxna patienter (18 år eller äldre) som har ögonsjukdomar som kallas glaukom eller okulär hypertoni, och för vilka det inte går att effektivt kontrollera det höga trycket i ögonen med enbart ett läkemedel.
Vad du behöver veta innan produkten används
Använd inte SIMBRINZA:
- om du är allergisk mot brinzolamid eller brimonidintartrat eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- om du är allergisk mot sulfonamider (till exempel läkemedel som används för att behandla diabetes och infektioner samt även diuretika (vattendrivande tabletter))
- om du tar monoaminoxidashämmare (MAO-hämmare) (till exempel läkemedel som används för att behandla depression eller Parkinsons sjukdom) eller vissa antidepressiva läkemedel. Du måste tala om för läkaren om du tar läkemedel mot depression
- om du har allvarliga problem med njurarna
- om du har för hög surhetsgrad i ditt blod (ett tillstånd som kallas hyperkloremisk acidos)
- till nyfödda och barn under 2 år.
Varningar och försiktighet
Tala med läkare, optiker eller apotekspersonal innan du använder SIMBRINZA om du har eller tidigare har haft:
- leverproblem
- en typ av högt tryck i ögonen som kallas trångvinkelglaukom
- torra ögon eller problem med hornhinnan
- kranskärlssjukdom (symtom kan inkludera bröstsmärta, tryck över bröstet, andnöd eller kvävningskänsla), hjärtsvikt, högt eller lågt blodtryck
- depression
- störd eller dålig blodcirkulation (som Raynauds sjukdom eller Raynauds syndrom eller cerebral insufficiens)
- om du någon gång har fått svåra hudutslag eller hudavlossning, blåsor och/eller munsår efter att ha använt SIMBRINZA eller andra relaterade läkemedel.
Var särskilt försiktig med SIMBRINZA:
Allvarliga hudreaktioner, inklusive Stevens-Johnsons syndrom och toxisk epidermal nekrolys har rapporterats i samband med behandling med brinzolamid. Sluta använda SIMBRINZA och uppsök medicinsk vård omedelbart om du får något av symtomen relaterade till de allvarliga hudreaktioner som beskrivs i avsnitt Eventuella biverkningar.
Om du använder mjuka kontaktlinser ska du inte använda dropparna med kontaktlinserna kvar i ögonen. Se avsnittet ”Användning av kontaktlinser – SIMBRINZA innehåller bensalkoniumklorid” nedan).
Barn och ungdomar
SIMBRINZA rekommenderas inte till barn och ungdomar under 18 års ålder eftersom det inte har studerats i denna åldersgrupp. Det är särskilt viktigt att läkemedlet inte används till barn under 2 år eftersom det inte kan anses vara säkert (se avsnittet ”Använd inte SIMBRINZA” ovan).
Andra läkemedel och SIMBRINZA
Tala om för läkare, optiker eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
SIMBRINZA kan påverka eller påverkas av andra läkemedel du använder, inklusive andra ögondroppar mot grön starr (glaukom).
Tala om för din läkare om du använder eller tänker använda något av följande läkemedel:
- läkemedel som sänker blodtrycket
- hjärtläkemedel inklusive digoxin (används för att behandla hjärtsjukdomar)
- andra läkemedel mot glaukom som även behandlar höjdsjuka och kallas acetazolamid, metazolamid och dorzolamid
- läkemedel som kan påverka metabolismen, såsom klorpromazin, metylfenidat och reserpin
- antivirala, antiretrovirala läkemedel (läkemedel som används för att behandla HIV) eller antibiotika
- läkemedel mot jästsvamp och svamp
- monoaminoxidashämmare (MAO-hämmare), eller antidepressiva läkemedel inklusive amitriptylin, nortriptylin, klomipramin, mianserin, venlafaxin och duloxetin
- läkemedel för bedövning
- lugnande medel, opiater eller barbiturater.
Du ska tala om för din läkare om dosen för något av dina nuvarande läkemedel ändras.
SIMBRINZA med alkohol
Om du dricker alkohol regelbundet, rådfråga läkare, optiker eller apotekspersonal innan du tar detta läkemedel. SIMBRINZA kan påverkas av alkohol.
Graviditet och amning
Om du är gravid, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare, optiker eller apotekspersonal innan du använder detta läkemedel. Kvinnor som kan bli gravida ska använda effektiva preventivmedel medan de behandlas med SIMBRINZA. Användning av SIMBRINZA rekommenderas inte under graviditet. Använd inte SIMBRINZA om inte din läkare tydligt har ordinerat det.
Om du ammar, kan SIMBRINZA passera över i bröstmjölken. Användning av SIMBRINZA rekommenderas inte under amning.
Körförmåga och användning av maskiner
När du använder SIMBRINZA, kan du kan märka att din syn blir suddig eller onormal ett tag. SIMBRINZA kan även orsaka yrsel, dåsighet eller trötthet hos vissa patienter.
Kör inte bil och använd inte maskiner förrän symtomen har gått över.
Användning av kontaktlinser – SIMBRINZA innehåller bensalkoniumklorid
Detta läkemedel innehåller 0,15 mg bensalkoniumklorid per 5 ml, vilket motsvarar 0,03 mg/ml.
Bensalkoniumklorid kan tas upp av mjuka kontaktlinser och missfärga kontaktlinserna. Ta ut kontaktlinser innan du använder läkemedlet och vänta minst 15 minuter innan kontaktlinserna sätts in igen. Bensalkoniumklorid kan vara irriterande för ögon, särskilt om du har torra ögon eller problem med hornhinnan (den klara hinnan längst fram i ögat). Om du känner irritation, stickningar eller smärta i ögat efter att ha använt läkemedlet, kontakta läkare.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens, optikerns eller apotekspersonalens anvisningar. Rådfråga läkare, optiker eller apotekspersonal om du är osäker.
SIMBRINZA ska bara användas i ögonen. Det får inte sväljas eller injiceras.
Rekommenderad dos är en droppe i det påverkade ögat eller ögonen två gånger per dag. Använd dropparna vid samma tidpunkt varje dag.
Bruksanvisning
Tvätta händerna innan du börjar.
|
|
|
| 1 |
2 |
Omskaka väl före användning.
Vrid av flasklocket. Om säkerhetskragen är lös när du har avlägsnat locket, ska du ta bort kragen innan du använder läkemedlet.
Undvik att vidröra droppspetsen med fingrarna när du öppnar eller stänger flaskan. Det kan förorena dropparna.
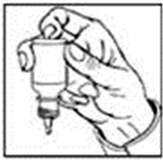
Håll flaskan upp och ner mellan tummen och fingrarna.
Luta huvudet bakåt.
Dra ned det undre ögonlocket med ett rent finger tills det bildas en ”ficka” mellan ögonlocket och ögat. Droppen ska hamna i fickan (bild 1).
För flaskans spets tätt intill ögat. Du kan stå framför en spegel, om det hjälper.
Rör inte ögat eller ögonlocket, omgivande områden eller andra ytor med flaskspetsen. Det kan förorena dropparna.
Tryck försiktigt i botten på flaskan för att frigöra en droppe SIMBRINZA.
Kläm inte på flaskan; den är konstruerad så att ett lätt tryck i botten är tillräckligt (bild 2).
För att minska mängden läkemedel som kan komma ut i resten av kroppen när du har använt ögondroppen ska du blunda och trycka lätt med ett finger i ögonvrån vid näsan under minst 2 minuter.
Om du använder dropparna i båda ögonen, upprepa de olika momenten för ditt andra öga. Du behöver inte stänga och skaka flaskan innan du administrerar droppen i det andra ögat. Skruva åt flasklocket noga omedelbart efter användning.
Om du använder andra ögondroppar utöver SIMBRINZA, vänta minst fem minuter mellan administrationen av SIMBRINZA och de andra dropparna.
Om droppen missar ögat, försök igen.
Om du har använt för stor mängd av SIMBRINZA
Skölj ur ögat med ljummet vatten. Ta inga fler droppar förrän det är dags för din nästa ordinarie dos.
Vuxna som oavsiktligt svalde läkemedel som innehöll brimonidin fick en långsammare hjärtfrekvens, sänkt blodtryck vilket kan följas av höjt blodtryck, hjärtsvikt, svårt att andas och effekter i nervsystemet. Om detta händer ska du omedelbart kontakta läkare.
Allvarliga biverkningar har rapporterats hos barn som råkat svälja läkemedel med brimonidin. Tecknen omfattar sömnighet, slapphet, låg kroppstemperatur, blekhet och svårighet att andas. Om detta händer, kontakta omedelbart läkare.
Om du har råkat svälja SIMBRINZA ska du omedelbart kontakta läkare.
Om du har glömt att använda SIMBRINZA
Fortsätt med nästa dos som planerat. Ta inte dubbel dos för att kompensera för glömd dos. Använd inte mer än en droppe i det påverkade ögat (ögonen) två gånger dagligen.
Om du slutar att använda SIMBRINZA
Sluta inte att använda SIMBRINZA utan att tala med läkare. Om du slutar att använda SIMBRINZA så kontrolleras inte trycket i ditt öga, vilket kan leda till synförlust.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, optiker eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Om du får någon av följande biverkningar ska du sluta att använda läkemedlet och omedelbart söka vård, eftersom det kan vara tecken på en reaktion mot läkemedlet. Frekvensen för en allergisk reaktion mot läkemedlet är okänd (kan inte beräknas utifrån tillgängliga data).
- Svåra hudreaktioner, inklusive utslag eller rodnad eller klåda på kroppen eller i ögonen.
- Svårt att andas.
- Bröstsmärta, oregelbundna hjärtslag.
Kontakta omedelbart läkare om du blir extremt trött eller får yrsel.
Följande biverkningar har rapporterats med SIMBRINZA och andra läkemedel som innehåller enbart brinzolamid eller brimonidin:
Sluta använda SIMBRINZA och uppsök medicinsk vård omedelbart om du får några av följande symtom:
- rödaktiga icke-förhöjda, målliknande eller cirkulära fläckar på bålen, ofta med centrala blåsor, hudavlossning, sår i mun, svalg, näsa, könsorgan samt ögon. Dessa allvarliga hudutslag kan föregås av feber och influensaliknande symtom (Stevens-Johnsons syndrom, toxisk epidermal nekrolys).
Vanliga (kan förekomma hos upp till 1 av 10 användare)
- Effekter i ögat: allergisk konjunktivit (ögonallergi), ytlig ögoninflammation, ögonsmärta, ögonobehag, dimsyn eller onormal syn, röda ögon.
- Allmänna biverkningar: dåsighet, yrsel, dålig smak i munnen, muntorrhet.
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
- Effekter i ögat: ytlig ögonskada med förlust av celler, inflammation i ögonlocket, avlagringar på ögats yta, ljuskänslighet, svullnad i ögat (i hornhinnan eller ögonlocket), ögontorrhet, utsöndring från ögat, vattnigt öga, rodnad på ögonlocket, onormal eller nedsatt känsel i ögat, trötthet i ögat, nedsatt syn, dubbelseende, produktpartiklar i ögonen.
- Allmänna biverkningar: sänkt blodtryck, bröstsmärta, oregelbundna hjärtslag, långsamma eller snabba hjärtslag, hjärtklappningar, svårt att sova (insomni), mardrömmar, depression, allmän svaghet, huvudvärk, yrsel, nervositet, irritabilitet, allmän sjukdomskänsla, minnesförlust, andfåddhet, astma, näsblod, förkylningssymtom, torrhet i näsa eller svalg, halsont, svalgirritation, hosta, rinnande näsa, täppt näsa, nysningar, bihåleinflammation, trånghet i bröstet, ringningar i öronen, matsmältningsbesvär, gas i tarmarna eller magont, illamående, diarré, kräkning, onormal känsel i munnen, ökade allergiska symtom i huden, utslag, onormal känsel i huden, håravfall, allmän klåda, förhöjda nivåer av klor i blodet, eller minskat antal röda blodceller vid blodtest, smärta, ryggsmärta, muskelsmärta eller -spasm, njursmärta som t.ex. smärta i ländryggen, nedsatt sexualdrift, sexuella problem för män.
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 användare)
- Effekter i ögat: minskad pupillstorlek.
- Allmänna biverkningar: svimning, förhöjt blodtryck.
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
- Effekter i ögat: minskad tillväxt av ögonfransarna.
Allmänna biverkningar:skakning, nedsatt känsel, förlust av smak, onormala leverfunktionsvärden i blodtest, svullnad i ansiktet, ledsmärta, behov att kissa ofta, bröstsmärta, svullnad i extremiteter, rödaktiga icke-förhöjda, målliknande eller cirkulära fläckar på bålen, ofta med centrala blåsor, hudavlossning, sår i mun, svalg, näsa, könsorgan samt ögon som kan föregås av feber och influensaliknande symtom. Dessa allvarliga hudutslag kan vara potentiellt livshotande (Stevens-Johnsons syndrom, toxisk epidermal nekrolys).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, optiker eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på flaskan och kartongen efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Inga särskilda förvaringsanvisningar.
Kassera flaskan 4 veckor efter att du öppnat den, för att förhindra infektioner, och använd en ny flaska. Skriv upp det datum då du öppnat den på avsett utrymme på kartongen.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga optikern eller apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- De aktiva substanserna är brinzolamid och brimonidintartrat. En ml suspension innehåller 10 mg brinzolamid och 2 mg brimonidintartrat motsvarande 1,3 mg brimonidin.
- Övriga innehållsämnen är bensalkoniumklorid (se avsnitt Vad du behöver veta innan produkten används ”Användning av kontaktlinser – SIMBRINZA innehåller bensalkoniumklorid”), propylenglykol, karbomer 974P, borsyra, mannitol, natriumklorid, tyloxapol, saltsyra och/eller natriumhydroxid och renat vatten.
Små mängder saltsyra och/eller natriumhydroxid läggs till för att hålla surhetsgraden (pH) normal.
Läkemedlets utseende och förpackningsstorlekar
SIMBRINZA ögondroppar, suspension är en vätska (vit till benvit suspension) som levereras i en förpackning innehållande en eller tre 5 ml plastflaskor med skruvlock.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irland
Tillverkare
Novartis Farmacéutica, S.A.
Gran Via de les Corts Catalanes, 764
08013 Barcelona
Spanien
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Belgien
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
Denna bipacksedel ändrades senast 22.1.2026
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.