Pakkausseloste
SANDOSTATIN LAR injektiokuiva-aine ja liuotin, suspensiota varten 10 mg, 20 mg, 30 mg
Sandostatin LAR 10 mg injektiokuiva-aine ja liuotin, suspensiota varten
Sandostatin LAR 20 mg injektiokuiva-aine ja liuotin, suspensiota varten
Sandostatin LAR 30 mg injektiokuiva-aine ja liuotin, suspensiota varten
oktreotidi
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Sandostatin LAR on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Sandostatin LAR ‑valmistetta
- Miten Sandostatin LAR ‑valmistetta käytetään
- Mahdolliset haittavaikutukset
- Sandostatin LAR ‑valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Sandostatin LAR on synteettinen somatostatiinijohdos. Somatostatiinia esiintyy normaalisti ihmiselimistössä, jossa se estää tiettyjen hormonien kuten kasvuhormonin vapautumista. Sandostatin LAR ‑hoidon etuna somatostatiiniin verrattuna on se, että lääke on vahvempaa ja vaikuttaa pidempään.
Sandostatin LAR ‑valmistetta käytetään
- akromegalian hoitoon
Akromegaliassa elimistössä muodostuu liikaa kasvuhormonia. Normaalisti kasvuhormoni säätelee kudosten, elinten ja luiden kasvua. Liiallinen kasvuhormonipitoisuus johtaa luiden ja kudosten koon suurenemiseen erityisesti käsissä ja jalkaterissä. Sandostatin LAR vähentää huomattavasti akromegalian oireita, joita ovat mm. päänsärky, liiallinen hikoilu, käsien ja jalkaterien puutuminen, uupumus ja nivelkipu. Kasvuhormonin liikatuotanto johtuu useimmiten aivolisäkkeen adenoomakasvaimesta. Sandostatin LAR ‑hoito voi pienentää adenooman kokoa.
Sandostatin LAR ‑lääkettä käytetään akromegalian hoitoon:
- kun muut akromegalian hoitotavat (leikkaus tai sädehoito) eivät sovi potilaalle tai eivät ole tehonneet,
- sädehoidon jälkeen väliaikaisena hoitona, kunnes sädehoidon täysi teho tulee esiin.
- lievittämään oireita, jotka liittyvät tiettyjen hormonien tai muiden samankaltaisten aineiden liialliseen muodostukseen mahassa, suolistossa tai haimassa
Jotkin harvinaiset mahan, suoliston tai haiman sairaudet voivat aiheuttaa tiettyjen hormonien ja muiden samankaltaisten luontaisten aineiden liiallista muodostusta. Tämä järkyttää elimistön luontaista hormonitasapainoa ja aiheuttaa erilaisia oireita, kuten kuumia aaltoja, ripulia, matalaa verenpainetta, ihottumaa ja painon laskua. Sandostatin LAR -hoito auttaa pitämään oireet hallinnassa.
- hoitamaan suoliston (esim. umpilisäkkeen, ohutsuolen tai paksusuolen) neuroendokriinisiä kasvaimia
Neuroendokriiniset kasvaimet ovat harvinaisia kasvaimia, joita voi esiintyä eri puolilla elimistöä. Sandostatin LAR ‑hoitoa käytetään myös tällaisten kasvainten kasvun hillitsemiseen, kun kasvain sijaitsee suolistossa (esim. umpilisäkkeessä, ohutsuolessa tai paksusuolessa).
- liikaa tyreotropiinia tuottavien aivolisäkekasvaimien hoitoon.
Liika tyreotropiini johtaa kilpirauhasen liikatoimintaan. Sandostatin LAR -lääkettä käytetään liikaa tyreotropiinia tuottavien aivolisäkekasvaimien hoitoon:
- kun muu hoito (leikkaus tai sädehoito) ei sovi tai ei ole auttanut
- sädehoidon jälkeen, kunnes sädehoidolla saavutetaan täysi teho
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Noudata tarkasti kaikkia lääkärisi ohjeita. Ne saattavat erota tässä selosteessa annettavista ohjeista.
Lue seuraavat ohjeet ennen kuin käytät Sandostatin LAR ‑valmistetta.
Älä käytä Sandostatin LAR ‑valmistetta
- jos olet allerginen oktreotidille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen kuin käytät Sandostatin LAR ‑valmistetta:
- jos tiedät, että sinulla on nyt sappikiviä tai sinulla on ollut niitä aiemmin, tai saat komplikaatioita kuten kuumetta, vilunväristyksiä, mahakipua tai ihon tai silmien keltaisuutta. Kerro asiasta lääkärille, sillä pitkäaikainen Sandostatin LAR ‑hoito voi aiheuttaa sappikivimuodostusta. Lääkäri päättää ehkä tutkia sappirakkosi säännöllisesti.
- jos tiedät, että sinulla on diabetes, sillä Sandostatin LAR voi vaikuttaa verensokeriarvoihin. Jos olet diabeetikko, verensokeriarvosi on tarkistettava säännöllisesti.
- jos sinulla on aiemmin ollut B12-vitamiinin puutosta; lääkäri haluaa ehkä tarkistaa B12-vitamiiniarvosi säännöllisesti.
Tutkimukset ja tarkastukset
Jos saat pitkäaikaista Sandostatin LAR ‑hoitoa, lääkäri saattaa tutkia kilpirauhastoimintasi säännöllisesti.
Lääkäri tutkii maksasi toiminnan.
Lääkärisi saattaa haluta tarkistaa haiman entsyymitoiminnan.
Lapset
Sandostatin LAR ‑valmisteen käytöstä lapsille on vain vähän kokemusta.
Muut lääkevalmisteet ja Sandostatin LAR
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Voit yleensä jatkaa muiden lääkkeiden käyttöä Sandostatin LAR ‑hoidon aikana. Sandostatin LAR ‑hoidon on kuitenkin ilmoitettu vaikuttaneen tiettyihin lääkkeisiin, esim. simetidiiniin, siklosporiiniin, bromokriptiiniin, kinidiiniin ja terfenadiiniin.
Jos käytät verenpainelääkettä (esim. beetasalpaajaa tai kalsiumkanavan salpaajaa) tai neste- ja elektrolyyttitasapainoa säätelevää lääkettä, lääkärin on ehkä muutettava sen annostusta.
Jos olet diabeetikko, lääkärin on ehkä muutettava insuliiniannostustasi.
Jos olet saamassa lutetium(177Lu)oksodotreotidi -radioaktiivista lääkevalmistehoitoa, lääkäri voi keskeyttää Sandostatin LAR -hoitosi ja/tai muuttaa sitä lyhyeksi aikaa.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.
Sandostatin LAR ‑valmistetta saa käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Hedelmällisessä iässä olevien naisten on käytettävä tehokasta ehkäisymenetelmää hoidon aikana.
Sandostatin LAR ‑hoidon aikana ei saa imettää. Ei tiedetä, erittyykö Sandostatin LAR rintamaitoon.
Ajaminen ja koneiden käyttö
Sandostatin LAR ‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn. Tietyt Sandostatin LAR ‑hoidon aikana mahdollisesti esiintyvät haittavaikutukset, kuten päänsärky ja uupumus, voivat kuitenkin vaikuttaa kykyysi ajaa turvallisesti autoa ja käyttää turvallisesti koneita.
Sandostatin LAR sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Miten valmistetta käytetään
Sandostatin LAR on aina annettava pistoksena pakaralihakseen. Toistuvassa käytössä lääke on annettava vuorotellen vasempaan ja oikeaan pakaraan.
Jos käytät enemmän Sandostatin LAR -valmistetta kuin sinun pitäisi
Sandostatin LAR ‑valmisteen yliannostuksen ei ole ilmoitettu aiheuttaneen henkeä uhkaavia reaktioita.
Yliannostuksen oireita ovat kuumat aallot, tiheä virtsaamistarve, uupumus, masentuneisuus, ahdistuneisuus ja keskittymisvaikeudet.
Jos epäilet saaneesi yliannostuksen ja sinulla on tällaisia oireita, ota heti yhteys lääkäriin.
Jos unohdat käyttää Sandostatin LAR ‑valmistetta
Jos pistos unohtuu, on suositeltavaa, että se annetaan heti, kun asia muistetaan. Tämän jälkeen jatketaan tavanomaiseen tapaan. Jos annos annetaan muutaman päivän myöhässä, tästä ei ole mitään haittaa. Jotkin oireet voivat kuitenkin uusiutua tilapäisesti, kunnes hoitoaikataulu palaa normaaliksi.
Jos lopetat Sandostatin LAR -valmisteen käytön
Oireet saattavat uusiutua, jos keskeytät Sandostatin LAR ‑hoidon. Älä siis lopeta Sandostatin LAR ‑valmisteen käyttöä, ellei lääkäri kehota sinua tekemään niin.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Jotkin haittavaikutukset saattavat olla vakavia. Kerro heti lääkärille, jos sinulle kehittyy jotakin seuraavista:
Hyvin yleiset (voi esiintyä yli 1 käyttäjällä 10:stä):
- Sappikivet, jotka aiheuttavat äkillistä selkäkipua.
- Liian suuret verensokeriarvot.
Yleiset (voi esiintyä enintään 1 käyttäjällä 10:stä):
- Kilpirauhasen vajaatoiminta (hypotyreoosi), joka vaikuttaa syketiheyteen, ruokahaluun ja painoon ja aiheuttaa uupumusta, kylmän tunnetta tai turvotusta kaulan etuosassa.
- Muutokset kilpirauhasen toimintakokeissa.
- Sappirakkotulehdus (kolekystiitti), jonka oireita voivat olla ylävatsan oikean puolen kipu, kuume, pahoinvointi, kellertävä iho ja silmät (keltatauti).
- Liian pienet verensokeriarvot.
- Heikentynyt glukoosinsieto
- Hidas sydämen syke.
Melko harvinaiset (voi esiintyä enintään 1 käyttäjällä 100:sta):
- Jano, niukka virtsaneritys, virtsan tummuus, ihon kuivuus ja punakkuus.
- Nopea sydämen syke.
Muut vakavat haittavaikutukset
- Yliherkkyysreaktiot (allergiset reaktiot), mm. ihottuma.
- Allerginen reaktio (anafylaksia), joka voi aiheuttaa nielemis- tai hengitysvaikeuksia, turvotusta ja kihelmöintiä, huimausta tai tajunnanmenetyksen, mihin saattaa liittyä verenpaineen lasku.
- Haimatulehdus (pankreatiitti), jonka oireita voivat olla äkillinen ylävatsakipu, pahoinvointi, oksentelu, ripuli.
- Maksatulehdus, jonka oireena voi olla ihon ja silmien keltaisuus, pahoinvointi, oksentelu, ruokahaluttomuus, yleinen sairaudentunne, kutina, virtsan vaaleus.
- Sydämen rytmihäiriöt.
- Verihiutaleiden määrän väheneminen veressä, mikä saattaa lisätä verenvuotoa tai mustelmia.
Kerro heti lääkärille, jos huomaat jonkin edellä mainituista haittavaikutuksista.
Muut haittavaikutukset
Kerro lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle, jos huomaat jonkin seuraavista haittavaikutuksista. Ne ovat yleensä lieviä ja häviävät, kun hoitoa jatketaan.
Hyvin yleiset (voi esiintyä yli 1 käyttäjällä 10:stä):
- Ripuli
- Vatsakipu
- Pahoinvointi
- Ummetus
- Ilmavaivat
- Päänsärky
- Pistoskohdan paikallinen kipu.
Yleiset (voi esiintyä enintään 1 käyttäjällä 10:stä):
- Mahavaivat aterian jälkeen
- Oksentelu
- Mahan täysinäisyyden tunne
- Ulosteiden rasvaisuus
- Ulosteiden löysyys
- Ulosteiden värimuutokset
- Huimaus
- Ruokahaluttomuus
- Muutokset maksan toimintakokeissa
- Hiustenlähtö
- Hengenahdistus.
- Heikotus.
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, sairaanhoitajalle tai apteekkihenkilökunnalle.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Säilytä jääkaapissa (2°C –8 °C). Ei saa jäätyä.
Sandostatin LAR -valmistetta voidaan säilyttää alle 25 °C:n asteen lämpötilassa injektiopäivänä.
Valmistetta ei saa säilyttää käyttökuntoon saattamisen jälkeen (käytettävä heti).
Älä käytä tätä lääkettä etiketissä ja pahvikotelossa mainitun viimeisen käyttöpäivämäärän ”EXP” jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Älä käytä tätä lääkettä, jos huomaat siinä hiukkasia tai värimuutoksia.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Sandostatin LAR sisältää
- Vaikuttava aine on oktreotidi. Yksi injektiopullo sisältää oktreotidiasetaattia vastaten 10 mg, 20 mg tai 30 mg oktreotidia.
- Muut aineet ovat:injektiokuiva-aine (injektiopullossa): poly(DL-laktidi-ko-glykolidi), mannitoli (E421).liuotin (esitäytetyssä ruiskussa): karmelloosinatrium, mannitoli (E421), poloksameeri 188 ja injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoot
Yksikköpakkaus sisältää yhden lasisen, bromobutyylikumitulpallisen 6 ml:n injektiopullon, joka on sinetöity alumiinisella repäisysinetillä ja joka sisältää injektiokuiva-aineen suspensiota varten, sekä yhden värittömän, esitäytetyn, lasisen 3 ml:n ruiskun, joka sisältää 2 ml liuotinta ja on suljettu kahdella klorobutyylikumitulpalla (toinen ruiskun etuosassa ja toinen männän yhteydessä). Injektiopullon ja esitäytetyn ruiskun lisäksi pakkaus sisältää yhden injektiopulloadapterin sekä yhden turvainjektioneulan. Kaikki komponentit on pakattu sinetöityyn läpipainopakkaukseen.
Kaikkia vahvuuksia ja pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
Novartis Finland Oy
Revontulenkuja 1
02100 Espoo
Valmistaja
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Saksa
Novartis Farmacéutica S.A.
Gran Via de les Corts Catalanes, 764
08013 Barcelona
Espanja
Tämä pakkausseloste on tarkistettu viimeksi 8.12.2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Lääkealan turvallisuus‐ ja kehittämiskeskus Fimean verkkosivuilla http://www.fimea.fi.
Ohjeet terveydenhuollon ammattilaiselle
Sandostatin LAR -valmisteen annos
Akromegalia
On suositeltavaa aloittaa hoito antamalla 20 mg Sandostatin LAR ‑valmistetta 4 viikon välein 3 kuukauden ajan. Jos potilasta on hoidettu ihon alle annettavalla Sandostatin-valmisteella, Sandostatin LAR ‑hoito voidaan aloittaa viimeistä ihon alle annettavaa Sandostatin-annosta seuraavana päivänä. Myöhempien annosmuutosten on perustuttava kasvuhormonin (GH) ja insuliinin kaltaisen kasvutekijä I:n/somatomediini C:n (IGF-1) pitoisuuksiin seerumissa sekä kliinisiin oireisiin.
Jos potilaan kliinisiä oireita ja biokemiallisia parametreja (GH, IGF-1) ei saada täysin hallintaan tämän 3 kuukauden jakson aikana (GH-pitoisuus edelleen yli 2,5 mikrog/l), annosta voidaan suurentaa 30 milligrammaan 4 viikon välein. Mikäli GH- ja IGF-1-pitoisuuksia ja/tai oireita ei ole saatu riittävästi hallintaan, kun 30 mg:n annosta on käytetty 3 kuukauden ajan, annos voidaan suurentaa 40 milligrammaan 4 viikon välein.
Jos potilaan GH-pitoisuus on johdonmukaisesti alle 1 mikrog/l, seerumin IGF-1-pitoisuus on normalisoitunut ja suurin osa akromegalian korjautuvista oireista ja löydöksistä on hävinnyt, kun potilasta on hoidettu 3 kuukauden ajan 20 mg:n annoksella, hänelle voidaan antaa 10 mg Sandostatin LAR ‑valmistetta 4 viikon välein. Etenkin tässä potilasryhmässä on kuitenkin suositeltavaa seurata tarkoin, pysyvätkö seerumin GH- ja IGF-1-pitoisuudet sekä kliiniset oireet ja löydökset asianmukaisesti hallinnassa kyseisellä pienellä Sandostatin LAR ‑annoksella.
Jos potilas saa vakaa-annoksista Sandostatin LAR ‑hoitoa, GH- ja IGF-1-pitoisuudet on määritettävä 6 kuukauden välein.
Gastroenteropankreaattiset endokriiniset kasvaimet
- Toiminnallisiin gastroenteropankreaattisiin neuroendokriinisiin kasvaimiin liittyvien oireiden hoito
On suositeltavaa aloittaa hoito antamalla 20 mg Sandostatin LAR ‑valmistetta 4 viikon välein. Jos potilasta on hoidettu ihon alle annettavalla Sandostatin-valmisteella, ihon alle annettavaa hoitoa jatketaan aiemmalla tehokkaalla annostuksella 2 viikon ajan ensimmäisen Sandostatin LAR ‑injektion jälkeen.
Jos potilaan oireet ja biomarkkeriarvot ovat hyvin hallinnassa 3 hoitokuukauden jälkeen, annosta voidaan pienentää 10 milligrammaan Sandostatin LAR ‑valmistetta 4 viikon välein.
Jos potilaan oireet ovat vain osittain hallinnassa 3 hoitokuukauden jälkeen, annosta voidaan suurentaa 30 milligrammaan Sandostatin LAR ‑valmistetta 4 viikon välein.
Päivinä, joina gastroenteropankreaattisiin kasvaimiin liittyvät oireet saattavat voimistua Sandostatin LAR ‑hoidon aikana, on suositeltavaa antaa lisäksi Sandostatin-valmistetta ihon alle ennen Sandostatin LAR ‑hoitoa käytetyllä annoksella. Ilmiötä voi esiintyä etenkin ensimmäisten kahden hoitokuukauden aikana, kunnes oktreotidin hoitopitoisuudet saavutetaan.
- Pitkälle edenneiden neuroendokriinisten kasvainten hoito, kun kasvain on saanut alkunsa keskisuolesta tai sen primaarisijainti on tuntematon mutta keskisuolen ulkopuolinen primaarisijainti on suljettu pois.
Suositeltava Sandostatin LAR ‑annos on 30 mg 4 viikon välein. Kasvaimen kasvun hillitsemiseen käytettävää Sandostatin LAR ‑hoitoa on jatkettava, ellei kasvain ole edennyt.
Tyreotropiinia erittävien adenoomien hoito
Sandostatin LAR ‑hoito aloitetaan antamalla 20 mg:n annoksia 4 viikon välein 3 kuukauden ajan ennen kuin annosmuutoksia harkitaan. Tämän jälkeen annosta muutetaan tyreotropiini- ja kilpirauhashormonivasteen perusteella.
Ohjeet Sandostatin LARin käyttökuntoon saattamista ja lihakseen pistämistä varten
AINOASTAAN SYVÄLLE LIHAKSEEN PISTETTÄVÄKSI
Pakkauksen sisältö:
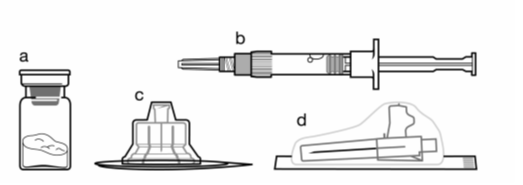
a. Sandostatin LAR injektiokuiva-aineen sisältävä injektiopullo,
b. Liuottimen sisältävä esitäytetty ruisku,
c. Injektiopullon adapteri lääkkeen sekoittamisvaihetta varten,
d. Yksi turvainjektioneula.
Noudata huolellisesti alla annettuja ohjeita varmistaaksesi Sandostatin LAR-valmisteen käyttökuntoon saattamisen oikealla tavalla ennen injektiota syvälle lihakseen.
Sandostatin LARin käyttökuntoon saattamisessa on kolme ratkaisevaa vaihetta. Niiden noudattamatta jättäminen voi johtaa lääkkeen annon epäonnistumiseen.
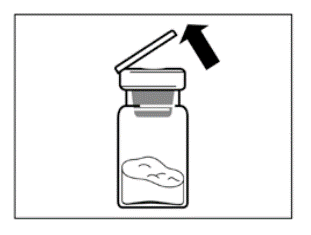
- Pakkauksen tulee lämmetä huoneenlämpöiseksi. Ota pakkaus jääkaapista ja anna sen olla huoneenlämmössä vähintään 30 minuuttia ennen käyttökuntoon saattamista, mutta älä ylitä 24 tuntia.
- Anna injektiopullon seistä 5 minuuttia liuottimen lisäämisen jälkeen varmistaaksesi, että kuiva-aine on kunnolla kostunut.
- Kostuttamisen jälkeen, ravista injektiopulloa maltillisesti vaakasuunnassa vähintään 30 sekuntia kunnes muodostuu tasainen suspensio. Sandostatin LAR -suspensio on valmistettava vasta juuri ennen käyttöä.
Sandostatin LAR -injektion saa antaa vain koulutettu terveydenhuollon ammattilainen.
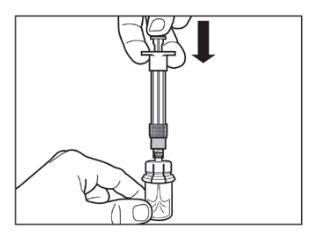
Vaihe 1
HUOM: On tärkeää, että aloitat käyttökuntoon saattamisen vasta kun pakkaus on huoneenlämpöinen. Anna pakkauksen olla huoneenlämmössä vähintään 30 minuuttia ennen käyttökuntoon saattamista, mutta älä ylitä 24 tuntia. Huomaa, että pakkaus voidaan tarvittaessa laittaa takaisin jääkaappiin. | 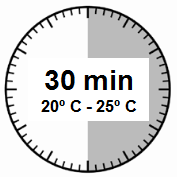 |
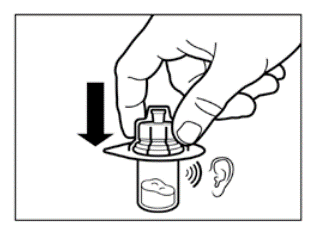
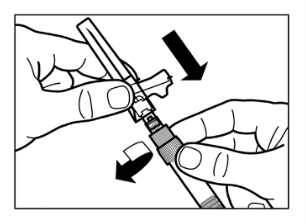
Vaihe 2
|
|
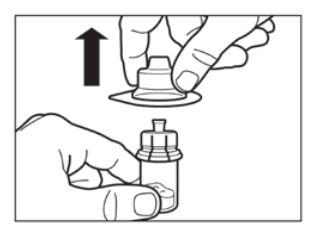
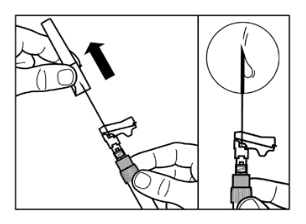
Vaihe 3
|
|
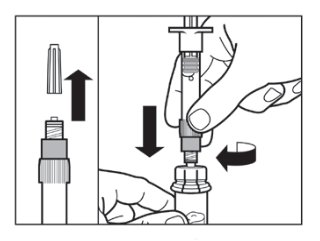
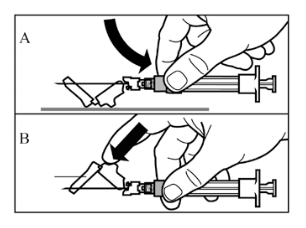
Vaihe 4 HUOM: On tärkeää, että annat injektiopullon seistä 5 minuuttia varmistaaksesi, että liuotin on täysin kostuttanut kuiva-aineen. Huomaa, että on täysin normaalia, jos ruiskun mäntä lähtee nousemaan hieman ylöspäin, sillä pullossa saattaa olla lievä ylipaine.
| 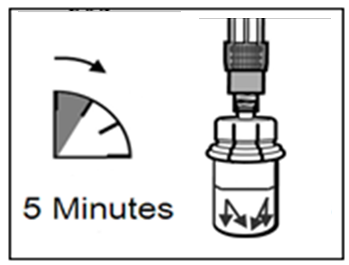 |
Vaihe 5
| 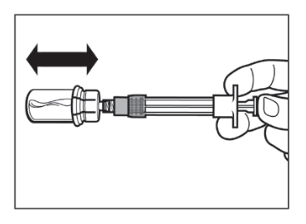 |
Vaihe 6
| 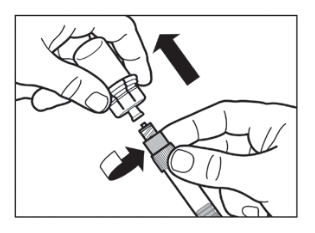 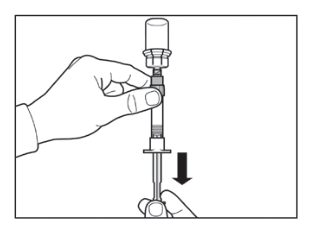 |
Vaihe 7
|
|
Vaihe 8
| 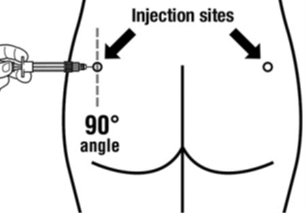 |
Vaihe 9
|
|