Pakkausseloste
NEVANAC silmätipat, suspensio 3 mg/ml
NEVANAC 3 mg/ml silmätipat, suspensio
nepafenaakki
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä NEVANAC on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät NEVANAC-valmistetta
3. Miten NEVANAC-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. NEVANAC-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
NEVANAC sisältää vaikuttavana aineena nepafenaakkia ja kuuluu tulehduskipulääkkeiden lääkeryhmään.
NEVANAC on tarkoitettu käytettäväksi aikuisilla
- estämään ja vähentämään silmän kipua ja tulehdusta kaihileikkauksen jälkeen
- ehkäisemään kaihileikkauksen jälkeistä makulaturvotuksen (turvotus silmän takaosassa) esiintymistä diabetesta sairastavilla potilailla.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä NEVANAC-valmistetta
- jos olet allerginen nepafenaakille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos olet allerginen jollekin muulle tulehduskipulääkkeelle
- jos sinulle on ilmaantunut astma, ihoyliherkkyys tai voimakas nenän tulehdus, kun olet käyttänyt muita tulehduskipulääkkeitä. Tulehduskipulääkkeitä ovat esimerkiksi asetyylisalisyylihappo, ibuprofeeni, ketoprofeeni, piroksikaami ja diklofenaakki.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät NEVANAC-valmistetta:
- jos saat helposti mustelmia tai verenvuotoja tai jos sinulla on ollut näitä ongelmia aikaisemmin
- jos sinulla on jokin muu silmäsairaus (esim. silmätulehdus) tai jos käytät muita silmälääkkeitä (eritoten paikallisesti käytettäviä steroidivalmisteita)
- jos sinulla on diabetes
- jos sinulla on nivelreuma
- jos sinulle on tehty useita silmäleikkauksia lyhyen ajan sisällä.
Vältä auringonvaloa NEVANAC-hoidon aikana.
Piilolinssien käyttämistä ei suositella kaihileikkauksen jälkeen. Lääkärisi kertoo, milloin voit aloittaa piilolinssien käytön uudelleen leikkauksen jälkeen (katso myös ”NEVANAC sisältää bentsalkoniumkloridia” -kohta).
Lapset ja nuoret
Tätä lääkettä ei saa antaa lapsille ja nuorille, jotka eivät ole vielä täyttäneet 18 vuotta, koska lääkkeen turvallisuutta ja tehoa lasten ja nuorten hoidossa ei ole varmistettu.
Muut lääkevalmisteet ja NEVANAC
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
NEVANAC voi vaikuttaa muihin käyttämiisi lääkkeisiin, mm. muihin glaukooman hoitoon käytettyihin silmätippoihin, tai nämä muut lääkkeet voivat vaikuttaa NEVANACiin.
Kerro lääkärille myös, jos käytät veren hyytymistä vähentävää lääkitystä (varfariinia) tai muita tulehduskipulääkkeitä. Ne voivat lisätä verenvuodon riskiä.
Raskaus ja imetys
Jos olet raskaana tai voit tulla raskaaksi, kysy lääkäriltä neuvoa ennen NEVANAC-valmisteen käyttöä. Naisten, jotka voivat tulla raskaaksi, suositellaan käyttävän tehokasta ehkäisyä NEVANAC-hoidon ajan. NEVANAC-valmistetta ei suositella käytettävän raskauden aikana. NEVANAC-valmistetta ei tule käyttää ellei lääkäri erityisesti neuvo sitä käyttämään.
Jos imetät, saattaa NEVANAC-valmistetta joutua äidinmaitoon. NEVANAC-valmisteen ei kuitenkaan odoteta vaikuttavan imetettävään vauvaan. NEVANAC-valmistetta voidaan käyttää imetyksen aikana.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
Älä aja äläkä käytä koneita, ennen kuin näkösi kirkastuu. Voi olla mahdollista, että näkösi sumenee hetkeksi sen jälkeen, kun olet ottanut NEVANAC-valmistetta.
NEVANAC sisältää bentsalkoniumkloridia
Tämä lääkevalmiste sisältää bentsalkoniumkloridia 0,15 mg per 3 ml, joka vastaa 0,05 mg/ml.
NEVANAC-silmätippojen sisältämä säilöntäaine, bentsalkoniumkloridi, saattaa imeytyä pehmeisiin piilolinsseihin ja voi muuttaa niiden väriä. Poista piilolinssit ennen tämän lääkevalmisteen käyttöä ja laita piilolinssit takaisin 15 minuutin kuluttua. Bentsalkoniumkloridi voi aiheuttaa silmä-ärsytystä erityisesti, jos sinulla on kuivat silmät tai sarveiskalvon sairauksia (silmän etuosan läpinäkyvä kerros). Jos silmääsi tulee poikkeavaa tunnetta, pistelyä tai kipua tämän lääkkeen käytön jälkeen, keskustele asiasta lääkärisi kanssa.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
NEVANAC-valmistetta tulee käyttää vain silmiin. Sitä ei saa niellä tai antaa ruiskeena.
Suositeltu annos on
Yksi tippa sairaaseen silmään tai kumpaankin sairaaseen silmään kerran päivässä. Käytä lääkettä samaan aikaan joka päivä.
Milloin lääkettä tulee ottaa ja miten pitkään
Aloita hoito päivää ennen kaihileikkausta. Jatka hoitoa leikkauspäivänä. Käytä lääkettä tämän jälkeen niin kauan kuin lääkärisi on määrännyt. Tämä aika voi olla enintään kolme viikkoa (silmäkivun ja tulehduksen ehkäisyyn ja hoitoon) tai 60 päivää (makulaturvotuksen ehkäisyyn ja näön parantamiseen) leikkauksen jälkeen.
Käyttöohje
Pese kätesi ennen kuin aloitat.
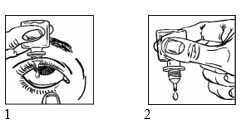
- Ravista hyvin ennen käyttöä.
- Käännä suljettu pullo ylösalaisin ja ravista sitä kerran ennen jokaista käyttökertaa. Kierrä korkki irti pullosta.
- Jos turvasinetin sisältävä irrotuskaulus on käytössä ja se on löysällä, kun olet poistanut korkin, irrota kaulus ennen valmisteen käyttämistä.
- Pidä pulloa sormiesi välissä niin, että pullon kärki osoittaa alaspäin.
- Taivuta päätäsi takakenoon.
- Vedä sormella alaluomea alaspäin, kunnes muodostuu “tasku” silmäluomen ja silmän väliin. Silmätipan kuuluu osua tähän taskuun (kuva 1).
- Tuo pullon tippakärki lähelle silmää. Voit tehdä tämän tarvittaessa peilin edessä, jos siitä on apua.
- Älä kosketa tippakärjellä silmää, silmäluomia äläkä silmän ympäristöä tai muita pintoja. Tämä voi saastuttaa silmätipat.
- Paina kevyesti pulloa sivuilta, kunnes silmään tippuu yksi tippa (kuva 2).
Jos tiputat lääkettä molempiin silmiin, toista em. kohdat toisen silmän kohdalla. Pulloa ei tarvitse sulkea ja ravistella ennen tipan tiputtamista toiseen silmään. Sulje korkki tiiviisti heti käytön jälkeen.
Jos tippa ei osu silmään, yritä uudelleen.
Jos käytät myös muita silmätippoja, odota vähintään 5 minuuttia NEVANAC‑tippojen ja muiden silmätippojen annostelun välillä.
Jos käytät enemmän NEVANAC-valmistetta kuin sinun pitäisi
Ota yhteyttä lääkäriin lisäohjeiden saamiseksi. Älä tiputa lisää tippoja silmään ennen kuin on seuraavan lääkkeenoton aika.
Jos unohdat käyttää NEVANAC-valmistetta
Ota kerta‑annos heti kun huomaat unohduksen. Jos seuraavan annoksen aika on pian, jätä unohtunut annos kokonaan väliin ja jatka seuraavalla annoksella normaalisti. Älä ota kaksinkertaista annosta korvataksesi unohtamasi kerta-annoksen. Älä käytä enempää kuin yksi tippa sairaaseen silmään / sairaisiin silmiin päivässä.
Jos lopetat NEVANAC-valmisteen käytön
NEVANAC-valmisteen käyttöä ei saa lopettaa neuvottelematta ensin lääkärin kanssa. Tippojen käyttämistä voi yleensä jatkaa, ellet koe vakavia haittavaikutuksia.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Sarveiskalvoon kohdistuvien haittavaikutusten (silmän pinnan ongelmien) vaara saattaa olla suurentunut seuraavissa tilanteissa:
- vaativa silmäleikkaus
- toistuvia silmäleikkauksia lyhyen ajan kuluessa
- potilas kärsii tietyistä silmän pinnan häiriöistä, kuten tulehduksesta tai kuivasilmäisyydestä
- potilaalla on tietty yleissairaus, kuten diabetes tai nivelreuma.
Jos silmäsi tulevat punaisemmiksi tai kivuliaammiksi, kun käytät tippoja, ota heti yhteys lääkäriisi. Tämä voi aiheutua silmän pinnan tulehduksesta, johon saattaa liittyä silmässä olevien solujen tuhoutuminen tai vaurioituminen, tai silmän värillisen osan tulehduksesta (iriitistä). Näitä haittavaikutuksia on havaittu enintään yhdellä ihmisellä sadasta.
Seuraavia haittavaikutuksia on havaittu NEVANAC 3 mg/ml ‑suspension tai NEVANAC 1 mg/ml ‑suspension tai molempien valmisteiden käytön yhteydessä:
Melko harvinaiset (nämä voivat koskea korkeintaan yhtä ihmistä 100:sta)
- Silmään kohdistuvat haittavaikutukset: silmän pinnan tulehdus, johon joko liittyy tai ei liity soluvaurio tai ‑kato, vierasesineen tunne silmässä, silmäluomen reunan karstoittuminen tai riippuluomi.
Harvinaiset (nämä voivat koskea korkeintaan yhtä ihmistä 1 000:sta)
- Silmään kohdistuvat haittavaikutukset: värikalvotulehdus, silmäkipu, epämukavuuden tunne silmässä, kuivat silmät, silmäluomen turpoaminen, silmän ärsytys, silmän kutina, erite silmässä, allerginen sidekalvotulehdus (silmäallergia), lisääntynyt kyynelvuoto, hiukkasten kertyminen silmän pinnalle, nesteen kertyminen tai turvotus silmän takaosassa, silmän punoitus.
- Koko elimistöön kohdistuvat haittavaikutukset: huimaus, päänsärky, allergiset oireet (silmäluomen allerginen turpoaminen), pahoinvointi, ihon tulehtuminen, punoitus tai kutina.
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)
- Silmään kohdistuvat haittavaikutukset: silmän pinnan vaurioituminen, kuten oheneminen tai puhkeaminen, heikentynyt silmän paraneminen, silmän pinnan arpi, samentuma, heikentynyt näkö, silmän turvotus, näön samentuminen.
- Koko elimistöön kohdistuvat haittavaikutukset: oksentelu, kohonnut verenpaine.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pullossa ja pakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä alle 25 °C. Pidä pullo ulkopakkauksessa. Herkkä valolle.
Tulehdusten välttämiseksi hävitä pullo, kun sen avaamisesta on kulunut 4 viikkoa. Kirjoita avaamispäivämäärä pakkauksen etikettiin sille varattuun kohtaan.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä NEVANAC sisältää
- Vaikuttava aine on nepafenaakki. 1 ml suspensiota sisältää 3 mg nepafenaakkia.
- Muut aineet ovat boorihappo, propyleeniglykoli, karbomeeri, natriumkloridi, guarkumi, karmelloosinatrium, dinatriumedetaatti, bentsalkoniumkloridi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä) ja puhdistettu vesi. Pieniä määriä natriumhydroksidia ja/tai suolahappoa lisätään, jotta valmisteen happamuus (pH‑taso) pysyy normaalina.
Lääkevalmisteen kuvaus ja pakkauskoko
NEVANAC-silmätipat, suspensio (silmätipat) on nestettä (suspensio, joka on väriltään vaaleankeltaisesta tummanoranssiin), joka toimitetaan kierrekorkillisessa muovipullossa. Pullo voi olla pussin sisällä.
Pakkaus sisältää yhden 3 ml:n pullon.
Myyntiluvan haltija
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irlanti
Valmistaja
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Belgia
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
Tämä pakkausseloste on tarkistettu viimeksi 21.1.2026
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu