Pakkausseloste
OSURNIA korvageeli 10 mg/10 mg/1 mg
ELÄINLÄÄKEVALMISTEEN NIMI
OSURNIA korvageeli koiralle
VAIKUTTAVAT JA MUUT AINEET
Yksi annos (1,2 g) sisältää:
Vaikuttavat aineet:
Terbinafiini (terbinafinum): 10 mg
Florfenikoli (florfenicolum): 10 mg
Beetametasoniasetaatti (betamethasoni acetas): 1 mg
vastaten beetametasoniemästä 0,9 mg
Apuaineet:
Butyylihydroksitolueeni (E321) 1 mg
Luonnonvalkoinen tai lievästi kellertävä läpikuultava geeli.
KÄYTTÖAIHEET
Akuutin ulkokorvatulehduksen ja akuutisti pahentuneen toistuvan ulkokorvatulehduksen hoito, kun aiheuttajina ovat Staphylococcus pseudintermedius ja Malassezia pachydermatis.
VASTA-AIHEET
Ei saa käyttää, jos tärykalvo on puhjennut.
Ei saa käyttää koirille, joilla on yleistynyt demodikoosi (Demodex-punkki).
Ei saa käyttää tiineillä eläimillä eikä siitoseläimillä.
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttaville aineille, muille kortikosteroideille tai apuaineille.
HAITTAVAIKUTUKSET
Koira:
Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): | Kuurousa, kuulon heikkeneminena
Annostelukohdan punoitus, annostelukohdan kipu, annostelukohdan kutina, annostelukohdan turvotus, annostelukohdan haavauma
Yliherkkyysreaktiot (esim. naaman turvotus, nokkosihottuma ja sokki)
Silmäsairaudet (esim. hermosyntyinen kuivasilmäisyys, kuivasilmäisyys, sarveiskalvon haavauma, luomikouristus, silmien punoitus ja silmävuoto)b
Haparoivat liikkeet, naaman halvaantuminen, silmävärve
Sisäkorvan häiriö (pääasiassa pään kallistus) |
a Tavallisesti väliaikaista ja pääasiassa ikääntyneillä eläimillä.
b Ks. myös kohta ”Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla”.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta:
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
www-sivusto: https://www.fimea.fi/elainlaakkeet/
KOHDE-ELÄINLAJI
Koira.
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Korvaan. Annostele yhden tuubin sisältö kuhunkin tulehtuneeseen korvaan. Toista hoito 7 vuorokauden kuluttua. Maksimaalinen hoitovaste saavutetaan mahdollisesti vasta 21 vuorokauden kuluttua toisesta hoitokerrasta.
1. Avaa tuubi kiertämällä pehmeä kärki irti.
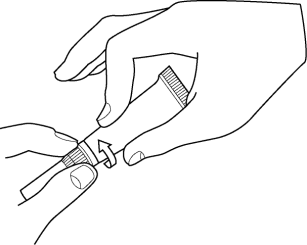
2. Työnnä joustava pehmeä kärki korvakäytävään.
3. Annostele eläinlääke korvakäytävään painamalla tuubia kahdella sormella.
4. Annostelun jälkeen korvan tyveä voi hieroa lyhyesti ja hellävaraisesti, jotta lääkevalmiste leviää tasaisesti korvakäytävään.
ANNOSTUSOHJEET
Ennen eläinlääkkeen käyttöä ulompi korvakäytävä on tutkittava perusteellisesti ja varmistettava, ettei tärykalvo ole puhjennut.
Puhdista korvat ennen ensimmäistä hoitokertaa. Korvat saa puhdistaa uudelleen aikaisintaan 21 vuorokautta toisen hoitokerran jälkeen. Kliinisissä tutkimuksissa korvat puhdistettiin pelkästään natriumkloridiliuoksella.
Jos eläinlääkkeen käyttö lopetetaan, korvakäytävät on puhdistettava ennen muun lääkevalmisteen käyttöä.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Säilytä jääkaapissa (2 °C – 8 °C).
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu etiketissä merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
ERITYISVAROITUKSET
Erityisvaroitukset:
Puhdista korvat ennen ensimmäistä hoitokertaa. Korvat saa puhdistaa uudelleen aikaisintaan 21 vuorokautta toisen hoitokerran jälkeen. Kliinisissä tutkimuksissa korvat puhdistettiin pelkästään natriumkloridiliuoksella.
Ohimenevää märkyyttä on todettu korvalehden sisä- ja ulkopinnoilla. Tämän oletetaan johtuvan valmisteen käytöstä, eikä sillä ole kliinistä merkitystä.
Bakteerien ja sienten aiheuttama korvatulehdus on usein sekundaarinen. Asianmukainen diagnoosi on tehtävä ja taustalla olevien syiden hoito selvitettävä ennen kuin mikrobilääkitystä harkitaan.
Eläinlääkkeen teho saattaa muuttua eläimillä, joilla on aiemmin ollut krooninen tai toistuva ulkokorvantulehdus, mikäli ei huomioida sairauden taustalla olevia syitä, kuten allergiaa tai korvan anatomista muotoa.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Jos yliherkkyyttä jollekin ainesosalle ilmenee, korva on pestävä huolellisesti.
Eläinlääkkeen turvallisuutta alle 2 kuukauden ikäisten tai alle 1,4 kg:n painoisten koirien hoidossa ei ole selvitetty.
Eläinlääkkeen käytön on perustuttava infektion aiheuttavien organismien tunnistamiseen ja herkkyysmääritykseen mahdollisuuksien mukaan.
Pakkausselosteessa annetuista ohjeista poikkeava käyttö saattaa lisätä florfenikolille vastustuskykyisten bakteereiden ja terbinafiinille vastustuskykyisten sienten esiintymistä ja heikentää muiden antibioottien ja sienilääkkeiden tehoa.
Jos kyseessä on ulkoloisten aiheuttama korvatulehdus, on aloitettava asianmukainen punkkien häätöön soveltuva hoito.
Ennen eläinlääkkeen käyttöä ulompi korvakäytävä on tutkittava perusteellisesti ja varmistettava, ettei tärykalvo ole puhjennut.
Kortikosteroideja sisältävien paikallishoitovalmisteiden pitkäaikaisen ja intensiivisen käytön on todettu aiheuttavan systeemisiä vaikutuksia, esimerkiksi heikentävän lisämunuaisten toimintaa (ks. kohta ”Yliannostus”).
Siedettävyystutkimuksissa havaittiin pienentyneitä kortisolipitoisuuksia valmisteen annon jälkeen (ennen ACTH-stimulaatiota ja sen jälkeen). Tämä viittaa siihen, että beetametasoni imeytyy verenkiertoon. Löydös ei korreloinut patologisten tai kliinisten oireiden kanssa, ja se oli palautuva.
Muiden kortikosteroidien samanaikaista käyttöä pitää välttää.
Käytettävä varoen koirille, joilla epäillään olevan tai on todettu umpierityssairaus (esim. diabetes mellitus, kilpirauhasen vajaa- tai liikatoiminta, jne.).
Eläinlääke voi ärsyttää silmiä. Vältä valmisteen joutumista koiran silmiin. Jos valmistetta joutuu vahingossa silmiin, niitä pitää huuhdella runsaalla vedellä 10–15 minuutin ajan. Jos kliinisiä merkkejä kehittyy, ota yhteys eläinlääkäriin.
Omistajia tulee kehottaa tarkkailemaan eläintä silmäoireiden (kuten silmien siristys, punoitus tai silmäerite) varalta valmisteen antoa seuraavien tuntien ja päivien ajan ja viipymättä ottamaan yhteyttä eläinlääkäriin, jos tällaisia merkkejä ilmenee. Katso kohdasta ”Haittatapahtumat” lisätietoja koirien silmien haittatapahtumista.
Tämän eläinlääkkeen turvallisuutta ja tehoa kissoille ei ole arvioitu. Valmisteen markkinoille tulon jälkeinen seuranta osoittaa, että eläinlääkkeen käyttöön kissoille voi liittyä hermosto-oireita (mukaan lukien Hornerin oireyhtymä ja siihen liittyvä vilkkuluomen esiintulo, silmien pienet mustuaiset, silmien mustuaisten erikokoisuus sekä sisäkorvan häiriöt ja niihin liittyvä liikkeiden haparoivuus ja pään pitäminen kallellaan) ja systeemisiä oireita (ruokahaluttomuus ja uneliaisuus). Tämän eläinlääkkeen käyttöä kissoille pitää siksi välttää.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Eläinlääke voi ärsyttää silmiä. Valmistetta voi vahingossa joutua silmiin, jos koira ravistelee päätään valmistetta annettaessa tai heti sen jälkeen. Omistajiin kohdistuvan riskin välttämiseksi suositellaan, että tämän eläinlääkkeen antaa vain eläinlääkäri tai että anto tapahtuu eläinlääkärin tarkassa valvonnassa. Sopivat varotoimet (kuten suojalasien käyttö eläinlääkettä annettaessa, korvakäytävän huolellinen hieronta annon jälkeen, jotta valmiste leviäisi tasaisesti, koiran pitäminen paikallaan annon jälkeen) ovat tarpeen, jotta vältettäisiin valmisteen joutuminen silmiin.
Jos valmistetta joutuu vahingossa silmiin, niitä pitää huuhdella runsaalla vedellä 10–15 minuutin ajan. Jos oireita ilmenee, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Jos valmistetta vahingossa joutuu ihollesi, pese alue runsaalla vedellä.
Jos ihminen vahingossa nielee valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Tiineys ja laktaatio:
Laboratoriotutkimuksissa tutkituilla lajeilla on löydetty näyttöä beetametasoniin liittyvistä, epämuodostumia aiheuttavista vaikutuksista.
Eläinlääkkeen turvallisuutta tiineyden ja laktaation aikana ei ole selvitetty tiineillä ja imettävillä nartuilla. Ei saa käyttää tiineyden ja laktaation aikana.
Hedelmällisyys:
Ei saa käyttää siitoseläimillä.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Yhteensopivuutta muiden korvanpuhdistusvalmisteiden, paitsi natriumkloridiliuoksen, kanssa ei ole osoitettu.
Yliannostus:
Pitkäaikainen tai tiheä eläinlääkkeen käyttö voi aiheuttaa tärykalvon pintasolukon rakkuloita tai välikorvan limakalvon haavaumia. Nämä löydökset eivät vaikuta kuuloon, ja ne ovat palautuvia.
Kortikosteroideja sisältävien paikallishoitovalmisteiden pitkäaikaisen ja intensiivisen käytön on todettu aiheuttavan systeemisiä vaikutuksia, esimerkiksi estävän lisämunuaisten toimintaa.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
24.10.2025
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary).
MUUT TIEDOT
Eläinlääke on yhdistelmävalmiste sisältäen kolmea vaikuttavaa ainetta: antibioottia, sienilääkettä ja kortikosteroidia.
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Dechra Regulatory B.V.
Handelsweg 25
5531 AE Bladel
Alankomaat
+31 348 563 434
Erän vapauttamisesta vastaava valmistaja:
Argenta Dundee Limited
Kinnoull Road
Dunsinane Industrial Estate
Dundee DD2 3XR
Iso-Britannia
Genera d.d.
Svetonedeljska cesta 2
Kalinovica
10436 Rakov Potok
Kroatia