Pakkausseloste
VABYSMO injektioneste, liuos 120 mg/ml
Vabysmo 120 mg/ml injektioneste, liuos
farisimabi
Lisäseuranta
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Ks. kohdan Mahdolliset haittavaikutukset lopusta, miten haittavaikutuksista ilmoitetaan.
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Pakkausselosteen lisäksi saat lääkäriltä potilasoppaan, jossa on tärkeitä turvallisuutta koskevia tietoja. Niistä saat tietoa Vabysmo-valmisteeseen liittyvistä hyödyistä ja riskeistä sekä toimenpiteistä, joihin sinun on ryhdyttävä, jos sinulla ilmenee tiettyjä oireita.
Tässä pakkausselosteessa kerrotaan
1. Mitä Vabysmo on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat Vabysmo-valmistetta
3. Miten Vabysmo-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. Vabysmo-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Vabysmo on ja mihin sitä käytetään
Vabysmo sisältää vaikuttavana aineena farisimabia, joka kuuluu uudissuonittumista estävien lääkeaineiden ryhmään.
Lääkäri antaa Vabysmo-pistoksen silmään seuraavien silmäsairauksien hoitoon aikuisilla:
- kostea silmänpohjan ikärappeuma
- diabeettisesta makulaturvotuksesta aiheutuva näkökyvyn heikkeneminen
- verkkokalvon laskimotukoksesta (verkkokalvon haaralaskimotukos tai verkkokalvon keskuslaskimotukos) johtuvan makulaturvotuksen aiheuttaman näkökyvyn heikkeneminen.
Nämä sairaudet vaikuttavat verkkokalvon (silmän takaosan valoa aistiva kerros) keskiosaan eli makulaan, jossa on keskeinen tarkan näön keskus. Kostea silmänpohjan ikärappeuma aiheutuu poikkeavien verisuonten kasvusta. Niistä vuotaa makulaan verta ja nestettä. Diabeettinen makulaturvotus aiheutuu verisuonten vuotamisesta, mikä aiheuttaa makulan turpoamisen. Verkkokalvon keskuslaskimotukos on verta pois verkkokalvosta kuljettavan pääasiallisen verisuonen tukos, ja verkkokalvon haaralaskimotukos on puolestaan pääverisuonen yhden pienemmän haaran tukos. Näissä verisuonissa noussut paine aiheuttaa nesteen vuotamista verkkokalvoon, jolloin makula turpoaa (makulaturvotus).
Miten Vabysmo vaikuttaa
Vabysmo tunnistaa spesifisesti angiopoietiini-2- ja verisuonen endoteelitekijä A -nimiset valkuaisaineet ja sitoutuu niihin. Kun näitä valkuaisaineita on normaalia enemmän, ne voivat aiheuttaa poikkeavien verisuonten kasvua ja/tai ne voivat vaurioittaa normaaleja verisuonia, jolloin ne vuotavat makulaan ja aiheuttavat sen turpoamisen tai vaurioitumisen, mikä puolestaan heikentää henkilön näkökykyä. Vabysmo voi näihin valkuaisaineisiin kiinnittymällä estää niiden toimintaa ja ehkäistä poikkeavien verisuonten kasvua, vuotamista ja siten turvotusta. Vabysmo voi lievittää näitä sairauksia ja/tai hidastaa niiden pahenemista ja siten ylläpitää tai jopa parantaa näkökykyä.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Sinulle ei saa antaa Vabysmo-valmistetta
- jos olet allerginen farisimabille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on aktiivinen tai epäilty infektio silmässä tai silmän ympärillä
jos sinulla on kipua tai punoitusta silmässä (silmätulehdus).
Jos jokin edellä mainituista koskee sinua, kerro siitä lääkärille. Sinulle ei pidä antaa Vabysmo-valmistetta.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen Vabysmo-valmisteen saamista
- jos sinulla on silmänpainetauti eli glaukooma (silmäsairaus, joka tavallisesti aiheutuu korkeasta silmänpaineesta)
- jos sinulla on aiemmin ollut näkökentässä valonvälähdyksiä tai lasiaiskellujia (tummia kelluvia pilkkuja) ja jos lasiaiskellujien koko tai määrä on äkillisesti suurentunut
- jos olet ollut silmäleikkauksessa edeltävien 4 viikon aikana tai jos sinulle suunnitellaan silmäleikkausta seuraavien 4 viikon aikana
- jos sinulla on joskus ollut jokin silmäsairaus tai olet saanut silmään hoitoa.
Kerro lääkärille heti
- jos menetät äkillisesti näkökykysi
- jos sinulle kehittyy mahdollisen silmäinfektion tai -tulehduksen oireita, kuten lisääntynyttä silmän punoitusta, silmäkipua, lisääntynyttä epämukavuuden tunnetta silmässä, näkökyvyn sumenemista tai heikkenemistä, pienten hiukkasten määrän lisääntymistä näkökentässä, lisääntyvää valonarkuutta.
Sinun on lisäksi tärkeää olla tietoinen, että
- kummankin silmän samalla kertaa tehtävän Vabysmo-hoidon turvallisuutta ja tehoa ei ole tutkittu ja tällainen käyttö voi lisätä haittavaikutusten riskiä
- Vabysmo-pistoksista voi aiheutua joillekin potilaille tilapäistä silmänpaineen kohoamista 60 minuutin kuluessa pistoksesta. Lääkäri seuraa tätä jokaisen pistoksen jälkeen.
- lääkäri tarkistaa, onko sinulla muita riskitekijöitä, jotka voivat lisätä silmän takaosan kerrosten repeämän tai irtauman (verkkokalvon irtauman tai repeämän tai verkkokalvon pigmenttiepiteelin repeämän tai irtauman) todennäköisyyttä, jolloin Vabysmo-pistoksen antamisessa pitää olla varovainen.
Joidenkin Vabysmo-valmisteen kanssa samankaltaisesti vaikuttavien lääkkeiden käyttöön tiedetään liittyvän verisuonet tukkivien veritulppien riski (valtimotromboemboliset tapahtumat); ne voivat johtaa sydäninfarktiin tai aivohalvaukseen. Silmään annettavan Vabysmo-pistoksen jälkeen pieniä määriä lääkettä pääsee vereen, joten tällaisten tapahtumien riski on teoriassa mahdollinen.
Hoidosta seuraavissa tilanteissa on vain rajallisesti kokemusta:
- potilaat, joilla on aktiivisia infektioita
- potilaat, joilla on kostea silmänpohjan ikärappeuma tai verkkokalvon laskimotukos ja jotka ovat iältään 85-vuotiaita tai sitä vanhempia
- potilaat, joilla on tyypin I diabeteksesta johtuva diabeettinen makulaturvotus
- diabetespotilaat, joiden keskimääräinen verensokeriarvo on korkea (HbA1c yli 10 %)
- diabetespotilaat, joilla on diabeteksesta aiheutuva silmäsairaus nimeltään proliferatiivinen diabeettinen retinopatia
- diabetespotilaat, joilla on korkea verenpaine (yli 140/90 mmHg) ja verisuonitauti
- potilaat, joilla on diabeettista makulaturvotusta ja jotka saavat injektioita pitkään alle 8 viikon välein.
Potilaista, jotka saavat injektioita pitkään alle 8 viikon välein, on vain rajallisesti kokemusta, ja näillä potilailla saattaa olla tavanomaista suurempi haittavaikutusten riski.
Hoidosta seuraavassa tilanteessa ei ole kokemusta:
- potilaat, joilla on diabetes tai verkkokalvon laskimotukos ja joiden korkea verenpaine on huonossa hoitotasapainossa.
Jos jokin edellä mainituista koskee sinua, lääkäri huomioi näiden tietojen puuttumisen hoitaessaan sinua Vabysmo-valmisteella.
Lapset ja nuoret
Vabysmo-valmisteen käyttöä ei ole tutkittu lapsilla eikä nuorilla, koska kosteaa silmänpohjan ikärappeumaa, diabeettista makulaturvotusta ja verkkokalvon laskimotukoksia esiintyy pääasiassa aikuisilla.
Muut lääkevalmisteet ja Vabysmo
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Vabysmo-valmistetta ei ole tutkittu raskaana olevilla naisilla. Vabysmo-valmistetta ei pidä käyttää raskauden aikana, paitsi jos mahdollinen hyöty potilaalle on sikiölle aiheutuvaa mahdollista riskiä suurempi.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.
Imetystä ei suositella Vabysmo-hoidon aikana, sillä ei tiedetä, erittyykö Vabysmo ihmisillä äidinmaitoon.
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja vähintään kolme kuukautta Vabysmo-hoidon päättymisen jälkeen. Jos voit tulla raskaaksi tai epäilet olevasi raskaana hoidon aikana, kerro siitä heti lääkärille.
Ajaminen ja koneiden käyttö
Sinulla voi olla tilapäisiä näköhäiriöitä (esim. näön sumenemista) Vabysmo-pistoksen jälkeen. Älä aja moottoriajoneuvoa äläkä käytä koneita tällaisten vaikutusten aikana.
Vabysmo sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Vabysmo sisältää polysorbaattia
Tämä lääkevalmiste sisältää 0,02 mg polysorbaattia per 0,05 ml:n annos. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla on allergioita, kerro asiasta lääkärille.
Miten valmistetta käytetään
Miten Vabysmo-valmistetta annetaan
Suositeltu annos on 6 mg farisimabia.
Kostea silmänpohjan ikärappeuma
- Saat kolmen ensimmäisen kuukauden ajan yhden pistoksen kuukaudessa.
- Sen jälkeen saatat saada pistoksia 4 kuukauden välein. Lääkäri päättää pistosten antovälin silmäsairautesi perusteella.
Diabeettisesta makulaturvotuksesta ja verkkokalvon laskimotukoksen (verkkokalvon haaralaskimotukos tai verkkokalvon keskuslaskimotukos) seurauksena kehittyneestä makulaturvotuksesta aiheutunut näkökyvyn heikkeneminen
- Saat yhden pistoksen joka kuukausi vähintään 3 kuukauden ajan.
- Sen jälkeen saat pistoksia harvemmin. Lääkäri päättää pistosten antovälin silmäsairautesi perusteella.
Antotapa
Silmään annettaviin pistoksiin perehtynyt lääkäri antaa Vabysmo-valmisteen pistoksena silmään (pistoksena lasiaiseen).
Lääkäri puhdistaa silmän ennen pistosta desinfioivalla silmähuuhteella infektion estämiseksi. Lääkäri puuduttaa silmän silmätipoilla (paikallispuudutteella) pistoksesta aiheutuvan kivun vähentämiseksi tai estämiseksi.
Miten kauan Vabysmo-hoito kestää
Kyse on pitkäaikaisesta hoidosta, joten se voi kestää kuukausia tai vuosia. Lääkäri seuraa vointiasi säännöllisin väliajoin tarkistaakseen, että hoito tehoaa. Lääkäri voi tihentää tai harventaa hoitoasi sen mukaan, millaisen vasteen saat Vabysmo-hoitoon.
Jos Vabysmo-annos jää saamatta
Jos annos jää saamatta, sovi lääkärin kanssa mahdollisimman pian uusi hoitoaika.
Jos lopetat Vabysmo-valmisteen käytön
Keskustele lääkärin kanssa ennen hoidon lopettamista. Hoidon lopettaminen voi lisätä riskiä, että menetät näkökykysi tai että näkökykysi heikkenee.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Vabysmo-pistosten haittavaikutukset liittyvät joko itse lääkkeeseen tai pistostoimenpiteeseen ja kohdistuvat pääasiassa silmään.
Jotkut haittavaikutukset voivat olla vakavia
Ota heti yhteyttä lääkäriin, jos sinulla on jokin seuraavista allergisten reaktioiden, tulehdusten tai infektioiden mahdollisista oireista:
- silmäkipua, lisääntynyttä epämukavuuden tunnetta, lisääntynyttä silmän punoitusta, sumentunut tai heikentynyt näkökyky, lisääntynyt pienten hiukkasten määrä näkökentässä tai lisääntynyttä valonarkuutta, sillä nämä ovat mahdollisen silmätulehduksen tai -infektion tai allergisen reaktion oireita
- äkillinen näkökyvyn heikkeneminen tai muutos.
Muut mahdolliset haittavaikutukset
Vabysmo-hoidon jälkeen ilmeneviä muita mahdollisia haittavaikutuksia luetellaan seuraavassa.
Haittavaikutukset ovat useimmiten lieviä tai keskivaikeita ja häviävät yleensä viikon kuluessa pistoksesta.
Jos jokin seuraavista haittavaikutuksista kehittyy vaikea-asteiseksi, ota yhteyttä lääkäriin.
Hyvin yleiset (voivat ilmetä useammalla kuin 1 henkilöllä kymmenestä):
- ei ole.
Yleiset (voivat ilmetä enintään 1 henkilöllä kymmenestä):
- samentunut silmän mykiö (kaihi).
- yhden silmän takaosan kerroksen repeämä (verkkokalvon pigmenttiepiteelin repeämä – vain kostea silmänpohjan ikärappeuma)
- silmän sisäosan hyytelömäisen aineen irtauma (lasiaisen irtauma)
- paineen nousu silmän sisällä (kohonnut silmänpaine)
- verenvuoto silmän ulomman kerroksen pienistä verisuonista (sidekalvon verenvuoto)
- liikkuvat pilkut tai tummat hahmot näkökentässä (lasiaiskellujat)
- silmäkipu.
Melko harvinaiset (voivat ilmetä enintään 1 henkilöllä sadasta):
- silmän sisäosan vakava tulehdus tai infektio (endoftalmiitti)
- silmän sisäosan hyytelömäisen aineen tulehdus / silmän punoitus (vitreiitti)
- silmän värikalvon ja sen liitännäiskudosten tulehdus (iriitti, iridosykliitti, uveiitti)
- silmänsisäinen verenvuoto (lasiaisverenvuoto)
- epämukavuuden tunne silmässä
- kutina (silmän kutina)
- verkkokalvon (silmän valoa aistivan takaosan) repeämä
- silmän punoitus (silmän/sidekalvon hyperemia)
- rikan tunne silmässä
- näön sumeneminen
- heikentynyt näöntarkkuus (vähentynyt näöntarkkuus)
- kipu toimenpiteen aikana (toimenpiteeseen liittyvä kipu)
- verkkokalvon irtauma
- lisääntynyt kyynelten tuotanto (lisääntynyt kyynelvuoto)
- sarveiskalvon naarmu, värikalvoa silmämunassa peittävän kirkkaan kerroksen vaurio (sarveiskalvon naarmu)
- silmä-ärsytys.
Harvinaiset (voivat ilmetä enintään 1 henkilöllä tuhannesta):
- tilapäisesti heikentynyt näöntarkkuus (tilapäisesti vähentynyt näöntarkkuus)
- vammasta aiheutuva mykiön samentuminen (traumaperäinen kaihi).
Tuntematon
- verkkokalvon vaskuliitti (silmän takaosan verisuonten tulehdus)
- verkkokalvon okklusiivinen vaskuliitti (verisuonten tukkeutuminen silmän takaosassa, tyypillisesti tulehduksen yhteydessä).
Joidenkin Vabysmo-valmisteen kanssa samankaltaisesti vaikuttavien lääkkeiden käyttöön tiedetään liittyvän verisuonet tukkivien veritulppien riski (valtimotromboemboliset tapahtumat); ne voivat johtaa sydäninfarktiin tai aivohalvaukseen. Silmään annettavan Vabysmo-pistoksen jälkeen pieniä määriä lääkettä pääsee vereen, joten tällaisten tapahtumien riski on teoriassa mahdollinen.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Lääkäri, apteekkihenkilökunta tai sairaanhoitaja vastaa tämän lääkkeen säilyttämisestä ja hävittää käyttämättä jäävän valmisteen asianmukaisesti. Seuraavat tiedot on tarkoitettu terveydenhuollon ammattilaisille.
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2–8 °C).
Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Avaamatonta injektiopulloa voidaan säilyttää ennen käyttöä huoneenlämmössä (20–25 °C) enintään 24 tuntia.
Pakkauksen sisältö ja muuta tietoa
Mitä Vabysmo sisältää
- Vaikuttava aine on farisimabi. Yksi ml injektionestettä, liuosta, sisältää 120 mg farisimabia. Yksi injektiopullo sisältää 28,8 mg farisimabia 0,24 ml:ssa liuosta. Tästä saadaan käyttöannokseksi 0,05 ml:n kerta-annos liuosta, joka sisältää 6 mg farisimabia.
- Muut aineet ovat L-histidiini, etikkahappo 30 % (E 260), L-metioniini, natriumkloridi, sakkaroosi, polysorbaatti 20 (E 432), injektionesteisiin käytettävä vesi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Vabysmo sisältää natriumia” ja ”Vabysmo sisältää polysorbaattia”).
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Vabysmo on kirkas tai opalisoiva, väritön tai ruskehtavankeltainen liuos.
Pakkauskoko: yksi lasinen injektiopullo ja yksi steriili, tylppä suodattimella varustettu kertakäyttöinen siirtoneula (18G x 1½”, 1,2 mm x 40 mm, 5 µm).
Myyntiluvan haltija
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Saksa
Valmistaja
Roche Pharma AG
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
België/Belgique/Belgien, Luxembourg/Luxemburg N.V. Roche S.A. België/Belgique/Belgien Tél/Tel: +32 (0) 2 525 82 11 | Lietuva UAB “Roche Lietuva” Tel: +370 5 2546799 |
България Рош България ЕООД Тел: +359 2 474 5444 | |
Česká republika Roche s. r. o. Tel: +420 - 2 20382111 | Magyarország Roche (Magyarország) Kft. Tel: +36 - 1 279 4500 |
Danmark Roche Pharmaceuticals A/S Tlf: +45 - 36 39 99 99 | |
Deutschland Roche Pharma AG Tel: +49 (0) 7624 140 | Nederland Roche Nederland B.V. Tel: +31 (0) 348 438050 |
Eesti Roche Eesti OÜ Tel: + 372 - 6 177 380 | Norge Roche Norge AS Tlf: +47 - 22 78 90 00 |
Ελλάδα, Κύπρος Roche (Hellas) A.E. Ελλάδα Τηλ: +30 210 61 66 100 | Österreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
España Roche Farma S.A. Tel: +34 - 91 324 81 00 | Polska Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88. |
France Roche Tél: +33 (0)1 47 61 40 00 | Portugal Roche Farmacêutica Química, Lda Tel: +351 - 21 425 70 00 |
Hrvatska Roche d.o.o. Tel: + 385 1 47 22 333 | România Roche România S.R.L. Tel: +40 21 206 47 01 |
Ireland/Malta Roche Products (Ireland) Ltd. Ireland/L-Irlanda Tel: +353 (0) 1 469 0700 | Slovenija Roche farmacevtska družba d.o.o. Tel: +386 - 1 360 26 00 |
Ísland Roche Pharmaceuticals A/S c/o Icepharma hf Sími: +354 540 8000 | Slovenská republika Roche Slovensko, s.r.o. Tel: +421 - 2 52638201 |
Italia Roche S.p.A. Tel: +39 - 039 2471 | Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
Sverige Roche AB Tel: +46 (0) 8 726 1200 | |
Latvija Roche Latvija SIA Tel: +371 - 6 7039831 |
Tämä pakkausseloste on tarkistettu viimeksi toukokuussa 2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu.
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhuollon ammattilaisille:
Injektiopullon käyttöohjeet:
Ennen aloittamista:
![]() Lue kaikki ohjeet huolellisesti ennen Vabysmo-valmisteen käyttöä.
Lue kaikki ohjeet huolellisesti ennen Vabysmo-valmisteen käyttöä.
![]() Vabysmo-pakkaus sisältää lasisen injektiopullon ja suodattimella varustetun siirtoneulan. Lasinen injektiopullo on kertakäyttöinen. Suodatinneula on kertakäyttöinen.
Vabysmo-pakkaus sisältää lasisen injektiopullon ja suodattimella varustetun siirtoneulan. Lasinen injektiopullo on kertakäyttöinen. Suodatinneula on kertakäyttöinen.
![]() Vabysmo pitää säilyttää jääkaapissa 2–8 ºC:n lämpötilassa.
Vabysmo pitää säilyttää jääkaapissa 2–8 ºC:n lämpötilassa.
Ei saa jäätyä.
Ei saa ravistaa.
![]() Anna Vabysmo-valmisteen lämmetä huoneenlämpöiseksi (20–25 °C) ennen kuin siirryt sen antamiseen. Pidä injektiopullo alkuperäispakkauksessa. Herkkä valolle.
Anna Vabysmo-valmisteen lämmetä huoneenlämpöiseksi (20–25 °C) ennen kuin siirryt sen antamiseen. Pidä injektiopullo alkuperäispakkauksessa. Herkkä valolle.
Vabysmo-injektiopulloa voidaan säilyttää huoneenlämmössä enintään 24 tuntia.
![]() Vabysmo-injektiopullo pitää tarkistaa silmämääräisesti ennen antoa. Vabysmo on kirkas tai opalisoiva ja väritön tai ruskehtavankeltainen nestemäinen liuos.
Vabysmo-injektiopullo pitää tarkistaa silmämääräisesti ennen antoa. Vabysmo on kirkas tai opalisoiva ja väritön tai ruskehtavankeltainen nestemäinen liuos.
Ei saa käyttää, jos havaitaan hiukkasia, samentumaa tai värimuutos.
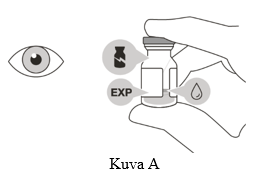
Ei saa käyttää, jos pakkaus, injektiopullo ja/tai suodattimella varustettu siirtoneula on vaurioitunut, niiden viimeinen käyttöpäivämäärä on ohitettu tai niitä on peukaloitu (ks. kuva A).
Noudata lasiaiseen annettavan injektion valmistelussa aseptista tekniikkaa.
Ota tarvikkeet esille
1. Ota esille seuraavat tarvikkeet:
- yksi Vabysmo-injektiopullo (mukana pakkauksessa)
- yksi steriili 5 mikrometrin tylppä suodattimella varustettu siirtoneula, 18G x 1½”, 1,2 mm x 40 mm (mukana pakkauksessa)
- yksi steriili 1 ml:n Luer lock -ruisku, jossa annosasteikko 0,05 ml:n välein (ei mukana pakkauksessa)
yksi steriili injektioneula 30G x ½” (ei mukana pakkauksessa)
Huom. 30G:n injektioneulaa suositellaan, jotta vältetään ohuempien neulojen yhteydessä tuntuva suurempi injisointipaine.- Desinfiointipyyhe (ei mukana pakkauksessa).
2. Aseta injektiopullo pakkauksesta poistamisen jälkeen tasaiselle alustalle pystyasentoon (noin 1 minuutiksi), jotta kaikki neste valuu injektiopullon pohjalle (ks. kuva B). Naputtele injektiopulloa varovasti sormella (ks. kuva C), sillä neste voi jäädä injektiopullon yläosaan.
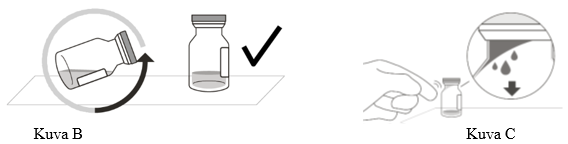
3. Poista injektiopullosta irti napsautettava (flip-off) korkki (ks. kuva D), ja pyyhi injektiopullon tulpan keskiosa desinfiointipyyhkeellä (ks. kuva E).
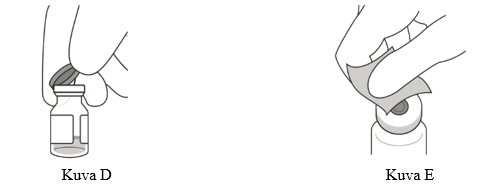
Siirrä lääkevalmiste injektiopullosta ruiskuun
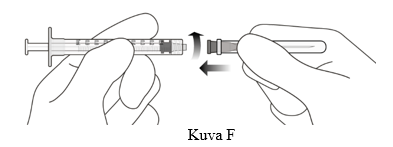
4. Kiinnitä pakkauksessa mukana oleva suodattimella varustettu siirtoneula (18G x 1½”) aseptisesti ja tukevasti kiinni 1 ml:n Luer lock -ruiskuun (ks. kuva F).
5. Paina aseptista tekniikkaa noudattaen suodattimella varustettu siirtoneula injektiopullon tulpan keskiosaan (ks. kuva G), paina se pohjaan asti ja kallista sitten injektiopulloa hieman, jotta neula koskettaa injektiopullon pohjan kulmaa (ks. kuva H).
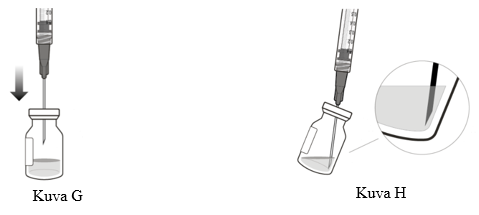
6. Pidä injektiopulloa hieman kallistettuna, ja vedä hitaasti kaikki neste injektiopullosta ruiskuun (ks. kuva I). Pidä suodattimella varustetun siirtoneulan viistoreuna nestepinnan alla välttääksesi ilman pääsyn neulaan.
Kiinnitä injektioneula
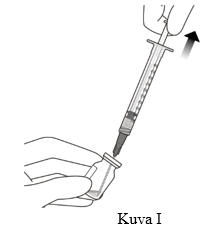
7. Varmista injektiopullon tyhjentäessäsi, että männänvarsi on vedetty riittävästi ulos, jotta tyhjennät myös suodattimella varustetun siirtoneulan täysin (ks. kuva I).
8. Irrota suodattimella varustettu siirtoneula ruiskusta ja hävitä se paikallisten säädösten mukaisesti.
Älä käytä suodattimella varustettua siirtoneulaa lasiaiseen annettavaan injektioon.
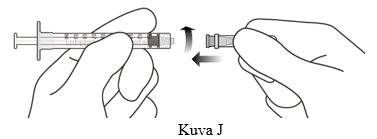
9. Kiinnitä injektioneula (30G x ½”) aseptisesti ja tukevasti kiinni Luer lock -ruiskuun (ks. kuva J).
Naputtele ilmakuplat ruiskun yläosaan ja säädä lääkevalmisteannos
10. Irrota neulasta muovinen neulansuojus vetämällä se varovasti suoraan irti.
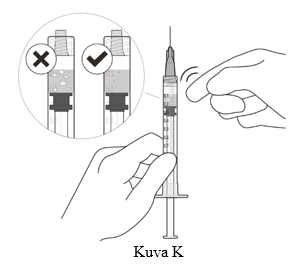
11. Pitele ruiskua neula ylöspäin osoittaen ja tarkista, onko ruiskussa ilmakuplia. Jos näet ilmakuplia, naputtele ruiskua sormella, kunnes kuplat nousevat yläosaan (ks. kuva K).
12. Paina ilma varovasti pois ruiskusta ja neulasta, ja paina mäntää hitaasti, kunnes kumitulpan kärki on 0,05 ml:n annosmerkin kohdalla. Ruisku on valmis injektiota varten (ks. kuva L). Varmista, että injektio annetaan heti annoksen valmistelun jälkeen.
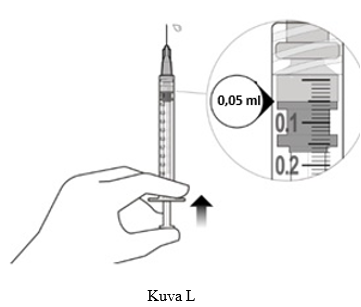
13. Injisoi hitaasti, kunnes kumitulppa on painettu ruiskun pohjaan ja 0,05 ml:n tilavuus on siten annettu. Varmista koko annoksen antaminen tarkistamalla, että kumitulppa on ruiskun säiliön pohjassa.
Ylimääräinen liuos on poistettava ennen injisointia. Injektion annos on asetettava 0,05 ml:n annosmerkin kohdalle yliannoksen välttämiseksi.
Jätemateriaali tai käyttämättä jäävä lääkevalmiste pitää hävittää paikallisten säädösten mukaisesti.