Pakkausseloste
LUMIGAN ögondroppar, lösning i endosbehållare 0,3 mg/ml
Tilläggsinformation
LUMIGAN 0,3 mg/ml ögondroppar, lösning, i endosbehållare
bimatoprost
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna bipacksedel, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad LUMIGAN engångsdos är och vad det används för
2. Vad du behöver veta innan du använder LUMIGAN engångsdos
3. Hur du använder LUMIGAN engångsdos
4. Eventuella biverkningar
5. Hur LUMIGAN engångsdos ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
LUMIGAN engångsdos är ett läkemedel som används vid glaukom (grön starr) och tillhör en grupp läkemedel som kallas prostamider.
LUMIGAN engångsdos av ögondroppar används för att minska högt tryck i ögat. LUMIGAN kan användas ensamt eller tillsammans med andra ögondroppar som kallas betablockerare, och som också sänker trycket.
I ögat finns en klar vätska som ger ögat näring. Vätska rinner ständigt ut ur ögat och ny bildas kontinuerligt. Om vätskan inte kan rinna ut tillräckligt snabbt, ökar trycket inne i ögat. LUMIGAN verkar genom att öka den vätskemängd som rinner ut, vilket minskar trycket inne i ögat.
Om ett förhöjt ögontryck inte sänks kan det leda till en sjukdom som kallas glaukom och med tiden kan synen skadas.
Detta läkemedel innehåller inte konserveringsmedel.
Vad du behöver veta innan produkten används
Använd inte LUMIGAN
- om du är allergisk mot bimatoprost eller något av övriga innehållsämnen i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder LUMIGAN engångsdos om:
- du har problem med andningen
- du har lever- eller njurbesvär
- du har opererats för grå starr
- du har, eller har haft, lågt blodtryck eller långsam hjärtrytm
- du har haft en inflammation eller virusinfektion i ögat
Under behandlingen kan LUMIGAN orsaka fördjupning av ögonlocksfåran på grund av fettförlust i ögonområdet vilket kan leda till ihopsjunkna ögon (enoftalmus), hängande ögonlock (ptos), att huden runt dina ögon spänns (involution av dermatokalasis) och att den nedre vita delen av ditt öga blir mera synlig. Förändringarna är vanligtvis milda men om de är uttalade kan de påverka ditt synfält. Förändringarna kan försvinna om du slutar ta LUMIGAN. LUMIGAN engångsdos kan också medföra att ögonfransarna växer och blir mörkare och även göra så att huden runt ögonlocket mörknar. Färgen på iris kan också bli mörkare. Dessa förändringar kan bli beständiga. Förändringarna kan bli mer märkbara, om bara ena ögat behandlas.
Barn och ungdomar
LUMIGAN engångsdos har inte testats på barn under 18 år och därför bör LUMIGAN inte användas av patienter under 18 år.
Andra läkemedel och LUMIGAN
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Graviditet, amning och fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
LUMIGAN engångsdos kan gå över i bröstmjölk. Därför bör du inte amma under behandling med detta läkemedel.
Körförmåga och användning av maskiner
Synen kan bli suddig strax efter du droppat LUMIGAN engångsdos. Kör inte bil och använd inte maskiner, förrän du kan se klart igen.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Rekommenderad dos är en droppe dagligen, på kvällen, en gång dagligen i vart öga som ska behandlas. LUMIGAN engångsdos skall endast administreras i ögat.
Om du använder LUMIGAN engångsdos tillsammans med andra ögonläkemedel, vänta minst 5 minuter mellan användning av LUMIGAN engångsdos och det andra ögonläkemedlet.
Använd inte mer än en gång per dag eftersom behandlingseffekten då kan minskas.
Tvätta händerna före användning. Se till att endosbehållaren är hel före användning. Lösningen ska användas omedelbart efter öppnandet. För att undvika förorening, låt inte den öppna änden av endosbehållaren röra vid ditt öga eller vid något annat.
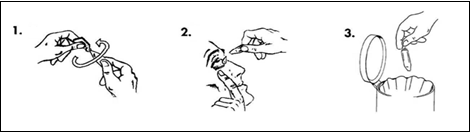
- Ta en endosbehållare från portionspåsen och håll den upprätt (med vingen uppåt) och vrid av vingen.
- Dra försiktigt ned det undre ögonlocket tills det bildas en ficka. Vänd endosbehållaren upp och ner och pressa fram 1 droppe i de(t) påverkade ögonen(at).
- Kasta endosbehållaren när du använt den, även om det finns lösning kvar.
Torka bort eventuell vätska som rinner ner på kinden.
Om du använder kontaktlinser, ta ut dem innan du använder läkemedlet. Vänta 15 minuter när du använt dropparna och innan du sätter in linserna igen.
Om du har använt för stor mängd av LUMIGAN
Om du använder mer av detta läkemedel än vad du borde, är det osannolikt att det skulle skada dig allvarligt. Administrera nästa dos på vanlig tid. Om du är bekymrad, vänd dig till läkare eller apotekspersonal.
Om du har glömt att använda LUMIGAN
Om du har glömt att använda detta läkemedel, droppa i en enda droppe så fort du kommer ihåg det och återgå sedan till din regelbundna rutin. Ta inte dubbel dos för att kompensera för glömd dos.
Om du slutar att använda LUMIGAN
LUMIGAN engångsdos skall användas varje dag för att få avsedd effekt. Om du slutar att använda LUMIGAN engångsdos kan trycket i ditt öga öka. Tala därför med din läkare innan du avbryter denna behandling.
Om du har ytterligare frågor om denna produkt kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
Påverkar ögat
- Lätt rodnad (upp till 24 % av patienterna)
- Fettförlust i ögonområdet vilket kan leda till fördjupning av ögonlocksfåran, ihopsjunkna ögon (enoftalmus), hängande ögonlock (ptos), att huden runt dina ögon spänns (involution av dermatokalasis) och att den nedre vita delen av ditt öga blir mera synlig
Vanliga (kan förekomma hos upp till 1 av 10 användare)
Påverkar ögat
- Små bristningar på ögats yta, med eller utan inflammation
- Irritation
- Kliande ögon
- Smärta
- Torra ögon
- En känsla av skräp i ögat
- Längre ögonfransar
- Mörkare hudfärg runt ögat
- Röda ögonlock
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
Påverkar ögat
- Trötta ögon
- Ljuskänslighet
- Mörkare irisfärg
- Kliande och svullna ögonlock
- Tårar
- Svullnad i det genomskinliga lagret som täcker ögats yta
- Dimsyn
Påverkar kroppen i övrigt
- Huvudvärk
- Hårväxt runt ögat
Har rapporterats (förekommer hos ett okänt antal användare)
Påverkar ögat
- Klibbiga ögon
- Obehag i ögat
Påverkar kroppen i övrigt
- Astma
- Försämring av astma
- Försämring av kronisk obstruktiv lungsjukdom (KOL)
Andnöd
- Symtom på allergisk reaktion (svullnad, rodnad i ögat och hudutslag)
- Yrsel
- Förhöjt blodtryck
- Missfärgning av huden runt ögat
Förutom biverkningarna för LUMIGAN 0,3 mg/ml engångsdos har följande biverkningar setts vid flerdosberedning med konserveringsmedel av LUMIGAN 0,3 mg/ml och kan uppträda hos patienter som tar engångsdos av LUMIGAN 0,3 mg/ml.
- Svidande känsla i ögat
- Allergisk reaktion i ögat
- Inflammerade ögonlock
- Svårighet att se skarpt
- Försämrad syn
- Mörkare ögonfransar
- Blödning i näthinnan
- Inflammation inuti ögat
- Cystiskt makulaödem (näthinnan svullnar inuti ögat vilket leder till försämrad syn)
- Irisinflammation
- Ryckningar i ögonlocken
- Ögonlocket krymper ihop och flyttar sig från ögats yta
- Illamående
- Hudrodnad runt ögat
- Svaghet
- Förhöjda levervärden
Andra biverkningar som rapporterats med ögondroppar innehållande fosfat
I mycket sällsynta fall har patienter med svåra skador på den genomskinliga ytan på ögats framsida (hornhinnan) utvecklat grumliga fläckar på hornhinnan på grund av kalkavlagringar under behandlingen.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Detta läkemedel är endast avsett för engångsbruk och innehåller inte konserveringsmedel. Spara inte oanvänd lösning.
Används före utgångsdatumet som anges på endosbehållaren och på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Detta läkemedel har inga särskilda förvaringsanvisningar. Använd dock portionspåsen inom 30 dagar efter öppnande.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är bimatoprost. En ml lösning innehåller 0,3 mg bimatoprost.
- Övriga innehållsämnen är natriumklorid, natriumfosfat dibasisk heptahydrat, citronsyra monohydrat och renat vatten. Små mängder saltsyra eller natriumhydroxid kan tillsätts för att hållas surhetsgraden (pH-nivån) normal.
Läkemedlets utseende och förpackningsstorlekar
LUMIGAN 0,3 mg/ml engångsdos är en klar, färglös lösning i endosbehållare i plast, var och en innehållande 0,4 mg/ml lösning.
Varje förpackning innehåller 5 endosbehållare i en kartong.
Varje förpackning innehåller 3 eller 9 portionspåsar av aluminiumfolie, var och en innehållande 10 endosbehållare, vilket ger sammanlagt 30 respektive 90 endosbehållare i en kartong.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
AbbVie Deutschland GmbH & Co. KG
Knollstrasse
67061 Ludwigshafen
Tyskland
Tillverkare
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irland
Ytterligare upplysningar om detta läkemedel kan erhållas hos ombudet för innehavaren av godkännandet för försäljning.
Finland AbbVie Oy Tel: +358 (0)10 2411 200 |
Sverige AbbVie AB Tel: +46 (0)8 684 44 600 |
Denna bipacksedel ändrades senast 11/2024
Information om detta läkemedel finns tillgänglig på Europeiska läkemedelsmyndighetens hemsida https://www.ema.europa.eu /
För att lyssna på eller begära en kopia av denna information i förstorad text eller för att få texten uppläst, kontakta ombudet för innehavaren av godkännandet för försäljning.