Pakkausseloste
HIZENTRA injektionsvätska, lösning 200 mg/ml
Tilläggsinformation
Hizentra 200 mg/ml injektionsvätska för subkutan injektion, lösning
Humant normalt immunglobulin (SCIg = subkutant immunglobulin)
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får några biverkningar tala med läkare eller sjukvårdspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Hizentra är och vad det används för
- Vad du behöver veta innan du använder Hizentra
- Hur du använder Hizentra
- Eventuella biverkningar
- Hur Hizentra ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Hizentra är
Hizentra tillhör en klass läkemedel som kallas humana normala immunglobuliner. Immunglobuliner kallas också antikroppar och är blodproteiner som hjälper din kropp att bekämpa infektioner.
Hur Hizentra verkar
Hizentra innehåller immunglobuliner som har framställts av blod från friska personer. Immunglobuliner produceras av kroppens immunsystem. De hjälper din kropp att bekämpa infektioner orsakade av bakterier och virus eller att behålla balansen i ditt immunsystem (kallas för immunomodulering). Medicinen fungerar på exakt samma sätt som de immunglobuliner som finns naturligt i ditt blod.
Vad används Hizentra för
Substitutionsbehandling (ersättningsbehandling)
Hizentra används för att höja onormalt låga immunglobulinnivåer i ditt blod till normala nivåer (ersättningsbehandling). Medicinen används hos vuxna och barn (0-18 år) i följande situationer:
- Behandling av patienter som föds med nedsatt förmåga eller oförmåga att producera immunglobuliner (primär immunbrist). Det omfattar följande tillstånd:
- låga halter av immunglobuliner (hypogammaglobulinemi) eller avsaknad av immunglobuliner (agammaglobulinemi) i blodet
- kombination av låga halter av immunglobuliner, återkommande infektioner och oförmåga att producera tillräckliga mängder av antikroppar efter vaccination (vanlig variabel immunbrist)
- kombination av låga halter av eller avsaknad av immunglobuliner och frånvaro av eller icke-fungerande immunceller (svår kombinerad immunbrist)
- brist på vissa immunglobulin G underklasser som orsakar återkommande infektioner.
2. Behandling av patienter med låga eller ej fullt fungerande immunglobulinnivåer vid förvärvade tillstånd (sekundär immunbrist), som upplever svåra eller återkommande infektioner på grund av ett försvagat immunsystem till följd av andra tillstånd eller behandlingar.
Immunomodulerande behandling hos CIDP-patienter
Hizentra används också hos patienter med kronisk inflammatorisk demyeliniserande polyradikuloneuropati (CIDP), en sorts autoimmun sjukdom. CIDP utmärks av kronisk inflammation i de perifera nerverna vilket orsakar muskelsvaghet och/eller domningar huvudsakligen i armar och ben. Det antas att kroppens försvarsattack förstärker sådan inflammation och att immunglobulinerna som finns i Hizentra hjälper till att skydda nerverna från attacken (immunomodulerande terapi).
Vad du behöver veta innan produkten används
Infundera INTE Hizentra:
► om du är allergisk mot humana immunglobuliner, polysorbat 80 eller L-prolin.
- Tala före behandlingen om för din läkare eller sjukvårdspersonal om du tidigare har reagerat mot någon av dessa substanser.
► om du har hyperprolinemi (en genetisk störning med höga halter av aminosyran prolin i blodet).
► i ett blodkärl.
Varningar och försiktighet
- Tala med din läkare eller sjukvårdspersonal innan du använder Hizentra.
Du kan vara allergisk (överkänslig) mot immunglobulin utan att veta om det. Allvarliga allergiska reaktioner är emellertid ovanliga. Det kan inträffa även om du har fått humant immunglobulin tidigare och tålt det bra. Det kan hända om du inte har tillräckligt immunglobulin typ A (IgA) i blodet (IgA-brist).
- Tala före behandling om för din läkare eller sjukvårdspersonal om du har brist på immunglobulin typ IgA. Hizentra innehåller restmängder av IgA, som kan orsaka en allergisk reaktion.
I sådana sällsynta fall kan allergiska reaktioner som till exempel plötsligt blodtrycksfall eller chock inträffa (se även avsnitt Eventuella biverkningar ”Eventuella biverkningar”).
- Om du märker sådana reaktioner under infusion av Hizentra, avbryt infusionen och kontakta din läkare eller åk genast till närmaste sjukhus.
- Tala om för läkaren om du tidigare har haft en hjärt- eller kärlsjukdom eller blodproppar, har tjockt blod eller har varit immobiliserad under en längre tid. Dessa saker kan öka risken för att du ska få en blodpropp efter att ha använt Hizentra. Tala även om för läkaren vilka läkemedel du använder, eftersom vissa läkemedel, till exempel sådana som innehåller hormonet östrogen (till exempel p-piller), kan öka risken för att du ska få en blodpropp. Kontakta din läkare omedelbart om du får tecken och symtom som andfåddhet, bröstsmärta, smärta och svullnad i en extremitet, svaghet eller domningar i ena sidan av kroppen efter att ha fått Hizentra.
- Kontakta din läkare om du får följande tecken och symtom: svår huvudvärk, stel nacke, dåsighet, feber, ljuskänslighet, illamående och kräkning efter att ha fått Hizentra. Din läkare avgör om det behövs fler tester och om behandlingen med Hizentra ska fortsätta.
Din läkare/sköterska kommer att undvika eventuella komplikationer genom att säkerställa att:
► du inte är överkänslig mot humant normalt immunglobulin.
Detta läkemedel ska infunderas långsamt i början. Den rekommenderade infusionshastigheten som anges i avsnitt Hur produkten används ”Hur du använder Hizentra” ska följas noggrant.
► du noggrant övervakas för eventuella symtom under hela infusionsperioden, i synnerhet om:
- du får humant normalt immunglobulin för första gången
- du har bytt från ett annat läkemedel
- det har varit ett långt uppehåll (mer än åtta veckor) sedan den föregående infusionen.
I dessa fall rekommenderas att du noggrant övervakas under den första infusionen och därefter i en timme. Om ovanstående punkter inte gäller för dig rekommenderas att du observeras i minst 20 minuter efter att du fått läkemedlet.
Andra läkemedel och Hizentra
- Tala om för din läkare eller sjukvårdspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
- Du får inte blanda andra läkemedel med innehållet i injektionsflaskan för Hizentra.
- Tala om för den vaccinerande läkaren före vaccination att du behandlas med Hizentra. Hizentra kan försämra effekten av vissa levande virusvacciner, som vaccin mot mässling, påssjuka, röda hund och vattkoppor. Efter att du fått läkemedlet bör du därför vänta upp till 3 månader innan du får dessa vacciner. För mässlingvaccinationer kan denna försämring kvarstå i upp till 1 år.
Graviditet, amning och fertilitet
- Tala om för läkare eller sjukvårdspersonal om du är gravid, planerar att bli gravid eller ammar. Din läkare kommer att avgöra om du kan få Hizentra under graviditeten eller under tiden du ammar.
Inga kliniska studier har utförts med Hizentra på gravida kvinnor. Däremot har läkemedel som innehåller immunglobuliner använts av gravida eller ammande kvinnor i många år och inga skadliga effekter på graviditetsförloppet, fostret eller det nyfödda barnet har observerats.
Om du ammar och får Hizentra, kan läkemedlets immunglobuliner också finnas i bröstmjölken. Därför kan ditt barn vara skyddat mot vissa infektioner.
Körförmåga och användning av maskiner
Patienter kan uppleva effekter som yrsel eller illamående vid behandling med Hizentra, vilket kan påverka förmågan att köra eller använda maskiner. Om detta händer ska du inte köra eller använda maskiner förrän dessa effekter har försvunnit.
Hizentra innehåller prolin
Du ska inte ta det om du lider av hyperprolinemi (se också avsnitt Vad du behöver veta innan produkten används ”Vad du behöver veta innan du använder Hizentra”). Tala om det för din läkare före behandlingen.
Övrig viktig information om Hizentra
Blodprover
Efter att du fått Hizentra kan resultaten från vissa blodprover (serologiska prover) påverkas under en viss tid.
- Tala om för din läkare att du behandlas med Hizentra före ett eventuellt blodprov.
Information om vad Hizentra tillverkas av
Hizentra framställs ur mänsklig blodplasma (den vätskeformiga delen av blodet). När läkemedel tillverkas av mänskligt blod eller plasma, vidtas speciella åtgärder för att förhindra att infektioner överförs till patienterna. Dessa omfattar:
- noggrant urval av blod- och plasmagivare för att säkerställa att de som kan ha infektioner utesluts och
- test av varje givare och plasmapool för tecken på virus/infektioner.
Tillverkarna av dessa läkemedel har också med steg vid beredningen av blod eller plasma som kan inaktivera eller avlägsna virus. Trots dessa åtgärder kan risken för att överföra smittämnen inte helt uteslutas när läkemedel som framställts från mänskligt blod eller plasma ges. Detta gäller även alla okända eller nya virus och andra typer av infektioner.
Vidtagna åtgärder anses vara effektiva mot virus med hölje, som humant immunbristvirus (HIV, AIDS-viruset), hepatit B-virus och hepatit C-virus (leverinflammation), samt mot virus utan hölje som hepatit A-virus och parvovirus B19.
- Det rekommenderas starkt att läkemedlets namn och tillverkningssatsnummer registreras varje gång du får en dos Hizentra, för att ha en förteckning över tillverkningssatser som använts (se avsnitt Hur produkten används ”Hur du använder Hizentra”).
Hizentra innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per injektionsflaska/spruta, d.v.s. är näst intill ”natriumfritt”.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Dosering
Din läkare kommer att beräkna den korrekta dosen för dig beroende på din kroppsvikt och hur du svarar på behandling.
Ändra inte dosen eller tidsintervallet mellan doserna utan att rådfråga din läkare.
Om du tycker att du ska få Hizentra oftare eller mer sällan, tala med din läkare.
Om du tror att du har missat en dos, tala med din läkare snarast möjligt.
Substitutionsbehandling
Din läkare avgör om du behöver en startdos (för vuxna och barn) på minst 1-2,5 ml/kg kroppsvikt fördelad på flera dagar. Därefter kan underhållsdoser ges med upprepade intervall, från dagligen till en gång varannan vecka, för att uppnå en total dos per månad på ca 2-4 ml/kg kroppsvikt. Din läkare kan justera dosen baserat på hur du svarar på behandlingen.
Immunomodulerande behandling
Din läkare kommer påbörja behandling med Hizentra 1 vecka efter din senaste intravenösa infusion med immunglobulin genom att ge den under huden (subkutant) med en veckodos om 1,0 till 2,0 ml/kg kroppsvikt. Din läkare kommer att bestämma din veckodos av Hizentra. De veckovisa underhållsdoserna kan delas upp i mindre doser och ges så ofta som det behövs under veckan. För dosering varannan vecka kommer din läkare att dubblera veckodosen av Hizentra. Vårdpersonal kan justera dosen beroende på hur du svarar på behandlingen.
Administreringssätt och administreringsväg
Om du får behandling i hemmet kommer den att påbörjas av sjukvårdspersonal med erfarenhet av behandling av immunbrist/CIDP med subkutant immunglobulin (SCIg) och av att ge råd till patienter vid behandling i hemmet.
Du kommer att få instruktioner och bli tränad i:
- aseptisk infusionsteknik
- hur man för en behandlingsdagbok, och
- åtgärder som ska vidtas i händelse av allvarliga biverkningar.
Infusionsställe(n)
- Hizentra får endast injiceras under huden.
- Du kan infundera Hizentra på ställen som buk, lår, överarm och höftens utsida. Om stora doser ges (mer än 50 ml), rekommenderas att injicera på flera ställen.
- Du kan använda ett obegränsat antal injektionsställen samtidigt. Injektionsställena bör vara på minst 5 cm avstånd från varandra.
- I de fall du använder en hjälpmedelsassisterad infusionsteknik (t.ex. infusion med hjälp av pump), kan mer än en infusionsutrustning användas samtidigt.
- I de fall du använder manuell infusionsteknik med spruta, kan du bara använda ett infusionsställe per spruta. Om du behöver ge ytterligare en Hizentra-spruta måste du använda en ny steril injektionsnål och byta infusionsställe.
- Volymen av läkemedel som infunderas på olika ställen kan variera.
Infusionshastighet(er)
Din läkare kommer att bestämma lämplig infusionsteknik och infusionshastighet för dig med hänsyn till din individuella dos, doseringsfrekvens och din tolerans för läkemedlet.
Infusion med infusionsutrustning
Den rekommenderade initiala infusionshastigheten är upp till 20 ml/timme/ställe. Om den tolereras väl kan du gradvis öka infusionshastigheten till 35 ml/timme/ställe för de följande två infusionerna. Därefter kan infusionshastigheten ökas ytterligare beroende på hur väl du tål behandlingen.
Manuell infusion
Den rekommenderade initiala infusionshastigheten är upp till 0,5 ml/min/ställe (30 ml/timme/ställe). Om den tolereras väl kan du öka infusionshastigheten till upp till 2,0 ml/min/ställe (120 ml/timme/ ställe) för efterföljande infusioner. Därefter kan infusionshastigheten ökas ytterligare beroende på hur väl du tolererar den.
Instruktioner för användning
| Följ stegen nedan och använd aseptisk teknik för att administrera Hizentra. | ||
| 1 | Rengör ytan Rengör ett bord eller en annan plan yta noggrant med en antiseptisk våtservett. | |
| 2 | Samla ihop materialet Placera Hizentra samt annat material och utrustning som behövs för infusionen på en ren och plan yta. | |
| 3 | Tvätta och torka händerna noggrant | |
| 4 | Kontrollera injektionsflaskorna Kontrollera Hizentra visuellt för partiklar i lösningen eller missfärgning och kontrollera även utgångsdatum före administrering av Hizentra. Använd inte lösningar som är grumliga eller innehåller partiklar. Använd inte lösningar som har varit frusna. Administrera en lösning som är rums- eller kroppstempererad. När en injektionsflaska har öppnats ska lösningen användas omedelbart. | |
| 5 | Förbered Hizentra för infusion Rengör injektionsflaskans propp – Ta bort det skyddande locket från injektionsflaskan för att exponera det centrala partiet av gummiproppen. Rengör proppen med spritservett eller antiseptiskt medel och låt det torka. Överför Hizentra till spruta för infusion – Fäst en överföringsanordning eller en nål på en steril spruta med aseptisk teknik. Om en överföringsanordning (vented spike) används, följ tillverkarens instruktioner. Om en nål används, dra tillbaka kolven för att suga in lika mycket luft i sprutan som den mängd Hizentra som ska dras upp. För sedan in nålen i det centrala partiet av proppen och, för att undvika skumbildning, spruta in luft i injektionsflaskans tomrum (inte i vätskan). Dra till sist upp den önskade volymen av Hizentra. Repetera detta steg när flera injektionsflaskor används för att uppnå önskad dos. | 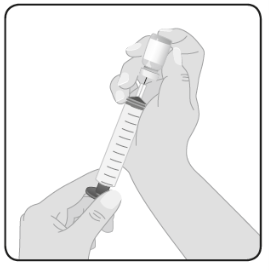 |
| 6 | Förbered slangen Fäst administrationsslangen eller nålsetet till sprutan. Spruta in lösning i slangen för att ta bort all kvarvarande luft (priming). | |
| 7 | Förbered infusionsstället/infusionsställena Välj infusionsstället/infusionsställena – Antalet infusionsställen och platsen för dessa beror på volymen av den totala dosen. Varje infusionsställe ska vara minst 5 cm från varandra. Du kan använda ett obegränsat antal infusionsställen samtidigt. | 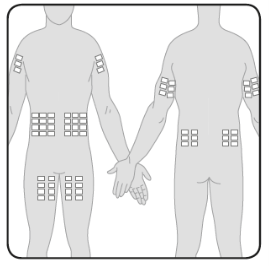 |
| Rengör infusionsstället/infusionsställena med ett huddesinfektionsmedel. Låt varje infusionsställe torka innan du fortsätter. | ||
| 8 | För in nålen Ta tag i huden mellan 2 fingrar och för in nålen i den subkutana vävnaden. | 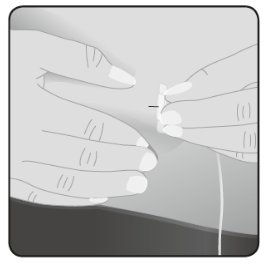 |
| Fäst nålen på huden – Använd gasbinda och tejp eller transparent förband om det behövs för att hålla nålen på plats. | ||
| 9 | Infundera Hizentra Starta infusionen. Om en infusionspump används, följ tillverkarens instruktioner. | |
| 10 | Protokollför infusionen Protokollför följande data i din behandlingsdagbok: • datumet för administreringen, • batch-numret (Lot) för läkemedlet, och • den infunderade volymen, infusionshastigheten, antalet infusionsställen samt platsen för dessa. | |
| 11 | Rengöring Kassera eventuell oanvänd produkt och använda administreringshjälpmedel efter administrering i enlighet med lokala krav. | |
Om du har ytterligare frågor om detta läkemedel kontakta läkare eller sjukvårdspersonal.
Om du använt för stor mängd av Hizentra
Om du tror att du har fått för mycket Hizentra eller du har missat en dos, tala med din läkare så snart som möjligt.
Om du har glömt att använda Hizentra
Om du tror att du har missat en dos, tala med din läkare så snart som möjligt.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
► I enstaka fall kan du bli allergisk (överkänslig) mot immunglobuliner och allergiska reaktioner som ger plötsligt blodtrycksfall eller chock kan inträffa (du kan t.ex. känna dig yr, svimfärdig när du ställer dig upp, få kalla händer och fötter, känna onormala hjärtslag eller bröstsmärta eller se suddigt).
► I enstaka fall kan du uppleva smärta och/eller svullnad i en arm eller ett ben med värmekänsla i det påverkade området, missfärgning av en arm eller ett ben, oförklarlig andnöd, bröstsmärta eller obehag som förvärras vid djupa andetag, oförklarligt snabb puls, domningar eller svaghet i ena sidan av kroppen, plötslig förvirring, svårigheter att tala eller förstå vilket kan vara tecken på blodpropp.
► I enstaka fall kan du få en svår huvudvärk med illamående, kräkningar, stel nacke, feber och ljuskänslighet vilket kan vara tecken på AMS (aseptiskt meningitsyndrom) som är en tillfällig övergående icke-infektiös inflammation i membranen som omger hjärnan och ryggmärgen.
- Om du märker sådana tecken under infusion av Hizentra stoppa infusionen och åk genast till närmaste sjukhus.
Se även avsnitt Vad du behöver veta innan produkten används i denna bipacksedel om riskerna för allergiska reaktioner, blodproppar och AMS.
Biverkningar som har setts i kliniska studier beskrivs i fallande ordning med de vanligaste först. Biverkningar som har setts efter marknadsförandet har okänd frekvens:
Följande biverkningar är mycket vanliga (förekommer hos fler än 1 patient av 10):
- Huvudvärk
- Utslag
- Reaktioner vid infusionsstället
Följande biverkningar är vanliga (förekommer hos 1 till 10 patienter av 100):
- Yrsel
- Migrän
- Förhöjt blodtryck (hypertension)
- Diarré
- Magsmärtor
- Illamående
- Kräkningar
- Klåda (pruritus)
- Nässelutslag (urtikaria)
- Smärta i muskler och skelett (muskuloskeletal smärta)
- Ledvärk (artralgi)
- Feber
- Trötthet (utmattning) inklusive allmän sjukdomskänsla
- Bröstsmärta
- Influensaliknande symtom
- Smärta
Följande biverkningar är mindre vanliga (förekommer hos 1 till 10 patienter av 1 000):
- Överkänslighet
- Ofrivilliga skakningar i en eller flera kroppsdelar (tremor, inklusive psykomotorisk hyperaktivitet)
- Snabb puls (takykardi)
- Värmevallningar
- Muskelspasmer
- Muskelsvaghet
- Frossa, inklusive låg kroppstemperatur
- Onormalt resultat på blodprov som kan tyda på nedsatt lever- och njurfunktion
I enstaka fall kan sår vid infusionsstället eller brännande känsla förekomma.
Du kan minska eventuella biverkningar om du infunderar Hizentra långsamt.
Biverkningar kan inträffa även om du tidigare har fått humana immunglobuliner och tolererat dem väl.
Se även avsnitt Vad du behöver veta innan produkten används ”Vad du behöver veta innan du använder Hizentra” för mer information om omständigheter som ökar risken för biverkningar.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
- Förvara detta läkemedel utom syn- och räckhåll för barn.
- Används före utgångsdatum som anges på ytterkartongen och injektionsflaskans etikett efter EXP.
- Du måste använda/infusera detta läkemedel så snart som möjligt efter att flaskan öppnats. Använd inte Hizentra om flaskan är öppen eller trasig.
- Förvaras vid högst 25 °C.
- Får ej frysas.
- Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
- Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar mediciner som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är humant normalt immunglobulin. En ml innehåller 200 mg humant normalt immunglobulin, av vilket minst 98% är immunglobulin typ G (IgG).
Den ungefärliga procentandelen av IgG-underklasser är följande:
IgG1...............69%
IgG2...............26%
IgG3...............3%
IgG4...............2%
Detta läkemedel innehåller spårmängder av IgA (inte mer än 50 mikrogram/ml).
- Övriga innehållsämnen (hjälpämnen) är L-prolin, polysorbat 80 och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Hizentra är en injektionsvätska för subkutan injektion, lösning (200 mg/ml). Färgen kan variera från svagt gul till ljusbrun.
Hizentra finns i 5 ml, 10 ml, 20 ml och 50 ml injektionsflaskor.
Hizentra finns också som förfyllda sprutor om 5, 10, 20 och 50 ml.
Förpackningsstorlekar
Förpackningar om 1, 10 eller 20 injektionsflaskor
Hizentra finns också i förpackningar med 1 (för 5, 10, 20, 50 ml), 10 (för 5, 10, 20, 50 ml) eller 20 (för 10, 20 ml) förfyllda sprutor.
Observera att spritservetter, nålar samt annat material eller utrustning inte ingår i förpackningen.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
CSL Behring GmbH
Emil-von-Behring-Strasse 76
D-35041 Marburg
Tyskland
För ytterligare upplysningar om detta läkemedel, kontakta ombudet för innehavaren av godkännandet för försäljning:
CSL Behring AB
Tel: +46 8 544 966 70
Denna bipacksedel ändrades senast 09/2025
Information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu/.