Pakkausseloste
FOTIVDA kapsel, hård 890 mikrog, 1340 mikrog
Tilläggsinformation
Fotivda 890 mikrogram, hård kapsel
Fotivda 1 340 mikrogram, hård kapsel
tivozanib
Utökad övervakning
![]() Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa om den.
- Om du har ytterligare frågor, kontakta läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Fotivda är och vad det används för
2. Vad du behöver veta innan du använder Fotivda
3. Hur du använder Fotivda
4. Eventuella biverkningar
5. Hur Fotivda ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Den aktiva substansen i Fotivda är proteinkinashämmaren tivozanib. Tivozanib minskar blodtillförseln till cancern vilket gör att tillväxten och spridningen av cancerceller avtar. Den fungerar genom att blockera effekten av ett protein som kallas vaskulär endotelcellstillväxtfaktor (VEGF). Genom att blockera effekten av VEGF förhindras utvecklingen av nya blodkärl.
Fotivda används för att behandla vuxna med avancerad njurcancer. Det används när andra behandlingar som t.ex. interferon-alfa eller interleukin-2, ännu inte har använts eller inte hjälpt för att stoppa sjukdomen.
Vad du behöver veta innan produkten används
Använd inte Fotivda:
- om du är allergisk mot tivozanib eller någon annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar);
- om du använder johannesört (även kallad Hypericum perforatum, en örtmedicin som används för att behandla lätt nedstämdhet och lindrig oro).
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Fotivda:
- Om du har högt blodtryck.
Fotivda kan öka ditt blodtryck. Din läkare kommer att övervaka ditt blodtryck regelbundet. Om det är för högt kommer läkaren att ge dig läkemedel som kan sänka det eller minska din Fotivda-dos. Om ditt blodtryck fortsätter att vara för högt kan läkaren besluta att tillfälligt eller permanent avbryta behandlingen med Fotivda. Om du redan tar ett läkemedel mot högt blodtryck och läkaren minskar dosen av Fotivda eller avbryter behandlingen tillfälligt eller permanent kommer ditt blodtryck att kontrolleras regelbundet.
- Om du har eller har haft en aneurysm (förstoring och försvagning av en kärlvägg) eller en bristning i en kärlvägg.
- Om du har problem med blodproppar.
Behandlingen med Fotivda kan öka risken för att utveckla en blodpropp (trombos) i blodkärlen som skulle kunna lösgöra sig, vandra med blodströmmen och täppa till ett annat blodkärl. Tala om för läkaren om du någonsin har haft något av följande:- Blodpropp i lungorna (med hosta, bröstsmärta, plötslig andnöd eller blodhosta),
- Blodpropp i ben, armar, ögon eller hjärna (med smärta eller svullnad i händer och fötter, försämrad syn eller förändrat mentalt tillstånd)
- Stroke, eller tecken och symtom på en ”ministroke” (TIA; transitorisk ischemisk attack)
- Hjärtattack
- Högt blodtryck
- Diabetes
- Större kirurgiskt ingrepp
- Multipla skador, t.ex. brutna ben och skador på inre organ
- Inte kunnat röra dig under en längre period
- Hjärtsvikt som kan ge andnöd eller svullna fotleder
- Inte kan andas, blåaktig hudfärg, fingertoppar eller läppar, rastlöshet, oro, förvirring, förändrat medvetandetillstånd, snabb, ytlig andning, ett hjärta som skenar eller onormal ökad svettning.
- Om du har eller har haft någon av följande symtom eller behandlas för hjärtsvikt.
- Andnöd (dyspné) när du anstränger dig eller när du ligger ner
- Känsla av svaghet och trötthet
- Svullnad (ödem) i ben, fotleder och fötter
- Minskad förmåga till fysisk aktivitet
- Ihållande hosta eller väsande andningsljud med vitt eller rosa blodfärgat slem
Tecken och symtom på hjärtsvikt kommer att övervakas så länge du tar din medicin. Vid behov kan läkaren minska din Fotivda-dos, eller avbryta behandlingen tillfälligt eller permanent.
- Om du har eller behandlas för onormal hjärtfrekvens och onormal hjärtrytm (arytmi eller hjärtrytmrubbningar). Din läkare kommer att övervaka hur Fotivda påverkar ditt hjärta genom att registrera ditt hjärtas elektriska aktivitet (ett elektrokardiogram) eller genom att mäta kalcium-, magnesium- och kaliumnivåerna i blodet under behandlingen.
- Om du har problem med din lever.
Din läkare kommer regelbundet att övervaka hur bra din lever fungerar före och under behandlingen med Fotivda (t.ex. med blodprov) och vid behov ordinera dig att ta Fotivda mindre ofta.
- Om du har problem med sköldkörteln eller tar medicin för att behandla en sköldkörtelsjukdom. Behandlingen med Fotivda kan göra att sköldkörteln fungerar sämre än vanligt. Din läkare kommer regelbundet att övervaka hur bra din sköldkörtel fungerar före och under behandlingen med Fotivda (t.ex. med blodprov).
Tala med läkare, apotekspersonal eller sjuksköterska när du använder Fotivda:
- Om du får andnöd eller svullna fotleder
Kontakta genast en läkare eftersom det kan vara symtom på hjärtsvikt. Din läkare kommer att övervaka detta och beroende på hur allvarligt det är kan läkaren minska din Fotivda-dos eller avbryta behandlingen tillfälligt eller permanent.
- Om du har haft problem med blödning
Behandlingen med Fotivda kan öka risken för blödning. Kontakta genast läkare om du får blödningsproblem (smärtsam svullen mage (buk), om du kräks blod, hostar blod, får svart avföring, blod i urinen, huvudvärk eller om ditt mentala tillstånd förändras). Det kan vara nödvändigt att tillfälligt avbryta behandlingen med Fotivda.
- Om laboratorietester visar att det finns protein i din urin
Din läkare kommer att övervaka detta i början av och under behandlingen. Beroende på resultaten kan läkaren minska din Fotivda-dos, eller avbryta behandlingen tillfälligt eller permanent.
- Om du har en sjukdom i hjärnan som kallas posteriort reversibelt encefalopatisyndrom (PRES)
Kontakta genast läkare om du har symtom, t.ex. huvudvärk, krampanfall, brist på energi, förvirring, blindhet eller andra synstörningar eller neurologiska störningar som svaghet i en arm eller ett ben. Om PRES diagnosticeras kommer din läkare att avbryta behandlingen med Fotivda.
- Om huden på händer eller fotsulor blir torr, spricker, fjällar eller lossnar, eller om den sticker eller svider
Detta kan vara symtom på ett tillstånd som kallas hand-fot-hud-reaktion. Din läkare kommer att behandla detta tillstånd och beroende på hur allvarligt det är kan läkaren minska din Fotivda‑dos, eller avbryta behandlingen tillfälligt eller permanent.
- Om du har symtom på bristning i tarmen eller fistelbildning (ett hål utvecklas i magen eller tarmen eller onormala passager bildas mellan olika delar av tarmen), t.ex. svår magsmärta, frossbrytningar, feber, illamående, kräkningar eller tarmförstoppning, diarré eller blödning från ändtarmen.
Din läkare kommer regelbundet att övervaka dessa symtom under behandlingen med Fotivda.
- Om du behöver genomgå en operation eller annan form av kirurgi
Din läkare kan rekommendera dig att tillfälligt sluta ta Fotivda om du ska opereras eller genomgå kirurgi, eftersom det kan påverka sårläkningen.
Tryckbläcket på kapseln med Fotivda 890 mikrogram innehåller tartrazin (E102) som kan orsaka allergiska reaktioner.
Barn och ungdomar
Ge inte Fotivda till barn och ungdomar under 18 år. Detta läkemedel har inte studerats för barn och ungdomar.
Andra läkemedel och Fotivda
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas använda andra läkemedel. Detta gäller även örtmediciner och andra läkemedel som du tar utan recept.
Fotivda kan fungera mindre bra om det tas samtidigt som vissa andra läkemedel. Tala om för läkare om du tar någon av följande läkemedel, eftersom läkare kan besluta att ändra medicineringen:
- Dexametason (ett kortison som minskar inflammation och behandlar störningar i immunsystemet);
- Rosuvastatin (ett läkemedel som används för att hjälpa till att sänka kolesterolnivåerna i ditt blod);
- Fenobarbital, Fenytoin, Karbamazepin (används för att behandla epilepsi);
- Nafcillin, Rifampicin, Rifabutin, Rifapentin (antibiotika);
- Johannesört (även kallad Hypericum perforatum, en örtmedicin som används för att behandla lätt nedstämdhet och lindring oro) eftersom man inte bör använda denna örtmedicin samtidigt som Fotivda.
Graviditet, amning och fertilitet
- Ta inte Fotivda om du är gravid. Om du är gravid tala om det för din läkare som kommer att berätta om riskerna med Fotivda för dig och ditt barn.
- Både du och din partner måste använda effektiva preventivmedel. Om du eller din partner tar hormonella preventivmedel (p-piller, spiral eller plåster) måste du använda ytterligare en skyddsmetod under hela behandlingen och en månad efter behandlingens slut.
- Amma inte under behandlingen med Fotivda eftersom det inte är känt om det aktiva ämnet i Fotivda passerar över i bröstmjölken. Tala med läkare om du redan ammar.
- Tala med läkare om du planerar att skaffa barn eftersom Fotivda kan påverka fertiliteten hos män och kvinnor.
Körförmåga och användning av maskiner
Fotivda kan ha biverkningar som påverkar förmågan att köra eller använda maskiner. Undvik att köra eller använda maskiner om du känner dig svag, trött eller yr. Se även avsnitt Eventuella biverkningar.
Hur produkten används
Ta alltid detta läkemedel exakt enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Rekommenderad dos
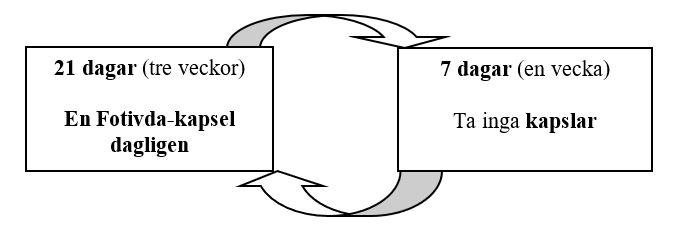
Rekommenderad dos är en kapsel Fotivda 1 340 mikrogram, en gång dagligen i 21 dagar (tre veckor), följt av 7 dagar (en vecka) utan behandling.
Detta schema upprepas i fyraveckorscykler.
Din läkare kommer att kontrollera dig regelbundet och i normala fall kommer du att fortsätta att ta Fotivda så länge behandlingen fungerar och du inte får oacceptabla biverkningar.
Reducerad dos
Om du får svåra biverkningar kan läkaren besluta att avbryta Fotivda-behandlingen och/eller sänka dosen till:
en kapsel Fotivda 890 mikrogram, en gång dagligen i 21 dagar (tre veckor), följt av 7 dagar (en vecka) utan behandling.
Detta schema upprepas i fyraveckorscykler.
Leverproblem
Om du har leverproblem kan din läkare ordinera dig att ta din dos varannan dag (dvs. en kapsel 1 340 mikrogram varannan dag).
Fotivda med mat och dryck
Fotivda måste tas med ett glas vatten och kan tas med eller utan mat. Svälj kapseln hel. Tugga inte, lös inte upp och öppna inte kapseln innan du sväljer den.
Om du har tagit för stor mängd Fotivda
Kontakta omedelbart läkare om du har tagit mer än den ordinerade dosen, motsvarande en kapsel dagligen.
För stor mängd Fotivda ökar risken för biverkningar eller risken att få svåra biverkningar, framför allt högt blodtryck. Uppsök sjukvård omedelbart om du upplever förvirring, om ditt mentala tillstånd förändras eller om du får huvudvärk. Alla dessa är symtom på högt blodtryck.
Om du har glömt att ta Fotivda
Ta inte en ersättningskapsel om du har missat att ta en kapsel. Ta nästa dos på vanlig tid.
Ta inte dubbel dos för att kompensera för en glömd kapsel.
Ta inte en ersättningskapsel om du kräks efter att ha tagit Fotivda. Ta nästa dos på vanlig tid.
Om du slutar ta Fotivda
Sluta inte att ta detta läkemedel om inte din läkare säger att du ska göra det. Om du slutar ta kapslarna kan ditt tillstånd förvärras.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Allvarliga biverkningar
Högt blodtryck är den mest allvarliga och är en mycket vanlig biverkning (se även avsnitt Vad du behöver veta innan produkten används, Varningar och försiktighet).
Kontakta omedelbart läkare om du tror att du har högt blodtryck. Symtom omfattar svår huvudvärk, suddig syn, andnöd, förändrat mentalt tillstånd, t.ex. du känner ångest, förvirring eller känner dig desorienterad.
Din läkare kommer att kontrollera ditt blodtryck regelbundet under behandlingen med Fotivda. Om du utvecklar högt blodtryck, kan din läkare skriva ut ett läkemedel mot högt blodtryck, minska dosen av Fotivda eller avbryta behandlingen med Fotivda.
Andra biverkningar
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
- Talsvårigheter
- Diarré
- Förlorad aptit, viktnedgång.
- Huvudvärk.
- Andningssvårigheter, andnöd vid fysisk aktivitet, hosta.
- Trötthet, ovanlig svaghet, smärta (inklusive i mun, skelett och armar, sidan av kroppen, ljumske, tumör).
- Inflammation i munnen, lätt smärta eller obehag i munnen, illamående, smärta och obehag i magen och uppsvälld mage.
- Hand-fot-syndrom med hudrodnad, svullnader, känsellöshet och hud som lossnar på handflator och fotsulor,
- Ryggsmärta.
- Trötthet och brist på energi.
Vanliga (kan förekomma hos upp till 1 av 10 användare)
- Underaktiv sköldkörtel som kan ge symtom t.ex. trötthet, slöhetstillstånd, muskelsvaghet, långsam puls, viktökning
- Sömnlöshet.
- Nervskador inklusive känsellöshet, stickningar, känslig hud eller känsellöshet och svaghet i armar och ben
- Synproblem inklusive suddig syn.
- Snabb puls, tryck över bröstet, hjärtattack/minskat blodflöde till hjärtat, blodpropp i en artär (blodkärl).
- Blodpropp i lungorna. Symtom omfattar hosta, bröstsmärta, plötslig andnöd eller blodhosta.
- Blodpropp i en djup ven i benet.
- Mycket högt blodtryck som leder till stroke, hudrodnad.
- Näsblödning, rinnande näsa, täppt näsa.
- Väderspänningar, halsbränna, sväljningssvårigheter och smärta vid sväljning, halsont, uppsvälld mage, svullen och smärtsam tunga, inflammerat, smärtsamt och/eller blödande tandkött.
- Smakförändring eller smakförlust
- Yrsel, öronringning, yrsel och en känsla av att allt snurrar (vertigo).
- Blödning, t.ex. i hjärna, från mun, tandkött, lungor, mage, tarmsår, kvinnligt könsorgan, anus, binjure.
- Hosta blod, kräkas blod
- Blekhet och trötthet pga. blödningar
- Illamående, matsmältningsbesvär, förstoppning, muntorrhet.
- Hud som kliar, hudutslag, hud som flagar, torr hud, håravfall, hudrodnad inklusive på händer och kropp, akne.
- Feber, bröstsmärta, svullna fötter och ben, frossbrytningar och låg kroppstemperatur.
- Ledsmärta och muskelsmärta.
- Ökad mängd protein i urinen.
- Onormala blodprovsresultat för levern, bukspottkörteln, njurarna och sköldkörteln.
- Inflammation i bukspottkörtel som orsakar svår magsmärta som kan stråla ut i ryggen.
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
- Hudutslag med varbildning, svampinfektioner.
- Ökad risk för blåmärken, blödning i huden,
- Överaktiv sköldkörtel (som kan ge symtom t.ex. ökad aptit, viktnedgång, värmeintolerans, ökade svettningar, darrningar, ökad puls), förstorad sköldkörtel.
- Ökat antal röda blodceller
- Sömnlöshet
- Minnesförlust.
- Tillfälligt minskat blodflöde till hjärnan
- Vattniga ögon.
- Täppta öron.
- Brist på blodflöde genom hjärtats blodkärl.
- Magsår i tunntarmen.
- Röd, svullen och öm hud, hudblåsor, ökad svettning, nässelutslag.
- Muskelsvaghet.
- Svullna eller irriterade slemhinnor.
- Onormalt elektrokardiogram (EKG), snabb och/eller oregelbunden puls.
- Hjärtsvikt. Symtom omfattar andnöd eller svullna fotleder. Svullnad i lungorna pga. av vätskeansamling
Sällsynta (kan förekomma hos upp till 1 av 1 000 användare)
- Posteriort reversibelt encefalopatisyndrom (PRES). Symtom omfattar huvudvärk, kramper, brist på energi, förvirring, blindhet eller andra synstörningar eller neurologiska störningar.
Ingen känd frekvens
- En förstoring och försvagning av en kärlvägg eller en bristning i en kärlvägg (aneurysmer och arteriella dissektioner).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka information om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och flaskan efter utg. dat. Utgångsdatumet är den sista dagen i angiven månad.
Tillslut flaskan väl. Fuktkänsligt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Fotivda 890 mikrogram, hård kapsel
Den aktiva substansen är tivozanib. Varje kapsel innehåller 890 mikrogram tivozanib (som hydrokloridmonohydrat).
Övriga innehållsämnen är:
- Kapselinnehåll: mannitol, magnesiumstearat.
- Kapselskal: gelatin, titandioxid (E171), indigokarmin (E132), järnoxid gul (E172).
- Tryckbläck, gult: shellack, propylenglykol, stark ammoniaklösning, titandioxid (E171), tartrazin (E102).
- Tryckbläck, blått: shellack, propylenglykol, stark ammoniaklösning, indigokarmin aluminiumlack (E132).
Fotivda 1 340 mikrogram, hård kapsel
Den aktiva substansen är tivozanib. Varje kapsel innehåller 1 340 mikrogram tivozanib (som hydrokloridmonohydrat).
Övriga innehållsämnen är:
- Kapselinnehåll: mannitol, magnesiumstearat.
- Kapselskal: gelatin, titandioxid (E171), järnoxid gul (E172).
- Tryckbläck, blått: shellack, propylenglykol, stark ammoniaklösning, indigokarmin aluminiumlack (E132).
Fotivdas utseende och förpackningsstorlekar
De hårda kapslarna med Fotivda 890 mikrogram har en mörkblå opak överdel och en ljusgul opak underdel, och är märkta ”TIVZ” på överdelen med gult bläck och ”LD” på underdelen med mörkblått bläck.
De hårda kapslarna med Fotivda 1 340 mikrogram har en ljusgul opak överdel och en ljusgul opak underdel, och är märkta ”TIVZ” på överdelen med mörkblått bläck och ”SD” på underdelen med mörkblått bläck.
Fotivda 890 mikrogram och Fotivda 1 340 mikrogram finns i förpackningar med 21 kapslar i HDPE‑flaskor med barnsäker förslutning.
Innehavare av godkännande för försäljning
Recordati Netherlands B.V.
Beechavenue 54,
1119PW Schiphol-Rijk
Nederländerna
Tillverkare
ALMAC PHARMA SERVICES (IRELAND) LIMITED
Finnabair Industrial Estate
Dundalk
Co. Louth
A91 P9KD
Irland
Denna bipacksedel ändrades senast i 07/2023
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu .