Pakkausseloste
IXIARO injektionsvätska, suspension
Tilläggsinformation
IXIARO injektionsvätska, suspension
Vaccin mot japansk encefalit (inaktiverat, adsorberat)
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du eller ditt barn får detta vaccin. Den innehåller information som är viktig för dig.
- Spara denna information, du och ditt barn kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare.
- Detta vaccin har ordinerats enbart åt dig och/eller ditt barn. Ge det inte till andra.
- Om du och/eller ditt barn får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad IXIARO är och vad det används för
2. Vad du behöver veta innan du och/eller ditt barn får IXIARO
3. Hur IXIARO ges
4. Eventuella biverkningar
5. Hur IXIARO ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
IXIARO är ett vaccin mot japanskt encefalitvirus.
Vaccinet gör att kroppen producerar ett eget skydd (antikroppar) mot sjukdomen.
IXIARO används för att förebygga infektion med japanskt encefalitvirus (JEV). Viruset förekommer främst i Asien och överförs till människa via mygg som stuckit infekterade djur (exempelvis gris). Många människor som smittas får lindriga symtom eller inga symtom alls. Personer som utvecklar en svår form av sjukdomen får vanligtvis influensaliknande symtom, med feber, köldfrossa, trötthet, huvudvärk, illamående och kräkningar. Förvirring och oro kan också förekomma på ett tidigt sjukdomsstadium.
IXIARO ska enbart ges till vuxna, ungdomar, barn och spädbarn i åldern 2 månader och äldre som reser till länder där JEV är endemiskt eller som är utsatta för risk genom sitt arbete.
Vad du behöver veta innan produkten används
Använd inte IXIARO:
- om du och/eller ditt barn är allergisk mot det aktiva ämnet eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar),
- om du och/eller ditt barn har fått en allergisk reaktion efter tidigare vaccination med IXIARO. Tecken på en allergisk reaktion kan vara kliande utslag, andfåddhet och svullnad i ansikte och tunga,
- om du och/eller ditt barn är sjuk med hög feber. I så fall kommer läkaren att skjuta upp vaccinationen.
Varningar och försiktighet
IXIARO får inte injiceras i ett blodkärl.
Grundvaccinationen ska ske minst en vecka före eventuell exponering för japanskt encefalitvirus (JEV).
Tala om för läkaren
- om du och/eller ditt barn har haft några hälsoproblem efter tidigare vaccinationer,
- om du och/eller ditt barn har några andra kända allergier,
- om du och/eller ditt barn har blödningsrubbningar (en sjukdom som gör att du och/eller ditt barn blöder mer än normalt) eller lågt antal blodplättar, vilket ökar risken för blödning eller blåmärken (trombocytopeni),
- om ditt barn är yngre än 2 månader, eftersomIXIARO inte har testats på spädbarn som är yngre än 2 månader,
- om ditt och/eller ditt barns immunförsvar är nedsatt (immunbrist) eller om du och/eller ditt barn tar mediciner som påverkar immunförsvaret (exempelvis kortison eller cancermediciner).
Din läkare kommer att diskutera eventuella risker och fördelar med att använda IXIARO.
Observera följande:
- IXIARO kan inte orsaka sjukdomen som den skyddar mot.
- IXIARO skyddar inte mot infektioner som orsakas av andra virus än japanskt encefalitvirus.
- Som med alla andra vaccin ger vaccination med IXIARO kanske inte skydd i samtliga fall.
- Du bör skydda dig och ditt barn på lämpligt sätt mot myggstick (med lämpliga kläder, myggmedel och myggnät) även efter vaccination med IXIARO.
Andra läkemedel och IXIARO
Enligt undersökningar som har utförts på människor för att utvärdera läkemedlets säkerhet och effekt (kliniska studier) kan IXIARO ges samtidigt med vaccin mot hepatit A och rabiesvaccin.
Tala om för läkare om du och/eller ditt barn tar, nyligen har tagit eller kan tänkas ta andra läkemedel, även receptfria sådana. Tala också om ifall du och/eller ditt barn nyligen fått något annat vaccin.
Graviditet, amning och fertilitet
Det finns inte tillräcklig information om användning av IXIARO på gravida eller ammande kvinnor.
Som en försiktighetsåtgärd ska du undvika IXIARO om du är gravid eller om du ammar.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du får detta vaccin.
Körförmåga och användning av maskiner
IXIARO har ingen eller försumbar effekt på körförmågan och användning av maskiner.
IXIARO innehåller kalium och natrium
Denna medicin innehåller kalium, mindre än 1 mmol (39 mg) per 0,5 ml enkeldos, dvs., huvudsakligen ”kaliumfritt”, och mindre än 1 mmol natrium (23 mg) per 0,5 ml enkeldos, det vill säga huvudsakligen ”natriumfritt”. Denna produkt kan innehålla rester av spår från natriummetabisulfit i mängder under detektionsgränsen.
Hur produkten används
Rekommenderad dosering för vuxna, ungdomar och barn i åldern 3 år och äldre är totalt 2 injektioner på vardera 0,5 ml:
- den första injektionen dag 0
- den andra injektionen 28 dagar efter den första injektionen (dag 28).
Vuxna mellan 18 och 65 år kan även vaccineras enligt följande:
- den första injektionen på dag 0
- den andra injektionen 7 dagar efter den första injektionen (dag 7).
Spädbarn och barn i åldern 2 månader till < 3 år
Rekommenderad dosering till spädbarn och barn i åldern 2 månader till < 3 år är totalt 2 injektioner på vardera 0,25 ml:
- den första injektionen dag 0
- den andra injektionen 28 dagar efter den första injektionen (dag 28).
Anvisningar om beredning av dosen på 0,25 ml finns i slutet av denna bipacksedel.
Se till att du och/eller ditt barn fullföljer hela vaccinationsprogrammet på 2 injektioner. Den andra injektionen ska ges minst 1 vecka innan du och/eller ditt barn löper risk att exponeras för japanskt encefalitvirus. Annars kommer du och/eller ditt barn inte att ha ett fullständigt skydd mot sjukdomen.
För vuxna, ungdomar, barn och spädbarn från 1 år kan en boosterdos ges inom andra året (dvs. 12–24 månader) efter första dosen av den rekommenderade grundimmuniseringen. Hos vuxna kan en andra boosterdos ges 10 år efter den första boosterdosen. För äldre personer (äldre än 65 år) kan den första boosterdosen ges tidigare. Din läkare beslutar om behovet och tidpunkten för boosterdoserna.
Administrering
Läkaren eller sjuksköterskan kommer att ge dig och/eller ditt barn IXIARO som en injektion i överarmsmuskeln (deltoidmuskeln). Vaccinet ska inte injiceras i ett blodkärl. Om du och/eller ditt barn lider av en blödningsrubbning kan din läkare eventuellt injicera vaccinet under huden (subkutant) istället.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Om du har glömt att få IXIARO
Om du och/eller ditt barn missar en avtalad tid för vaccination ska du tala med läkaren och få en ny tid för den andra injektionen. Utan den andra injektionen kommer du och/eller ditt barn inte att vara fullt skyddad mot sjukdomen. Det finns uppgifter som visar att den andra injektionen kan ges upp till 11 månader efter den första.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Flertalet av biverkningarna listade nedan har rapporterats i kliniska studier. De uppstår vanligtvis inom de första tre dagarna efter vaccinationen, är vanligtvis lindriga och försvinner inom några dagar.
Mycket vanliga (förekommer hos fler än 1 av 10 användare):
huvudvärk, muskelsmärta, smärta och ömhet på injektionsstället, trötthet
Vanliga (förekommer hos 1 till 10 användare av 100):
illamående, influensaliknande sjukdom, feber, andra reaktioner på injektionsstället (t.ex. rodnad, förhårdnader, svullnad, klåda)
Mindre vanliga (förekommer hos 1 till 10 användare av 1 000):
kräkningar, hudutslag, förändringar i lymfkörtlarna, migrän (bultande huvudvärk, ofta samtidigt med illamående, kräkningar och ljuskänslighet), yrsel, svindel (känsla av att omgivningen rör sig), diarré, magsmärta, svettningar, klåda, köldfrossa, allmän sjukdomskänsla, stelhet i muskler och leder, ledvärk, svaghet, onormala levervärden (förhöjda leverenzymer)
Sällsynta (förekommer hos 1 till 10 användare av 10 000):
hjärtklappning, snabba hjärtslag, andningssvårigheter, onormal känsel i huden (till exempel stickningar), nässelfeber, hudrodnad, smärta i ben eller armar, brist på blodplättar, nervinflammation, svullnad av armar och ben och vrister, smakrubbning, svullnad av ögonlock, svimning
Ytterligare biverkningar hos barn i åldern 2 månader till < 3 år
Hos barn i åldern 2 månader till < 3 år har följande biverkningar setts mer frekvent jämfört med barn i åldern 3 år till < 12 år, ungdomar och vuxna:
Mycket vanliga: feber (28,9 %), diarré (11,8 %), influensaliknande sjukdom (11,2 %), irritabilitet (11,0 %)
Vanliga: nedsatt aptit, kräkningar, hudutslag
Mindre vanliga: hosta
Rapportering av biverkningar
Om du och/eller ditt barn får biverkningar, tala med läkare. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet: www.fimea. fi .
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea Biverkningsregistret PB 55 FI-00034 Fimea
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
- Förvaras utom syn- och räckhåll för barn.
- Används före utgångsdatum som anges på kartongen och etiketten efter ”Utg.dat.”. Utgångsdatumet är den sista dagen i angiven månad.
- Förvaras i kylskåp (2°C - 8°C).
- Får ej frysas. Vaccin som har varit fryst ska inte användas.
- Förvaras i originalförpackningen. Ljuskänsligt.
- Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används av dig och/eller ditt barn. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
1 dos (0,5 ml) av IXIARO innehåller:
japanskt encefalitvirus stam SA14-14-2 (inaktiverat) 1,2 6 AE3
som motsvarar en styrka på ≤ 460 ng ED50
1 framställt ur vero-celler
2 adsorberat på hydratiserad aluminiumhydroxid, (cirka 0,25 milligram Al3+)
3 antigenenheter
Aluminiumhydroxid ingår som adjuvans i vaccinet.
De övriga innehållsämnena är: natriumklorid, kaliumdivätefosfat, dinatriumvätefosfat och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
IXIARO är en injektionsvätska, suspension (0,5 ml i en glasspruta med eller utan nål, förpackning om 1).
IXIARO är en vit, något mjölkaktig steril suspension som blir homogen när den skakas.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning:
Valneva Austria GmbH
Campus Vienna Biocenter 3
A-1030 Wien
Österrike
E-mail: infoixiaro@valneva.com
Tillverkare:
Valneva Austria GmbH
Campus Vienna Biocenter 3
A-1030 Wien
Österrike
För mer information om detta läkemedel, kontakta innehavaren av godkännandet för försäljning via följande e-postadress:
Denna bipacksedel ändrades senast 2021-03-19.
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu /.
Denna bipacksedel finns på samtliga EU-/EES-språk på Europeiska läkemedelsmyndighetens webbplats.
Direktiv för experterna inom hälsovården
Den förfyllda sprutan är endast avsedd för engångsbruk och får inte användas till mer än en person. Den förfyllda sprutan är klar för användning. Om det inte medföljer någon nål, ska en steril nål användas.
Använd inte om blisterfolien eller förpackningen har skadats.
Vid förvaring kan det förekomma en fin vit fällning och en klar färglös supernatant.
Skaka sprutan väl före administrering för att erhålla en vit, ogenomskinlig, homogen suspension.
Kassera vaccinet om det innehåller partiklar efter skakning eller om det ser missfärgat ut eller om sprutan ser ut att vara skadad.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Information om administreringen av en dos på 0,5 ml av IXIARO för personer som är 3 år och äldre
Följ nedanstående steg för att administrera hela dosen på 0,5 ml:
1. Skaka sprutan för att erhålla en homogen suspension.
2. Avlägsna skyddshättan från sprutspetsen genom att vrida den försiktigt. Undvik att bryta eller dra av spetsen eftersom det kan skada sprutan.
3. Fäst en nål vid den förfyllda sprutan.
Information om beredningen av en dos på 0,25 ml av IXIARO för användning till barn under 3 år
Följ nedanstående steg för att administrera en dos på 0,25 ml till barn i åldern 2 månader till < 3 år:
1. Skaka sprutan för att erhålla en homogen suspension.
2. Avlägsna skyddshättan från sprutspetsen genom att vrida den försiktigt. Undvik att bryta eller dra av spetsen eftersom det kan skada sprutan.
3. Fäst en nål vid den förfyllda sprutan.
4. Håll sprutan upprätt.
5. Tryck upp kolvproppen till kanten på den röda linjen på sprutkammaren, angiven med en röd pil (se figur 1)*, för att kassera överskottet.
6. Fäst en ny steril nål innan resten av vaccinet injiceras.
*Om du tryckte upp kolvproppen förbi den röda linjen finns det ingen garanti för att en dos på 0,25 ml återstår och en ny spruta ska användas.
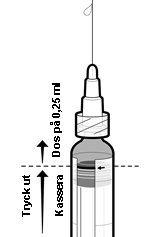
Figur 1: Beredning för administrering av en dos på 0,25 ml