Pakkausseloste
IXIARO injektioneste, suspensio
IXIARO-injektioneste, suspensio
Rokote Japanin aivotulehdusta vastaan (inaktivoitu, adsorboitu)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin sinulle tai lapsellesi annetaan tätä rokotetta, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Sinä ja lapsesi voitte tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Tämä lääke on määrätty vain sinulle ja/tai lapsellesi eikä sitä tule antaa muiden käyttöön.
- Jos havaitset haittavaikutuksia, käänny lääkärin puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä IXIARO on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat ja/tai lapsesi saa IXIAROa
3. Miten IXIAROa käytetään
4. Mahdolliset haittavaikutukset
5. IXIAROn säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
IXIARO on Japanin aivotulehdukselta suojaava rokote.
Rokote saa elimistön tuottamaan itse suojaa (vasta-aineita) tätä sairautta varten.
IXIAROa käytetään ehkäisemään Japanin aivotulehdusviruksen (JEV) aiheuttamaa infektiota. Virusta tavataan pääsääntöisesti Aasiassa. Se tarttuu ihmiseen infektoitunutta eläintä (esimerkiksi sikoja) pistäneiden hyönteisten pistosta. Monille tartunnan saaneille ihmisille tulee lieviä oireita tai niitä ei tule lainkaan. Vakavammin sairastuvilla ihmisillä Japanin aivotulehdus alkaa yleensä flunssan kaltaisella sairaudella, jossa ilmenee kuumetta, vilunväristyksiä, väsymystä, päänsärkyä, pahoinvointia ja oksentamista. Sairauden varhaisessa vaiheessa esiintyy myös sekavuutta ja levottomuutta.
IXIAROa tulee antaa vain aikuisille, nuorille, lapsille ja 2 kuukautta täyttäneille imeväisille, jotka matkustavat maihin, joissa JE-virusta esiintyy endeemisenä, tai jotka ovat vaarassa saada tartunnan työnsä kautta.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä IXIAROa
- Jos sinä ja/tai lapsesi olette allergisia vaikuttavalle aineelle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- Jos sinulle ja/tai lapsellesi on tullut allerginen reaktio saatuanne edellisen IXIARO-annoksen. Allergisen reaktion merkkejä voivat olla kutiava ihottuma, hengenahdistus sekä kasvojen ja kielen turvotus.
- Jos sinä ja/tai lapsesi olette sairaana ja teillä on korkea kuume. Siinä tapauksessa lääkäri lykkää rokotteen antamista.
Varoitukset ja varotoimet
IXIAROa ei saa pistää verisuoneen.
Primaari-immunisaatio tulisi olla hankittuna vähintään viikkoa ennen mahdollista altistumista Japanin aivotulehdusta aiheuttavalle virukselle.
Kerro lääkärille,
- Jos sinulla ja/tai lapsellasi on ollut terveydellisiä ongelmia minkä tahansa aikaisemmin saamanne rokotteen jälkeen.
- Jos sinulla ja/tai lapsellasi on jokin allergia.
- Jos sinulla ja/tai lapsellasi on verenvuototauti (sairaus, jonka takia sinä ja/tai lapsesi vuodatte verta tavallista enemmän) tai jos sinulla ja/tai lapsellasi on havaittu verihiutaleiden määrän vähenemistä, minkä vuoksi verenvuodon tai mustelmien (trombosytopenia) riski on kohonnut.
- Jos lapsesi on alle 2 kuukauden ikäinen, sillä IXIAROa ei ole tutkittu alle 2 kuukauden ikäisillä.
- Jos sinun tai lapsesi immuunijärjestelmä ei toimi kunnolla (immuunipuutos) tai jos sinä ja/tai lapsesi käytätte immuunijärjestelmään vaikuttavia lääkkeitä (esimerkiksi kortisonia tai syöpälääkkeitä).
Lääkäri keskustelee kanssasi IXIAROn käyttämiseen liittyvistä mahdollisista riskeistä ja hyödyistä.
Huomaa, että
- IXIARO ei voi aiheuttaa sitä sairautta, jolta se suojaa
- IXIARO ei suojaa muiden kuin Japanin aivotulehdusviruksen aiheuttamilta infektioilta
- kuten muutkaan rokotteet, IXIARO-rokotuskaan ei välttämättä aina suojaa sairaudelta
- sinun tulee huolehtia riittävistä varotoimenpiteistä hyönteisten puremia vastaan (asianmukainen vaatetus, hyönteiskarkotteiden ja -verkkojen käyttö) myös IXIARO-rokotteen saamisen jälkeen
Muut lääkevalmisteet ja IXIARO
Ihmisillä tehty lääkkeiden tehokkuutta ja turvallisuutta käsittelevät tutkimukset (kliininen tutkimus) ovat osoittaneet, että IXIAROa voidaan käyttää samanaikaisesti kuin hepatiitti A -rokotetta ja rabiesrokotetta.
Kerro lääkärille, jos sinä ja/tai lapsesi parhaillaan käytätte tai olette äskettäin käyttäneet tai saatatte joutua käyttämään muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt, tai jos olette hiljattain saaneet jonkin muun rokotteen.
Raskaus, imetys ja hedelmällisyys
IXIAROn käytöstä raskaana olevilla tai imettävillä naisilla on vain vähän tietoja.
Varotoimena IXIAROn käyttöä raskauden tai imetyksen aikana tulee välttää.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän rokotteen saamista.
Ajaminen ja koneiden käyttö
IXIAROlla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
IXIARO sisältää kaliumia ja natriumia
Tämä lääkevalmiste sisältää kaliumia alle 1 mmol (39 mg) per 0,5 ml yksittäinen annos eli sen voidaan sanoa olevan ”kaliumiton” ja alle 1 mmol natriumia (23 mg) per 0,5 ml yksittäinen annos, eli sen voidaan sanoa olevan ”natriumiton”. Tämä tuote saattaa sisältää jäännöksiä natriummetabisulfiitista, joka on havaitsemisrajan alapuolella.
Miten valmistetta käytetään
Suositeltu annostus aikuisille, nuorille ja 3 vuotta täyttäneille lapsille on kaikkiaan kaksi 0,5 ml:n rokoteannosta:
- Ensimmäinen ruiske annetaan päivänä 0.
- Toinen ruiske annetaan 28 päivää ensimmäisen ruiskeen jälkeen (päivänä 28).
18 – ≤ 65-vuotiaat aikuiset voidaan rokottaa myös seuraavasti:
- Ensimmäinen ruiske annetaan päivänä 0.
- Toinen ruiske annetaan 7 päivää ensimmäisen ruiskeen jälkeen (päivänä 7).
2 kuukautta täyttäneet mutta alle 3-vuotiaat lapset
Suositeltu annostus 2 kuukautta täyttäneille mutta alle 3-vuotiaille lapsille on kaikkiaan kaksi 0,25 ml:n rokoteannosta:
- Ensimmäinen ruiske annetaan päivänä 0.
- Toinen ruiske annetaan 28 päivää ensimmäisen ruiskeen jälkeen (päivänä 28).
Tämän pakkausselosteen lopussa on ohjeet 0,25 ml:n annoksen valmistamiseen.
Huolehdi siitä, että sinä ja/tai lapsesi saatte kaksi ruisketta sisältävän rokotussarjan kokonaan. Toinen ruiske olisi annettava vähintään viikkoa ennen kuin sinulla ja/tai lapsellasi on riski altistua JE-virukselle. Jos ette saa sitä, teillä ei ehkä ole täydellistä suojaa sairautta vastaan.
Aikuisille, nuorille, lapsille ja yli 1-vuotiaille sylilapsille voidaan antaa tehosteannos toisen vuoden (ts. 12–24 kuukauden) kuluessa suositellun perusrokotuksen ensimmäisen annoksen jälkeen. Aikuisille voidaan antaa toinen tehosteannos 10 vuoden kuluttua ensimmäisestä tehosteannoksesta. Iäkkäille henkilöille (>65 –vuotiaille) ensimmäisen tehosteannoksen voi antaa aikaisemmin. Lääkärisi päättää tehosteannosten tarpeesta ja ajankohdasta.
Annostelu
Lääkäri tai hoitaja antaa IXIARO-ruiskeen olkavarren lihakseen (hartialihakseen). Sitä ei saa pistää verisuoneen. Jos sinä ja/tai lapsesi sairastatte verenvuototautia, lääkäri voi antaa ruiskeen ihon alle.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Jos unohdat ottaa IXIARO-rokotteen
Jos suunniteltu ruiske jää väliin, ota yhteyttä lääkäriin ja sovi uusi aika toiselle ruiskeelle.
Ilman toista ruisketta sinulla ja/tai lapsellasi ei ole riittävää suojaa sairautta vastaan. Tutkimustiedot ovat osoittaneet, että toinen ruiske voidaan antaa viimeistään 11 kuukauden kuluttua ensimmäisestä ruiskeesta.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Useimpia näistä haittavaikutuksista on havaittu kliinisissä tutkimuksissa. Haittavaikutukset ilmenevät yleensä rokotteen antamista seuraavien kolmen päivän aikana. Ne ovat tavallisesti lieviä ja häviävät muutaman päivän kuluessa.
Hyvin yleinen (yli 1 käyttäjällä kymmenestä):
päänsärky, lihaskipu, pistoskohdan kipu ja arkuus sekä väsymys, uupumus
Yleinen (1−10 käyttäjällä sadasta):
pahoinvointi, influenssan kaltainen sairaus, kuume, muut pistoskohdan reaktiot (kuten punoitus, kovettuminen, turvotus, kutina)
Melko harvinainen (1−10 käyttäjällä tuhannesta):
oksentelu, ihottuma, imusolmukkeiden muutokset, migreeni (jyskyttävä päänsärky, johon liittyy usein pahoinvointia, oksentelua ja valonarkuutta), heitehuimaus, huimaus (pyörryttävä tunne), ripuli, vatsakipu, kutina, vilunväristykset, yleinen huonovointisuus, luu- ja lihasjäykkyys, nivelsärky, heikkous, epänormaalit tulokset maksakokeista (suurentuneet maksaentsyymiarvot)
Harvinainen (1−10 käyttäjällä 10 000:sta):
sydämentykytys, sydämen tiheälyöntisyys, hengenahdistus, epänormaali tunne iholla (esimerkiksi pistelyn tunne), nokkosihottuma, ihon punoitus, jalka- tai käsikipu, verihiutaleiden niukkuus, hermotulehdus, raajan turvotus ja nilkan turvotus, makuhäiriöt, silmäluomen turvotus sekä pyörtyminen
Muut haittavaikutukset 2 kuukautta täyttäneillä mutta alle 3-vuotiailla lapsilla
Kaksi kuukautta täyttäneillä mutta alle 3-vuotiailla lapsilla on havaittu seuraavia haittavaikutuksia useammin kuin 3 vuotta täyttäneillä mutta alle 12-vuotiailla lapsilla, nuorilla ja aikuisilla:
Hyvin yleinen: kuume (28,9 %), ripuli (11,8 %), influenssan kaltainen sairaus (11,2 %), ärtyisyys (11,0 %)
Yleinen: ruokahaluttomuus, oksentelu, ihottuma
Melko harvinainen: yskä
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan kansallisen ilmoitusjärjestelmän kautta: www.fimea. fi .
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytys jääkaapissa (2 °C ‑ 8 °C)
- Ei saa jäätyä. Jos rokote jäätyy, sitä ei pidä käyttää.
- Säilytä alkuperäispakkauksessa valolta suojattuna.
- Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä IXIARO sisältää
1 annos (0,5 ml) IXIAROa sisältää:
6 AU3 Japanin aivotulehdusviruskantaa SA14-14-2 (inaktivoitu)1,2, joka vastaa ≤ 460 ng:n ED50-arvon tehoa.
1 tuotettu Vero-soluissa
2 adsorboitu alumiinihydroksidiin, hydratoitu (noin 0,25 milligrammaa Al3+)
3 antigeeniyksikköä
Tämä rokote sisältää alumiinihydroksidia adjuvanttina.
Muut aineet ovat natriumkloridi, kaliumdivetyfostaatti, dinatriumvetyfosfaatti, injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko (pakkauskoot)
IXIARO on injektioneste (0,5 ml lasiruiskussa, erillisen neulan kanssa tai ilman sitä, yhden annoksen pakkauskoko).
IXIARO on valkoista, hieman maitomaista steriiliä suspensiota, josta tulee ravistamalla tasaista.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija
Valneva Austria GmbH
Campus Vienna Biocenter 3
A-1030 Wien
Itävalta
Sähköpostiosoite: infoixiaro@valneva.com
Valmistaja
Valneva Austria GmbH
Campus Vienna Biocenter 3
A-1030 Wien
Itävalta
Jos haluat lisätietoja tästä lääkevalmisteesta, ota yhteyttä sen myyntiluvan haltijaan seuraavan sähköpostiosoitteeseen kautta:
Tämä pakkausseloste on tarkistettu viimeksi 2021-03-19.
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta http://www.ema.europa.eu/ . Tämä pakkausseloste on saatavissa kaikilla EU-kielillä Euroopan lääkeviraston verkkosivustolla.
Ohjeet terveydenhuollon ammattilaiselle
Esitäytetty ruisku on kertakäyttöinen ja siitä tulee antaa rokote vain yhdelle henkilölle. Esitäytetty ruisku on käyttövalmis. Jos pakkauksessa ei ole neulaa, käytä steriiliä neulaa.
Älä käytä rokotetta, jos suojakalvo ei ole ehjä tai jos pakkaus on vaurioitunut.
Rokotteen säilytyksen aikana siinä voidaan havaita valkoista hienojakoista sakkaa ja kirkas, väritön supernatantti.
Ravista ruiskua hyvin ennen käyttöä, jotta saat aikaan valkoisen, samean, homogeenisen suspension. Älä käytä tuotetta, jos siinä on ravistamisen jälkeen hiukkasia, jos se vaikuttaa värjääntyneeltä tai jos ruisku näyttää vialliselta.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Tietoa 0,5 ml:n IXIARO-annoksen antamisesta 3 vuotta täyttäneille
Antaessasi koko 0,5 ml:n annoksen toimi seuraavasti:
1. Ravista ruiskua, niin että saat homogeenisen suspension.
2. Irrota korkki ruiskun kärjestä kiertämällä korkkia varovasti. Älä yritä napsauttaa tai vetää korkkia irti, sillä ruisku saattaa vaurioitua.
3. Kiinnitä neula esitäytettyyn ruiskuun.
Tietoa 0,25 ml:n IXIARO-annoksen valmistamisesta annettavaksi alle 3-vuotiaille
Antaessasi 0,25 ml:n annoksen vähintään 2 kuukauden mutta alle 3 vuoden ikäiselle lapselle, toimi seuraavasti:
1. Ravista ruiskua, niin että saat homogeenisen suspension.
2. Irrota korkki ruiskun kärjestä kiertämällä korkkia varovasti. Älä yritä napsauttaa tai vetää korkkia irti, sillä ruisku saattaa vaurioitua.
3. Kiinnitä neula esitäytettyyn ruiskuun.
4. Pidä ruiskua pystyasennossa.
5. Poista ylimääräinen suspensio työntämällä männän pysäytin ruiskun säiliön punaisen viivan reunaan asti, joka on merkitty punaisella nuolella (ks. kuvaa 1)*.
6. Kiinnitä ruiskuun uusi, steriili neula ennen jäljelle jääneen suspension injisointia.
*Jos työnnät männän pysäyttimen punaisen viivan ohi, jäljellä ei enää välttämättä ole 0,25 ml:n annosta, ja on syytä ottaa käyttöön uusi ruisku.
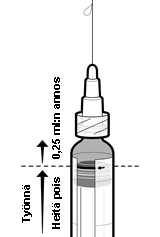
Kuva 1: Valmistelut ennen 0,25 ml:n annoksen antamista