Pakkausseloste
ORFADIN oral suspension 4 mg/ml
Tilläggsinformation
Orfadin 4 mg/ml oral suspension
nitisinon
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Orfadin är och vad det används för
- Vad du behöver veta innan du tar Orfadin
- Hur du tar Orfadin
- Eventuella biverkningar
- Hur Orfadin ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Orfadin innehåller den aktiva substansen nitisinon. Orfadin används för att behandla:
- en sällsynt sjukdom som kallas hereditär tyrosinemi typ 1 hos vuxna, ungdomar och barn (i alla åldersspann)
- en sällsynt sjukdom som kallas alkaptonuri (AKU) hos vuxna.
Vid dessa sjukdomar kan inte din kropp bryta ned aminosyran tyrosin helt (aminosyror är våra proteiners byggstenar), vilket gör att skadliga ämnen bildas. Dessa ämnen ansamlas i din kropp. Orfadin blockerar nedbrytningen av tyrosin och därför bildas inte de skadliga ämnena.
Vid behandling av hereditär tyrosinemi typ 1 måste du hålla en speciell diet när du tar detta läkemedel eftersom tyrosin kommer att finnas kvar i din kropp. Denna speciella diet har låg halt av tyrosin och fenylalanin (en annan aminosyra).
Vid behandling av AKU kan läkaren råda dig att hålla en speciell diet.
Vad du behöver veta innan produkten används
Ta inte Orfadin
- om du är allergisk mot nitisinon eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Amma inte medan du tar detta läkemedel, se avsnittet ”Graviditet och amning”.
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du tar Orfadin.
- Dina ögon kontrolleras av en ögonläkare före och regelbundet under behandling med nitisinon. Om dina ögon blir röda eller uppvisar andra tecken på påverkan, kontakta din läkare omedelbart för att få ögonen undersökta. Ögonproblem kan vara ett tecken på otillräcklig dietkontroll, se avsnitt Eventuella biverkningar.
Under behandlingen kommer blodprov att tas för att din läkare ska kunna kontrollera att behandlingen är tillräcklig och för att säkerställa att den inte har biverkningar som orsakar blodrubbningar.
Om du får Orfadin för behandling av hereditär tyrosinemi typ 1 kontrolleras din lever regelbundet eftersom sjukdomen påverkar levern.
En uppföljande undersökning bör ske var 6:e månad av din läkare. Om du upptäcker biverkningar rekommenderas kortare intervall mellan undersökningarna.
Andra läkemedel och Orfadin
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Orfadin kan påverka effekten av andra läkemedel, t.ex.:
- läkemedel mot epilepsi (t.ex. fenytoin)
- läkemedel mot blodproppar (t.ex. warfarin).
Orfadin med mat
Det rekommenderas att den orala suspensionen tas tillsammans med mat.
Graviditet och amning
Säkerheten för detta läkemedel har inte studerats hos gravida och ammande kvinnor.
Kontakta din läkare om du planerar att bli gravid. Om du blir gravid bör du omedelbart kontakta din läkare.
Amma inte medan du tar detta läkemedel, se avsnittet ”Ta inte Orfadin”.
Körförmåga och användning av maskiner
Detta läkemedel har mindre effekt på förmågan att framföra fordon och använda maskiner. Om du upplever biverkningar som påverkar synen ska du dock inte framföra fordon eller använda maskiner förrän synen är normal igen (se avsnitt Eventuella biverkningar ”Eventuella biverkningar”).
Orfadin innehåller natrium, glycerol och natriumbensoat
Detta läkemedel innehåller 0,7 mg (0,03 mmol) natrium per ml.
En dos om 20 ml oral suspension (10 g glycerol) eller mer kan ge huvudvärk, magbesvär och diarré.
Natriumbensoat kan förvärra gulsot (gulfärgning av hud och ögon) hos för tidigt födda och fullgångna nyfödda med gulsot och kan utvecklas till kärnikterus (hjärnskada på grund av ansamling av bilirubin i hjärnan). Det nyfödda barnets blodnivåer av bilirubin (ett ämne som leder till gulfärgning av huden vid höga nivåer) kommer att övervakas noga. Om nivåerna är betydligt högre än de ska vara, speciellt hos för tidigt födda barn med riskfaktorer som acidos (för lågt pH i blodet) och låg albuminnivå (ett protein i blodet) kommer behandling med Orfadin kapslar att övervägas istället för den orala suspensionen tills bilirubinnivåerna i plasma har normaliserats.
Hur produkten används
Ta alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Följ anvisningarna nedan för dosberedning och administrering noga för att säkerställa att rätt dos ges.
För hereditär tyrosinemi typ 1 ska behandling med detta läkemedel inledas och övervakas av läkare med erfarenhet av behandling av sjukdomen.
För hereditär tyrosinemi typ 1 är rekommenderad total dygnsdos 1 mg/kg kroppsvikt. Din läkare kommer att anpassa dosen individuellt.
Dosering en gång dagligen rekommenderas. På grund av begränsade data för patienter med kroppsvikt <20 kg, rekommenderas emellertid att den totala dygnsdosen delas upp på två dagliga dostillfällen för dessa patienter.
För AKU är rekommenderad dos 10 mg en gång dagligen.
Den orala suspensionen ges outspädd med en spruta direkt i munnen.
Orfadin får inte injiceras. Fäst ingen nål på sprutan.
Hur man förbereder dosen som ska ges
Dosen som din läkare ordinerat ska anges i ml suspension och inte i mg. Detta beror på att sprutan som används för att dra upp den korrekta dosen från flaskan är markerad i ml. Rådfråga apotekspersonal eller läkare om din ordination anges i mg.
Förpackningen innehåller en läkemedelsflaska med ett lock, en flaskadapter och tre sprutor för oral användning (1,5 ml, 3 ml och 6 ml). Använd alltid en av sprutorna för oral användning som medföljer för att ta läkemedlet.
- 1,5 ml-sprutan (den minsta sprutan) är markerad från 0,1 ml till 1,5 ml med mindre 0,05 ml-graderingar. Den används för att mäta upp doser på högst 1,5 ml.
- 3 ml-sprutan (den medelstora sprutan) är markerad från 1 ml till 3 ml med mindre 0,1 ml-graderingar. Den används för att mäta upp doser mellan 1,5 ml och upp till 3 ml.
- 6 ml-sprutan (den största sprutan) är markerad från 1 ml till 6 ml med mindre 0,25 ml-graderingar. Den används för att mäta upp doser på över 3 ml.
Det är viktigt att du använder korrekt spruta när du tar läkemedlet. Din läkare, apotekspersonal eller sjuksköterska ger information om vilken spruta som du ska använda beroende på den föreskrivna dosen.
Hur man förbereder en ny flaska av läkemedel för användning första gången:
Skaka flaskan kraftigt innan den första dosen ges eftersom långvarig förvaring medför att partiklarna bildar en fast kaka på botten av flaskan. Följ anvisningarna nedan:
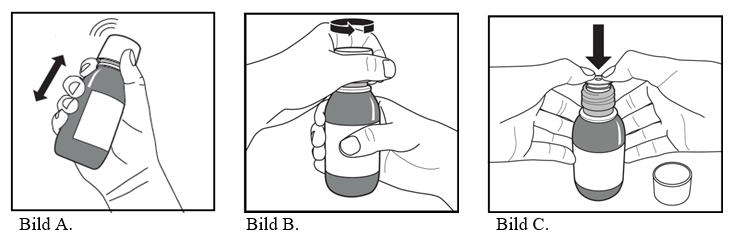
- Ta ut flaskan från kylskåpet. Anteckna datumet när flaskan tas ut från kylskåpet på flaskans etikett.
- Skaka flaskan kraftigt i minst 20 sekunder tills den fasta kakan i botten på flaskan är helt dispergerad (bild A).
- Avlägsna det barnskyddande skruvlocket genom att trycka ned det ordentligt och vrida moturs (bild B).
- Placera flaskan upprätt på ett bord. Tryck in plastadaptern ordentligt i flaskhalsen så långt som det går (bild C) och stäng flaskan med det barnskyddande skruvlocket.
För efterföljande dosering, se anvisningarna nedan: Hur man förbereder en dos av läkemedel.
Hur man förbereder en dos av läkemedel
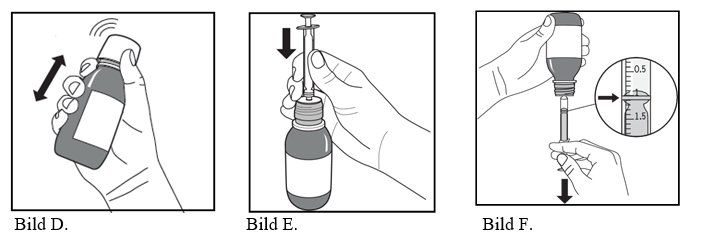
- Skaka flaskan kraftigt i minst 5 sekunder (bild D).
- Öppna därefter omedelbart flaskan genom att avlägsna det barnskyddande skruvlocket.
- Tryck ned kolven helt i sprutan.
- Håll flaskan i upprätt position och för in sprutan ordentligt i adapterns hål överst på flaskan (bild E).
- Vänd flaskan försiktigt upp och ned med sprutan på plats (bild F).
- För att dra upp den föreskrivna dosen (ml) ska man dra ned kolven långsamt tills den övre kanten av kolven är exakt i nivå med linjen som markerar dosen (bild F). Om eventuella luftbubblor observeras i den fyllda sprutan ska man trycka upp kolven tills luftbubblorna tryckts ut. Därefter ska man dra ned kolven på nytt tills den övre kanten är exakt i nivå med linjen som markerar dosen.
- Vänd flaskan i upprätt position på nytt. Ta ut sprutan från flaskan genom att försiktigt vrida ut den ur flaskan.
- Dosen ska administreras i munnen omedelbart (utan spädning) för att undvika att läkemedlet stelnar i sprutan. Sprutan ska tömmas långsamt för att möjliggöra sväljning. Snabb uttryckning av läkemedlet kan orsaka kvävning.
- Sätt tillbaka det barnskyddande skruvlocket direkt efter användning. Flaskadaptern ska inte avlägsnas.
- Flaskan kan förvaras i rumstemperatur (vid högst 25 °C).
Rengöring:
Rengör sprutan omedelbart med enbart kallt kranvatten. Vid behov ska kolven dras ut och tryckas in. Skaka av överskott av vatten och låt sprutan torka till nästa doseringstillfälle. Sprutan ska inte demonteras.
Om du har tagit för stor mängd av Orfadin
Om du har tagit mer av medicinen än du borde ska du kontakta din läkare eller apotekspersonal så snart som möjligt.
Om du har glömt att ta Orfadin
Ta inte dubbel dos för att kompensera för glömd dos. Om du glömmer att ta en dos, kontakta din läkare eller apotekspersonal.
Om du slutar att ta Orfadin
Kontakta din läkare, om du upplever att effekten av läkemedlet är för stark eller svag. Ändra inte dosen eller avsluta behandlingen utan att tala med din läkare.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Om du lägger märke till biverkningar som påverkar ögonen bör du rådgöra med din läkare omedelbart för att få ögonen undersökta. Behandling med nitisinon leder till högre tyrosinnivåer i blodet vilket kan orsaka ögonrelaterade symtom. Vanliga ögonrelaterade biverkningar (kan påverka fler än 1 av 100 patienter) som orsakas av högre tyrosinnivåer hos patienter med hereditär tyrosinemi typ 1 är inflammation i ögat (konjunktivit), grumling och inflammation i hornhinnan (keratit), ljuskänslighet (fotofobi) och ögonsmärta. Inflammation i ögonlocket (blefarit) är en mindre vanlig biverkning (kan påverka upp till 1 av 100 patienter).
Hos patienter med AKU är ögonirritation (keratopati) och ögonsmärta mycket vanliga rapporterade biverkningar (kan påverka fler än 1 av 10 patienter).
Andra biverkningar som rapporterats hos patienter med hereditär tyrosinemi typ 1 listas nedan:
Andra vanliga biverkningar
- Minskat antal blodplättar (trombocytopeni) och vita blodkroppar (leukocytopeni), brist på vissa vita blodkroppar (granulocytopeni).
Andra mindre vanliga biverkningar
- Ökat antal vita blodkroppar (leukocytos),
- klåda (pruritus), hudinflammation (exfoliativ dermatit), hudutslag.
Andra biverkningar som rapporterats hos patienter med AKU listas nedan:
Andra vanliga biverkningar
- bronkit
- lunginflammation
- klåda (pruritus), hudutslag.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats:
Suomi/Finland
[Finnish]
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
[Swedish]
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på flaskan och kartongen efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C – 8 °C).
Får ej frysas.
Förvaras upprätt.
Efter öppnandet kan produkten förvaras vid temperatur upp till 25 °C under en enda period på 2 månader, efter vilken produkten måste kasseras.
Glöm inte att skriva upp datumet på flaskan då du tar ut den ur kylskåpet.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är nitisinon. En ml innehåller 4 mg nitisinon.
- Övriga innehållsämnen är hydroxypropylmetylcellulosa, glycerol (se avsnitt Vad du behöver veta innan produkten används), polysorbat 80, natriumbensoat (E211) (se avsnitt Vad du behöver veta innan produkten används), citronsyramonohydrat, natriumcitrat (se avsnitt Vad du behöver veta innan produkten används), jordgubbsarom (konstgjord) och renat vatten.
Läkemedlets utseende och förpackningsstorlekar
Den orala suspensionen är en vit, något tjockare och ogenomskinlig suspension. Innan man skakar flaskan kan den likna en fast kaka på botten och en något opalskimrande vätska.
Den tillhandahålls i en 100 ml brun glasflaska med ett vitt barnskyddande skruvlock. Varje flaska innehåller 90 ml suspension.
Varje förpackning innehåller en flaska, en flaskadapter och tre sprutor för oral användning.
Innehavare av godkännande för försäljning
Swedish Orphan Biovitrum International AB
SE-112 76 Stockholm
Sverige
Tillverkare
Apotek Produktion & Laboratorier AB
Celsiusgatan 43
SE-212 14 Malmö
Sverige
Apotek Produktion & Laboratorier AB
Prismavägen 2
SE-141 75 Kungens Kurva
Sverige
Denna bipacksedel ändrades senast 07/2025.
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu. Där finns också länkar till andra webbplatser rörande sällsynta sjukdomar och behandlingar.