Pakkausseloste
FULVESTRANT MEDAC injektionsvätska, lösning i förfylld spruta 250 mg
Tilläggsinformation
Fulvestrant medac 250 mg injektionsvätska, lösning i förfylld spruta
fulvestrant
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
• Spara denna information, du kan behöva läsa den igen.
• Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
• Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
• Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Fulvestrant medac är och vad det används för
2. Vad du behöver veta innan du använder Fulvestrant medac
3. Hur du använder Fulvestrant medac
4. Eventuella biverkningar
5. Hur Fulvestrant medac ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Fulvestrant medac innehåller den aktiva substansen fulvestrant, vilken tillhör gruppen östrogenblockerare.
Östrogener, en typ av kvinnliga könshormoner, kan i vissa fall vara involverade i tillväxten av bröstcancer.
Fulvestrant medac används antingen:
• ensamt för att behandla postmenopausala kvinnor med en typ av bröstcancer som kallas östrogenreceptorpositiv bröstcancer som är lokalt avancerad eller har spridit sig till andra delar av kroppen (metastatisk) eller
• i kombination med palbociklib för behandling av kvinnor med en typ av bröstcancer som kallas hormonreceptorpositiv, human epidermal tillväxtfaktorreceptor 2‑negativ bröstcancer, som är lokalt avancerad eller har spridit sig till andra delar av kroppen (metastatisk). Kvinnor som inte har nått klimakteriet kommer också att behandlas med ett läkemedel som kallas luteiniserande hormonfrisättande hormon (LHRH)‑agonist.
När fulvestrant ges i kombination med palbociklib är det viktigt att du också läser bipacksedeln för palbociklib. Fråga läkaren om du har några frågor om palbociklib.
Fulvestrant som finns i Fulvestrant medac kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apotek eller annan hälsovårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Använd inte Fulvestrant medac
• om du är allergisk mot fulvestrant eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
• om du är gravid eller ammar.
• om du har allvarliga leverproblem.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Fulvestrant medac om något av nedanstående gäller för dig:
• problem med njurarna eller levern
• lågt antal trombocyter (bidrar till att blodet levrar sig) eller blödningsrubbning
• tidigare problem med blodproppar
• problem med benmineralförlust (osteoporos)
• alkoholproblem.
Barn och ungdomar
Fulvestrant medac är inte avsett för barn och ungdomar under 18 år.
Andra läkemedel och Fulvestrant medac
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Det är särskilt viktigt att du talar om för läkaren om du använder antikoagulantia (läkemedel som förhindrar blodproppar).
Graviditet, amning och fertilitet
Graviditet
Du får inte använda Fulvestrant medac om du är gravid. Om du kan bli gravid ska du använda ett effektivt preventivmedel när du behandlas med Fulvestrant medac och i 2 år efter din sista dos.
Amning
Du får inte amma när du behandlas med Fulvestrant medac.
Körförmåga och användning av maskiner
Fulvestrant medac påverkar troligtvis inte din förmåga att köra bil eller använda maskiner, men om du känner dig trött efter behandlingen ska du undvika att köra bil eller använda maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Fulvestrant medac innehåller 12,4 volymprocent etanol (alkohol), dvs. upp till 1 000 mg per dos, att likställa med 25 ml öl eller 10 ml vin per dos. Skadligt för den som lider av alkoholism. Att beakta för gravida eller ammande kvinnor, barn och högriskgrupper som patienter med leversjukdom eller epilepsi.
Fulvestrant medac innehåller 500 mg bensylalkohol i varje 5 ml.
Bensylalkohol kan orsaka allergiska reaktioner.
Om du har nedsatt leverfunktion eller nedsatt njurfunktion, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel. Stora mängder bensylalkohol kan lagras i kroppen och orsaka biverkningar (metabolisk acidos).
Fulvestrant medac innehåller 750 mg bensylbensoat i varje 5 ml.
Hur produkten används
Ta alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Rekommenderad dos är 500 mg fulvestrant (två 250 mg/5 ml injektioner) en gång per månad med en extra dos på 500 mg två veckor efter den initiala dosen.
Din läkare eller sjuksköterska kommer att ge dig Fulvestrant medac som en långsam intramuskulär injektion, en i vardera skinkan.
Om du har fått för stor mängd av Fulvestrant medac
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Du kan behöva omedelbar läkarbehandling om du får någon av följande biverkningar:
• Allergiska reaktioner (överkänslighet), däribland svullnad i ansikte, läppar, tunga och/eller hals som kan vara tecken på anafylaktiska reaktioner
• Tromboemboli (ökad risk för blodproppar)*
• Leverinflammation (hepatit)
• Leversvikt
Tala om för läkare, apotekspersonal eller sjuksköterska om du får följande biverkningar:
Mycket vanliga biverkningar (kan förekomma hos fler än en av 10 användare)
• Reaktioner vid injektionsstället, såsom smärta och/eller inflammation
• Förändringar av leverenzymvärden (visas via blodprov)*
• Illamående
• Svaghet, trötthet*
• Ledsmärta och muskuloskeletal smärta
• Blodvallningar
• Hudutslag
• Allergiska reaktioner (överkänslighet), däribland svullnad i ansikte, läppar, tunga och/eller hals
Alla övriga biverkningar:
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 användare)
• Huvudvärk
• Kräkningar, diarré, eller nedsatt aptit*
• Urinvägsinfektion
• Ryggsmärta*
• Ökning av bilirubin (ett gallpigment som produceras av levern)
• Tromboembolism (ökad risk för blodpropp)*
• Minskat antal blodplättar (trombocytopeni)
• Vaginal blödning
• Smärta i nedre delen av ryggen som strålar ut i benet på ena sidan (ischias)
• Plötslig svaghet, domning, stickning eller förlust av rörligheten i benet, framför allt endast på ena sidan av kroppen, plötsliga problem med att gå eller hålla balansen (perifer neuropati)
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 användare)
• Tjock, vitaktig vaginal flytning och svampinfektion
• Blåmärken och blödning vid injektionsstället
• Ökning av gamma‑GT, ett leverenzym som ses i ett blodprov
• Leverinflammation (hepatit)
• Leversvikt
• Domningar, stickningar och smärta
• Anafylaktiska reaktioner
*Inkluderar biverkningar för vilka den exakta påverkan av fulvestrant inte kan bedömas på grund av den underliggande sjukdomen.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för
läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 Fimea
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras och transporteras kallt (2 °C‑8 °C).
Förvara den förfyllda sprutan i originalförpackningen. Ljuskänsligt.
Avvikelser utanför temperaturområdet 2 °C‑8 °C ska begränsas. Detta inkluderar att undvika förvaring vid temperaturer som överstiger 30 °C och att inte överskrida en period på 28 dagar där den genomsnittliga förvaringstemperaturen för produkten är under 25 °C (men över 2 °C‑8 °C). Efter temperaturavvikelser ska produkten omedelbart återgå till de rekommenderade förvaringsförhållandena (förvaras och transporteras kallt 2 °C‑8 °C). Temperaturavvikelser har en kumulativ effekt på produktkvaliteten och tidsperioden på 28 dagar får inte överskridas under hela hållbarhetstiden på 48 månader för Fulvestrant medac. Exponering för temperaturer under 2 °C skadar inte produkten, förutsatt att den inte förvaras under -20 °C.
Används före utgångsdatum som anges på kartongen eller sprutans etikett efter ”EXP”.
Utgångsdatumet är den sista dagen i angiven månad.
Hälso- och sjukvårdspersonal är ansvarig för korrekt förvaring, användning och kassering av Fulvestrant medac 250 mg injektionsvätska, lösning i förfylld spruta.
Detta läkemedel kan utgöra en risk för vattenmiljön. Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
• Den aktiva substansen är fulvestrant. Varje förfylld spruta (5 ml) innehåller 250 mg fulvestrant. Varje ml lösning innehåller 50 mg fulvestrant.
• Övriga innehållsämnen är etanol (96 procent), bensylalkohol, bensylbensoat och ricinolja (raffinerad).
Läkemedlets utseende och förpackningsstorlekar
Fulvestrant medac är en klar, färglös till gul, fri från synliga partiklar, oljig och viskös lösning i en förfylld glasspruta. Varje spruta innehåller 5 ml injektionsvätska, lösning.
Fulvestrant medac har två förpackningsstorlekar:
• Kartong med ett blister med en förfylld spruta, en steril hypodermisk nål (BD SafetyGlide) och en bipacksedel.
Eller
• Kartong med två blister med en förfylld spruta vardera, två sterila hypodermiska nålar (BD SafetyGlide) och en bipacksedel.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
medac
Gesellschaft für klinische Spezialpräparate mbH
Theaterstr. 6
22880 Wedel
Tyskland
Tillverkare
S.C. Rompharm Company S.R.L.
Str. Eroilor 1A, 075100 Otopeni, Ilfov,
Rumänien
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under följande namn:
Finland, Italien, Polen, Tyskland:
Fulvestrant medac
Denna bipacksedel ändrades senast 01.12.2020
Direktiv för experterna inom hälsovården
Fulvestrant medac ska administreras genom användning av två förfyllda sprutor, se avsnitt Hur produkten används.
Instruktioner för administrering
Administrera injektionen enligt lokala riktlinjer för att utföra intramuskulära injektioner av stora volymer.
OBS! Försiktighet bör iakttas vid administrering av Fulvestrant medac på det dorsogluteala injektionsstället på grund av närheten till den underliggande ischiasnerven.
Varningar: Autoklavera inte den skyddade nålen (BD SafetyGlide Shielding Hypodermic Needle) före användning.
Händerna måste hela tiden hållas bakom nålen vid all användning och vid destruktion.
För båda sprutorna:
- Ta glassprutan från blistret och kontrollera att den inte är skadad.
- Ta bort den yttre förpackningen kring den skyddade nålen (SafetyGlide).
- Parenterala lösningar måste inspekteras visuellt avseende partiklar och missfärgning före administrering.
- Håll sprutan upprätt.
- Ta med andra handen tag i skyddslocket och vrid av locket försiktigt. Vidrör inte sprutspetsen för att bibehålla steriliteten (se Figur 1).
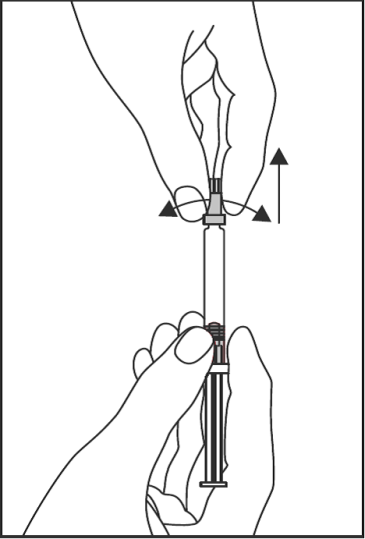
Figur 1
- Sätt fast den skyddade nålen på luer-lockfattningenoch vrid tills den sitter fast (se Figur 2).
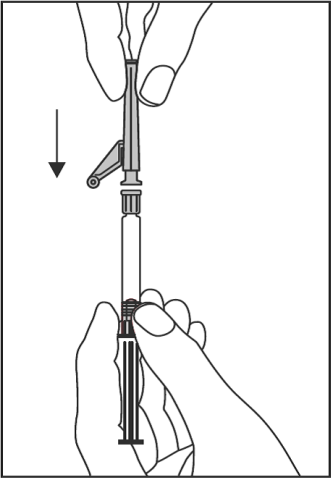
Figur 2
- Kontrollera att nålen är låst vid luer-lockfattningen innan du flyttar sprutan från vertikalplanet.
- Dra skyddshylsan rakt av nålen för att undvika att skada nålspetsen.
- För den förfyllda sprutan till administreringsstället.
- Ta bort nålskyddet.
- Tryck ut överskott av gas från sprutan.
- Administrera intramuskulärt långsamt (1‑2 minuter/injektion) i skinkan (glutealområdet). För att underlätta användning nålens avfasning är riktad uppåt mot hävarmen (se Figur 3).
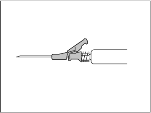
Figur 3
- Efter injektion, tryck omedelbart med ett finger mot den aktiverade hävarmen för att aktivera skyddsmekanismen (se Figur 4).
OBS! Aktivera genom att rikta nålen bort från dig själv och andra. Lyssna efter ett klickljud och kontrollera visuellt att nålspetsen är fullständigt täckt.
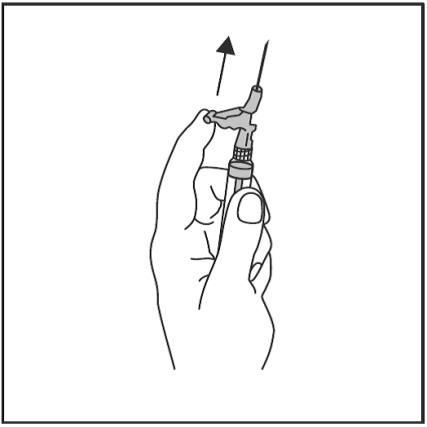
Figur 4
Destruktion
Förfyllda sprutor är endast avsedda för engångsbruk.
Detta läkemedel kan utgöra en risk för vattenmiljön. Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.