Pakkausseloste
ADYNOVI injektiokuiva-aine ja liuotin, liuosta varten 500 IU, 1000 IU, 2000 IU, 3000 IU
ADYNOVI 250 IU / 2 ml injektiokuiva-aine ja liuotin, liuosta varten
ADYNOVI 500 IU / 2 ml injektiokuiva-aine ja liuotin, liuosta varten
ADYNOVI 1 000 IU / 2 ml injektiokuiva-aine ja liuotin, liuosta varten
ADYNOVI 250 IU / 5 ml injektiokuiva-aine ja liuotin, liuosta varten
ADYNOVI 500 IU / 5 ml injektiokuiva-aine ja liuotin, liuosta varten
ADYNOVI 1 000 IU / 5 ml injektiokuiva-aine ja liuotin, liuosta varten
ADYNOVI 2 000 IU / 5 ml injektiokuiva-aine ja liuotin, liuosta varten
ADYNOVI 3 000 IU / 5 ml injektiokuiva-aine ja liuotin, liuosta varten
Rurioktokogi alfa pegoli (pegyloitu rekombinantti ihmisen hyytymistekijä VIII)
Lisäseuranta
![]() Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Kohdan 4.8 lopussa selitetään, kuinka haittavaikutuksista ilmoitetaan.
Tähän lääkkeeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti uutta turvallisuutta koskevaa tietoa. Voit auttaa ilmoittamalla kaikista mahdollisesti saamistasi haittavaikutuksista. Kohdan 4.8 lopussa selitetään, kuinka haittavaikutuksista ilmoitetaan.
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä ADYNOVI on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät ADYNOVI-valmistetta
3. Miten ADYNOVI-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. ADYNOVI-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
ADYNOVI sisältää vaikuttavana aineena rurioktokogi alfa pegolia, joka on pegyloitu ihmisen hyytymistekijä VIII. Ihmisen hyytymistekijä VIII:aa on muokattu sen vaikutusajan pidentämiseksi. Hyytymistekijä VIII:aa tarvitaan veren hyytymiseen ja verenvuodon tyrehtymiseen. Hemofilia A -potilailta (joilla on synnynnäinen tekijä VIII:n puutos) se puuttuu tai se ei toimi kunnolla.
ADYNOVI-valmistetta käytetään vähintään 12-vuotiaiden potilaiden verenvuodon hoitoon ja estämiseen, kun potilaalla on hemofilia A (perinnöllinen verenvuotohäiriö, jonka aiheuttaa hyytymistekijä VIII:n puutos).
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä ADYNOVI-valmistetta
- jos olet allerginen rurioktokogi alfa pegolille, oktokogi alfalle tai jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos olet allerginen hiiri- tai hamsteriproteiineille.
Jos et ole varma asiasta, kysy lääkäriltäsi.
Varoitukset ja varotoimet
On tärkeää merkitä ADYNOVI-valmisteen eränumero muistiin. Joten aina kun saat uuden ADYNOVI-pakkauksen, merkitse päivämäärä ja eränumero (pakkauksessa sanan ”Lot” jälkeen) muistiin ja säilytä tiedot turvallisessa paikassa.
Keskustele lääkärin kanssa ennen kuin käytät ADYNOVI-valmistetta.
On olemassa pieni riski, että saat anafylaktisen reaktion (vaikea, äkillinen allerginen reaktio) ADYNOVI-valmisteesta. Sinun pitää olla tietoinen allergisten reaktioiden varhaisista merkeistä, joita ovat muun muassa ihottuma, nokkosihottuma, paukamat, yleistynyt kutina, huulten ja kielen turvotus, hengitysvaikeudet, vinkuva hengitys, puristava tunne rinnassa, yleinen pahoinvointi ja huimaus. Nämä voivat olla anafylaktisen sokin varhaisia oireita. Muita anafylaktisen sokin oireita voivat lisäksi olla äärimmäinen huimaus, tajunnan menetys ja äärimmäiset hengitysvaikeudet.
Jos saat mitään näistä oireista, keskeytä injektio heti ja ota yhteyttä lääkäriin. Vaikeat oireet, kuten hengitysvaikeudet ja pyörryttäminen, vaativat nopeaa ensihoitoa.
Jos sairastat sydänsairautta, kerro siitä lääkärille, sillä hyytymiskomplikaatioiden riski on tällöin tavallista suurempi.
Potilaat, joille kehittyy tekijä VIII:n estäjä
Inhibiittorien (vasta-aineiden) muodostuminen on tunnettu komplikaatio, joka voi tapahtua minkä tahansa tekijä VIII-lääkkeen käytön aikana. Etenkin suurina pitoisuuksina esiintyessään nämä inhibiittorit estävät hoitoa vaikuttamasta oikein, ja sinua tai lastasi seurataan huolellisesti inhibiittorien kehittymisen varalta. Kerro lääkärille heti, jos verenvuotosi tai lapsesi verenvuoto ei ole hallittavissa ADYNOVI-valmisteella.
Katetriin liittyvät komplikaatiot
Jos hoitosi edellyttää keskuslaskimokatetria, on otettava huomioon keskuslaskimokatetriin liittyvät komplikaatiot, kuten paikalliset infektiot, bakteerien esiintyminen veressä ja katetrointipaikan tromboosi.
Lapset ja nuoret
ADYNOVI-valmistetta voidaan käyttää vain (vähintään 12-vuotiaiden) nuorten ja aikuisten hoitoon. Luetellut varoitukset ja varotoimet pätevät myös nuoriin.
Muut lääkevalmisteet ja ADYNOVI
Kerro lääkärille, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat joutua käyttämään muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä. Hemofilia A:ta esiintyy naisilla vain harvoin. Siksi saatavilla ei ole tietoja ADYNOVI-valmisteen käytöstä raskauden tai imettämisen aikana.
Ajaminen ja koneiden käyttö
ADYNOVI-valmisteella ei ole haitallista vaikutusta ajokykyyn tai koneiden käyttökykyyn.
ADYNOVI sisältää natriumia
ADYNOVI-valmiste sisältää enintään 12,42 mg natriumia (ruokasuola koostuu suurimmaksi osaksi natriumista) per injektiopullo, mikä on 0,62 % aikuisen päivittäisestä natriumin saantisuosituksesta.
Ruumiinpainostasi ja ADYNOVI-annoksestasi riippuen, voit saada valmistetta useita injektiopullollisia. Mikäli noudatat vähänatriumista ruokavaliota, on sinun otettava tämä huomioon.
Miten valmistetta käytetään
ADYNOVI-hoidon aloittaa ja sitä valvoo lääkäri, jolla on kokemusta hemofilia A -potilaiden hoidosta.
Lääkäri laskee ADYNOVI-annoksesi tilasi ja kehonpainosi perusteella sekä sen perusteella, käytetäänkö valmistetta verenvuodon ehkäisemiseen vai hoitoon. Se, miten usein lääkettä on annettava, riippuu siitä, miten hyvin ADYNOVI tehoaa omalla kohdallasi. Korvaushoito ADYNOVI-valmisteella on tavallisesti elinikäinen hoito.
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Verenvuodon ehkäisy
Tavallinen annos ADYNOVI-valmistetta on 40–50 IU painokiloa kohden kaksi kertaa viikossa annettuna.
Verenvuodon hoito
ADYNOVI-annos lasketaan kehonpainosi ja halutun tekijä VIII -pitoisuuden mukaan. Tekijä VIII:n tavoitepitoisuus riippuu verenvuodon vaikeudesta ja sijainnista.
Jos sinusta tuntuu, että ADYNOVI-valmisteen teho on riittämätön, keskustele lääkärin kanssa.
Lääkäri tekee tarvittavat laboratoriokokeet varmistaakseen, että tekijä VIII -pitoisuutesi on riittävä. Tämä on erityisen tärkeää, jos sinulle tehdään suuri leikkaus.
Käyttö lapsille ja nuorille
ADYNOVI-valmistetta voidaan käyttää vain (vähintään 12-vuotiaiden) nuorten ja aikuisten hoitoon. Nuorille annettava annos lasketaan myös painon mukaan, ja annos on sama kuin aikuisilla.
Miten ADYNOVI annetaan
ADYNOVI-valmisteen antaa tavallisesti lääkäri tai sairaanhoitaja injektiona laskimoon. Sinä voit tai joku muu voi myös antaa ADYNOVI-valmistetta injektiona, mutta vain riittävän koulutuksen jälkeen. Tämän pakkausselosteen lopussa on yksityiskohtaiset ohjeet itselääkitykseen.
Jos käytät enemmän ADYNOVI-valmistetta kuin sinun pitäisi
Käytä ADYNOVI-valmistetta juuri siten kuin lääkäri on määrännyt. Tarkista lääkäriltäsi tai apteekistasi, mikäli olet epävarma. Jos injektoit suositusta enemmän ADYNOVI-valmistetta, kerro siitä lääkärille mahdollisimman nopeasti.
Jos unohdat käyttää ADYNOVI-valmistetta
Älä injektoi kaksinkertaista annosta korvataksesi unohtamasi kerta-annoksen. Ota seuraava injektio aikataulun mukaisesti ja jatka lääkärisi neuvomalla tavalla.
Jos lopetat ADYNOVI-valmisteen käytön
Älä lopeta ADYNOVI-valmisteen käyttöä keskustelematta ensin lääkärin kanssa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Jos ilmenee vaikeita, äkillisiä allergisia reaktioita (anafylaksia), injektointi on keskeytettävä välittömästi. Ota välittömästi yhteyttä lääkäriin, jos saat jonkin seuraavista allergisten reaktioiden varhaisista oireista:
- ihottuma, nokkosihottuma, paukamat, yleistynyt kutina
- huulten ja kielen turpoaminen
- hengitysvaikeudet, vinkuva hengitys, puristava tunne rinnassa
- yleinen pahoinvointi
- huimaus ja tajunnan menetys.
Vaikeat oireet, kuten hengitysvaikeudet ja pyörrytys tai pyörtyminen, vaativat nopeaa ensihoitoa.
Potilaille, jotka ovat saaneet aiemmin hoitoa tekijä VIII:lla (enemmän kuin 150 hoitopäivää), inhibiittorien (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä) muodostuminen on melko harvinaista (alle yhdellä potilaalla 100:sta). Jos näin tapahtuu, lääkkeesi ei välttämättä enää toimi asianmukaisesti ja sinulle saattaa aiheutua jatkuvaa vuotoa. Jos näin tapahtuu, ota välittömästi yhteyttä lääkäriin.
Hyvin yleiset haittavaikutukset (voi esiintyä useammalla kuin 1 henkilöllä kymmenestä)
Päänsärky
Yleiset haittavaikutukset (voi esiintyä enintään 1 henkilöllä kymmenestä)
Pahoinvointi
Ripuli
Ihottuma
Huimaus
Nokkosihottuma
Melko harvinaiset haittavaikutukset (voi esiintyä enintään 1 henkilöllä sadasta)
Punoitus, allerginen reaktio (yliherkkyys)
Inhibiittori tekijä VIII:lle (potilaat, jotka ovat aiemmin saaneet hoitoa tekijä VIII:lla (enemmän kuin 150 hoitopäivää))
Joidenkin valkosolutyyppien lisääntyminen
Infuusioreaktio
Silmien punoitus
Ihoon liittyvä haittavaikutus
Haittavaikutukset, joiden yleisyyttä ei tunneta (saatavissa oleva tieto ei riitä yleisyyden arviointiin)
Mahdollisesti hengenvaaralliset reaktiot (anafylaksia)
Muut haittavaikutukset lapsilla
Haittavaikutusten esiintyvyys, tyyppi ja vaikeusaste lapsilla ovat odotettavasti samoja kuin aikuisilla.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C - 8 °C).
Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Kestoaikana kuiva-aineinjektiopulloa voidaan säilyttää huoneenlämmössä (korkeintaan 30 ºC) yhden, enintään 3 kuukautta kestävän jakson ajan. Tässä tapauksessa lääke vanhenee tämän 3 kuukauden jakson jälkeen tai valmisteen injektiopullossa mainitun viimeisen käyttöpäivämäärän jälkeen, sen mukaan, kumpi on aiemmin. Kirjaa 3 kuukauden huoneenlämmössä säilyttämisen päättymisaika ulkopakkaukseen. Valmistetta ei saa laittaa takaisin kylmäsäilytykseen huoneenlämmössä säilyttämisen jälkeen. Älä säilytä liuosta kylmässä käyttökuntoon saattamisen jälkeen.
Käytä valmiste 3 tunnin kuluessa, kun kuiva-aine on liuennut kokonaan.
Valmiste on kertakäyttöinen. Hävitä käyttämättä jäänyt osuus asianmukaisella tavalla.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä ADYNOVI sisältää
- Vaikuttava aine on rurioktokogi alfa pegoli (pegyloitu ihmisen hyytymistekijä VIII, joka valmistetaan rekombinantilla DNA-tekniikalla). Jokainen kuiva-aineinjektiopullo sisältää nimellisesti 250, 500, 1 000, 2 000 tai 3 000 IU rurioktokogi alfa pegolia.
- Liuotininjektiopullo sisältää 2 / 5 ml injektionesteisiin käytettävää vettä.
- Muut aineet ovat mannitoli, trehaloosidihydraatti, histidiini, glutationi, natriumkloridi, kalsiumklorididihydraatti, tris(hydroksimetyyli)aminometaani ja polysorbaatti 80. Ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä “ADYNOVI sisältää natriumia”.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
ADYNOVI on injektiokuiva-aine ja liuotin, liuosta varten (injektiokuiva-aine, liuosta varten). Kuiva-aine on valkoinen tai vaalea mureneva jauhe. Liuotin on kirkasta ja väritöntä liuosta. Käyttökuntoon saattamisen jälkeen liuos on kirkasta ja väritöntä eikä siinä näy vieraita hiukkasia.
Yksi pakkaus sisältää yhden kuiva-aineinjektiopullon ja yhden liuotininjektiopullon sekä laitteen käyttökuntoon saattamista varten (BAXJECT II Hi‑Flow).
Myyntiluvan haltija
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Wien
Valmistaja
Baxalta Belgium Manufacturing SA
Boulevard René Branquart, 80
B‑7860 Lessines
Belgia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Takeda Oy
Puh: 0800 774 051
medinfoEMEA@takeda.com
Tämä pakkausseloste on tarkistettu viimeksi 07/2023
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla osoitteessa http://www.ema.europa.eu/
Valmistus- ja anto-ohjeet
Käytä vain liuotinta ja liuoksen valmistukseen tarkoitettua sekoituslaitetta, jotka toimitetaan kunkin ADYNOVI-pakkauksen mukana. Kuiva-ainetta ei saa sekoittaa muiden lääkevalmisteiden tai liuotinten kanssa tai käyttää muiden sekoituslaitteiden kanssa.
Valmisteen nimen ja eränumeron kirjaaminen aina ADYNOVI-valmistetta annettaessa on erittäin suositeltavaa. Kuiva-aineinjektiopullossa on repäisyetiketit.
Käyttökuntoon saattamisen ohjeet
Injektiopullo
- Älä käytä etiketeissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen.
- Älä käytä, jos BAXJECT II Hi-Flow -laite, sen steriili suojus tai pakkaus on vaurioitunut tai jos niissä on merkkejä vauriosta.
1. Käytä käyttökuntoon saattamisen aikana antiseptista (puhdasta ja vähäbakteerista) tekniikkaa ja tasaista työskentelypintaa.
2. Anna kuiva-aine- ja liuotininjektiopullojen lämmetä huoneenlämpöisiksi (15 °C – 25 °C) ennen käyttöä.
3. Poista muovikorkit kuiva-aine- ja liuotininjektiopulloista.
4. Puhdista kumitulpat desinfiointipyyhkeellä ja anna kuivua ennen käyttöä.
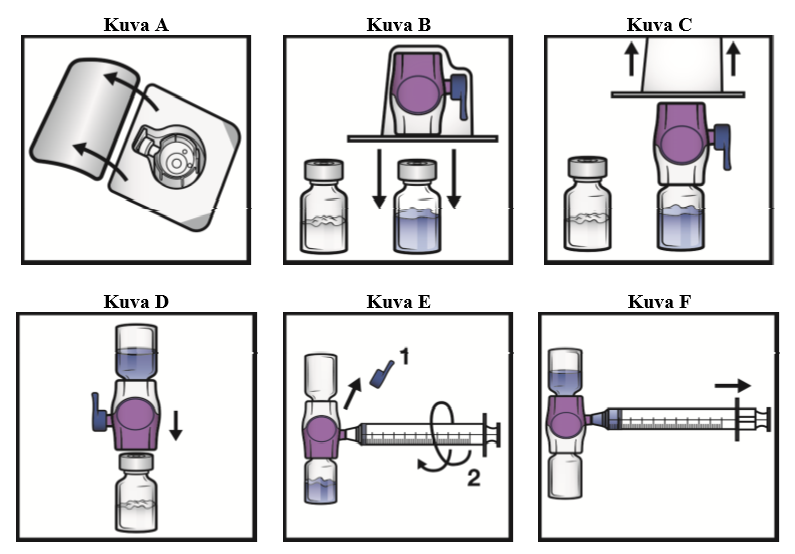
5. Avaa BAXJECT II Hi‑Flow -laitteen pakkaus vetämällä kansi pois ilman, että kosketat sisäpuolta (kuva A). Älä poista laitetta pakkauksesta.
6. Käännä pakkaus ylösalaisin. Työnnä läpinäkyvä muovipiikki kokonaan suoraan alas liuotininjektiopullon tulpan läpi (kuva B).
7. Tartu BAXJECT II Hi‑Flow -pakkaukseen sen reunasta ja vedä pakkaus irti laitteesta (kuva C). Älä poista sinistä korkkia BAXJECT II Hi‑Flow -laitteesta. Älä kosketa esillä olevaa purppuranpunaista muovipiikkiä.
8. Käännä järjestelmä ylösalaisin siten, että liuotininjektiopullo on yläpuolella. Työnnä purppuranpunainen muovipiikki nopeasti kokonaan suoraan alas kuiva-aineinjektiopullon tulpan läpi (kuva D). Tyhjiö vetää liuottimen kuiva-aineinjektiopulloon.
9. Pyöritä varovasti, kunnes kuiva-aine on liuennut kokonaan. Älä säilytä valmistetta jääkaapissa käyttökuntoon saattamisen jälkeen.
Kuiva-aineinjektiopullo
- Älä käytä etiketeissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen.
- Ei saa käyttää, jos läpipainopakkauksen kansi ei ole tiiviisti kiinni.
- Älä säilytä liuosta kylmässä käyttökuntoon saattamisen jälkeen.
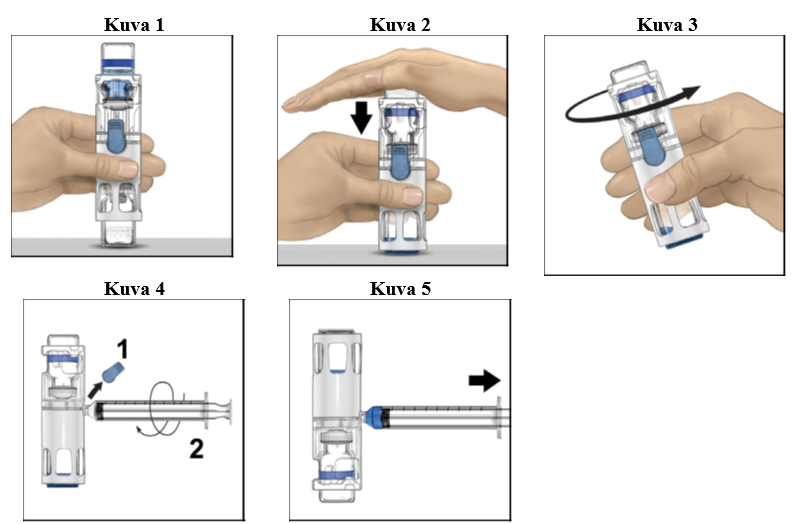
1. Jos valmistetta säilytetään vielä jääkaapissa, ota suljettu läpipainopakkaus (sisältää kuiva-aine- ja liuotininjektiopullot esikoottuina käyttökuntoon saattamiseen tarkoitetun järjestelmän kanssa) jääkaapista ja anna sen lämmetä huoneenlämpöiseksi (15 °C – 25 °C).
2. Pese kätesi huolellisesti saippualla ja lämpimällä vedellä.
3. Avaa ADYNOVI-läpipainopakkaus poistamalla kansi. Poista BAXJECT III ‑järjestelmä läpipainopakkauksesta.
4. Aseta kuiva-aineinjektiopullo tasaiselle pinnalle niin, että liuotininjektiopullo on ylimpänä (kuva 1). Liuotininjektiopullossa on sininen raita. Älä poista sinistä korkkia, ennen kuin myöhemmässä vaiheessa niin neuvotaan.
5. Pitele kuiva-aineinjektiopulloa toisella kädellä BAXJECT III ‑järjestelmässä ja paina liuotininjektiopulloa tasaisesti alaspäin toisella kädellä, kunnes järjestelmä on painunut kokonaan kasaan ja liuotin virtaa kuiva-aineinjektiopulloon (kuva 2). Älä kallista järjestelmää, ennen kuin siirto on valmis.
6. Tarkista, että liuottimen siirto on valmis. Pyöritä varovasti, kunnes kaikki materiaali on liuennut (kuva 3). Varmista, että kuiva-aine on liuennut kokonaan. Muuten kaikki käyttökuntoon saatettu liuos ei kulkeudu laitteen suodattimen läpi. Valmiste liukenee nopeasti (tavallisesti alle minuutissa). Käyttökuntoon saattamisen jälkeen liuoksen pitäisi olla kirkasta ja väritöntä eikä siinä saa näkyä vieraita hiukkasia.
Ohjeet injektointiin
Tärkeä huomautus:
- Tarkista käyttökuntoon saatettu liuos hiukkasten ja värinmuutosten varalta ennen antoa (liuoksen tulee olla kirkasta ja väritöntä eikä siinä saa olla hiukkasia).
Älä käytä, jos liuos ei ole täysin kirkasta tai liuennut täydellisesti.
Injektiopullo
1. Poista sininen korkki BAXJECT II Hi‑Flow -laitteesta (kuva E). Älä vedä ilmaa ruiskuun. Liitä ruisku BAXJECT II Hi‑Flow -laitteeseen. Luer-lock-ruiskun käyttöä suositellaan.
2. Käännä järjestelmä ylösalaisin (kuiva-aineinjektiopullo on nyt yläpuolella). Vedä käyttökuntoon saatettu liuos ruiskuun vetämällä mäntää taakse hitaasti (kuva F).
3. Irrota ruisku. Liitä sopiva neula ja injektoi laskimoon. Jos potilaan on tarkoitus saada enemmän kuin yksi injektiopullo ADYNOVI-valmistetta, samaan ruiskuun voi vetää usean injektiopullon sisällön.
Kunkin ADYNOVI-injektiopullon sekoittamiseen liuottimen kanssa tarvitaan erillinen BAXJECT II Hi‑Flow -laite.
4. Anna valmiste enintään 5 minuutin kuluessa (enimmäisinfuusionopeus on 10 ml/min).
5. Hävitä käyttämättä jäänyt osuus asianmukaisella tavalla.
Kuiva-aineinjektiopullo
1. Poista sininen korkki BAXJECT III -laitteesta (kuva 4). Älä vedä ilmaa ruiskuun. Liitä ruisku BAXJECT III -laitteeseen. Luer-lock-ruiskun käyttöä suositellaan.
2. Käännä järjestelmä ylösalaisin (kuiva-aineinjektiopullo on nyt yläpuolella). Vedä käyttökuntoon saatettu liuos ruiskuun vetämällä mäntää taakse hitaasti (kuva 5).
3. Irrota ruisku, liitä perhosneula ruiskuun ja injektoi käyttökuntoon saatettu liuos laskimoon. Liuos on annettava hitaasti, potilaan mukavuustason mukaan määritetyllä nopeudella, joka ei ylitä 10 ml:aa minuutissa. (Ks. kohta Mahdolliset haittavaikutukset, Mahdolliset haittavaikutukset.)
4. Hävitä käyttämättä jäänyt osuus asianmukaisella tavalla.
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille:
Tarvittaessa annettava hoito
Seuraavissa verenvuototapahtumissa tekijä VIII:n aktiivisuus ei saa vastaavan ajanjakson aikana laskea annetun plasma-aktiivisuustason alapuolelle (prosentteina normaalista tai IU/dl-yksiköissä). Seuraavaa taulukkoa voidaan käyttää annoksen määrityksen apuna verenvuototapahtumissa ja leikkauksissa.
Taulukko 1 Annostusohje verenvuototapahtumia ja leikkauksia varten
|
Verenvuodon laajuus / kirurgisen toimenpiteen tyyppi |
Tekijä VIII:n tarvittava pitoisuus (% tai IU/dl) |
Annosten antotiheys (tunteina) / hoidon kesto (päivinä) |
|
Verenvuoto |
||
|
Alkava hemartroosi, lihasverenvuoto tai suun verenvuoto |
20 – 40 |
Injektio toistetaan 12–24 tunnin välein vähintään 1 päivän ajan, kunnes kipuna ilmenevä vuotoepisodi on mennyt ohi tai paraneminen on tapahtunut. |
|
Laajempi hemartroosi, lihasverenvuoto tai hematooma |
30 – 60 |
Injektio toistetaan 12–24 tunnin välein 3–4 tai useamman päivän ajan, kunnes kipu lakkaa ja akuutti toimintakyvyn vajaus korjautuu. |
|
Hengenvaaralliset verenvuodot |
60 – 100 |
Injektio toistetaan 8–24 tunnin välein, kunnes vaara on ohi. |
|
Leikkaus |
||
|
Pieni Hampaanpoisto mukaan lukien. |
30 – 60 |
Injektio toistetaan 24 tunnin välein vähintään 1 päivän ajan, kunnes paraneminen on tapahtunut. |
|
Suuri |
80 – 100 (leikkausta ennen ja sen jälkeen) |
Injektio toistetaan 8–24 tunnin välein, kunnes haava on parantunut riittävästi. Hoitoa jatketaan sen jälkeen vielä vähintään 7 vuorokauden ajan, jotta tekijä VIII -aktiivisuus pysyy 30–60 %:n (IU/dl) tasolla. |
Estohoito
Pitkäaikaisessa estohoidossa suositeltu annos on 40–50 IU ADYNOVI-valmistetta painokiloa kohden kaksi kertaa viikossa, 3–4 päivän välein annettuna. Annosten ja antovälien säätämistä voidaan harkita saavutettujen tekijä VIII -pitoisuuksien ja potilaskohtaisen vuototaipumuksen perusteella.
Pediatriset potilaat
Tarvittaessa annettavan hoidon annostus pediatrisille potilaille (12–18-vuotiaille) on sama kuin aikuispotilaiden annostus. 12–17-vuotiaiden potilaiden estohoito ei eroa aikuispotilaiden estohoidosta. ADYNOVI-valmisteen pitkäaikaisen käytön turvallisuutta alle 12 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Annosten ja antovälien säätämistä voidaan harkita saavutettujen tekijä VIII -pitoisuuksien ja potilaskohtaisen vuototaipumuksen perusteella.