Pakkausseloste
TWINRIX PAEDIATRIC injektioneste, suspensio, esitäytetty ruisku
Twinrix Paediatric, injektioneste, suspensio esitäytetyssä ruiskussa.
Hepatiitti A- (inaktivoitu) ja hepatiitti B (rDNA) (HAB) -rokote (adsorboitu)
Yleisiä ohjeita
Lue tämä seloste huolellisesti, ennen kuin saat/lapsesi saa tätä rokotetta, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä rokote on määrätty vain sinulle/lapsellesi eikä sitä tule antaa muiden käyttöön.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tämä seloste on kirjoitettu rokotteen saajalle, mutta rokote voidaan myös antaa nuorelle tai lapselle, joten voit lukea sitä lapsesi puolesta.
Tässä pakkausselosteessa kerrotaan
1. Mitä Twinrix Paediatric on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat Twinrix Paediatricia
3. Miten Twinrix Paediatric annetaan
4. Mahdolliset haittavaikutukset
5. Twinrix Paediatricin säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Twinrix Paediatric on rokote, jota käytetään 1 ‑ 15-vuotiaille pikkulapsille, lapsille ja nuorille kahden taudin, hepatiitti A:n ja hepatiitti B:n ehkäisyyn. Rokote vaikuttaa saamalla elimistössä aikaan suojan (vasta-ainetuotannon) näitä tauteja vastaan.
- Hepatiitti A: Hepatiitti A on tartuntatauti, joka voi vaikuttaa maksaan. Sen aiheuttaa hepatiitti A ‑virus. Hepatiitti A ‑virus voi tarttua ihmisestä toiseen ruoan ja juoman välityksellä tai uimalla jäteveden saastuttamassa vedessä. Hepatiitti A:n oireet alkavat 3 ‑ 6 viikon kuluttua viruskosketuksesta. Niitä ovat pahoinvointi (huono olo), kuume, kipu ja kolotus. Muutaman päivän kuluttua silmänvalkuaiset ja iho voivat muuttua keltaisiksi (keltatauti). Oireiden vaikeusaste ja tyyppi voivat vaihdella. Pikkulapsilla ei keltaisuutta ehkä esiinny. Useimmat toipuvat täysin, mutta sairaus on yleensä niin vaikea, että se vaatii noin kuukauden poissaolon työstä.
- Hepatiitti B: Hepatiitti B:n aiheuttaa hepatiitti B ‑virus. Se aiheuttaa maksan turpoamista (tulehdusta). Virusta on tartunnankantajan elimistön nesteissä kuten veressä, siemennesteessä, emätineritteessä tai syljessä.
Rokotus on paras tapa suojautua näiltä taudeilta. Mikään rokotteen aineosa ei aiheuta tartuntaa.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Twinrix Paediatricia ei saa antaa jos:
- olet allerginen
- vaikuttaville aineille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- neomysiinille
Allergisen reaktion merkkejä voivat olla kutiava ihottuma, hengenahdistus ja kasvojen tai kielen turvotus.
- sinulla on aiemmin ollut allerginen reaktio jollekin hepatiitti A- ja hepatiitti B ‑rokotteelle.
- sinulla on vaikea tulehdussairaus ja korkea kuume (yli 38°C). Lievän infektion kuten nuhakuumeen ei pitäisi olla ongelma, mutta puhu asiasta ensin lääkärin kanssa.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin saat Twinrix Paediatricia jos:
- sinulla on ollut jotain terveysongelmia aiemman rokotuksen jälkeen.
- sinulla on sairaudesta tai lääkityksestä johtuva heikko immuunijärjestelmä.
- sinulla on verenvuotohäiriö tai mustelmataipumusta.
Pyörtymistä voi esiintyä (enimmäkseen nuorilla) pistoksena annettavan rokotuksen jälkeen, tai jopa ennen. Kerro lääkärille tai hoitajalle, jos olet pyörtynyt aikaisemman pistoksena annettavan rokotuksen yhteydessä.
Muut lääkevalmisteet ja Twinrix Paediatric
Twinrix Paediatric voidaan antaa samanaikaisesti Ihmisen papilloomavirus (HPV) rokotteen kanssa eri injektiokohtiin (toiselle puolelle kehoa, esim. toiseen käsivarteen).
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan otat, olet äskettäin ottanut tai saatat ottaa muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Twinrix Paediatricin erittymisestä äidinmaitoon ei tiedetä. Rokotteen ei kuitenkaan odoteta aiheuttavan haittaa imeväiselle.
Twinrix Paediatric sisältää neomysiiniä ja natriumia
Kerro lääkärille, jos sinulla on ollut allerginen reaktio neomysiinille (antibiootti).
Tämä rokote sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Miten valmistetta käytetään
Saat kaikkiaan kolme pistosta kuuden kuukauden aikana. Kukin injektio annetaan eri käynnillä. Ensimmäinen annos annetaan sovittuna päivänä. Loput kaksi annosta annetaan kuukauden ja kuuden kuukauden kuluttua ensimmäisestä annoksesta.
- Ensimmäinen annos: sovittuna päivänä
- Toinen annos: 1 kuukauden kuluttua
- Kolmas annos: 6 kuukauden kuluttua ensimmäisestä annoksesta
Jos tarvitaan lisäannoksia tai tehosterokotus, lääkäri kertoo siitä.
Jos sinulta jää sovittu rokotuskerta väliin, sovi lääkärin kanssa uudesta käynnistä.
Huolehdi siitä, että saat koko kolmen pistoksen rokotussarjan. Muutoin rokotussuoja voi jäädä vaillinaiseksi.
Lääkäri antaa Twinrix Paediatric ‑rokotuksen pistoksena sinulle olkavarsilihakseen ja lapsellesi reisilihakseen.
Rokotetta ei saa koskaan antaa laskimoon.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki rokotteet, tämäkin rokote voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Seuraavia haittavaikutuksia on esiintynyt:
Seuraavia haittavaikutuksia on esiintynyt kliinisissä lääketutkimuksissa, rokotteen rutiinikäytössä tai monovalenttisen hepatiitti A- ja B-rokotteen rutiinikäytössä tai aikuisille tarkoitetulla Twinrix-lääkemuodolla.
Hyvin yleiset (kerran tai useammin kuin kerran 10 rokotuksen jälkeen): injektiokohdan kipu ja punoitus.
Yleiset (harvemmin kuin kerran 10 rokotuksen jälkeen): uneliaisuus, päänsärky, pahoinvointi, ruokahaluttomuus, injektiokohdan turvotus tai mustelmat, huonovointisuus, väsymys, kuume 37,5ºC tai enemmän, ärtyneisyys.
Melko harvinaiset (harvemmin kuin kerran 100 rokotuksen jälkeen): ripuli, oksentelu, vatsakipu, ihottuma, lihaskipu, ylähengitystieinfektio.
Harvinaiset (harvemmin kuin kerran 1000 rokotuksen jälkeen): suurentuneita imusolmukkeita niskassa, kainalokuopassa tai nivuksissa (lymfadenopatia), huimaus, iho ei reagoi kipuun tai kosketukseen (hypoestesia), pistely ja kihelmöinti (parestesia), nokkosihottuma, kutina, nivelkipu, matala verenpaine, flunssankaltaiset oireet, kuten korkea kuume, kurkkukipu, vuotava nenä, yskä ja vilunväristykset.
Hyvin harvinaiset (harvemmin kuin kerran 10 000 rokotuksen jälkeen): trombosyyttien (verihiutaleiden) määrän väheneminen, mikä lisää verenvuotojen tai mustelmien riskiä (trombosytopenia), ihon läpi näkyvät violetit tai punaisenruskeat täplät (trombosytopeeninen purpura), aivojen turvotus tai infektio (enkefaliitti), aivojen degeneratiivinen sairaus (enkefalopatia), hermotulehdus (neuriitti), käsien ja jalkojen puutuminen tai heikkous (neuropatia), paralyysi, kouristuskohtaukset, kasvojen, suun tai kurkun turpoaminen (angioneuroottinen edeema), violetit tai punavioletit kuhmut iholla (lichen planus), vakavat ihottumat (erythema multiforme), nivelten turvotus, lihasheikkous, aivokalvontulehdus, mikä voi johtaa vakavaan päänsärkyyn, niskajäykkyyteen ja valoherkkyyteen (meningiitti), eräiden verisuonten tulehdus (vaskuliitti), maksan toimintakokeiden epänormaalit arvot, MS-tauti, selkäytimen turvotusta (myeliitti), riippuva silmäluomi ja toispuolinen kasvojen lihasvelttous (kasvohalvaus), tilapäinen hermotulehdus, johon liittyy raajojen kipua, heikkoutta ja paralyysiä. Oireet esiintyvät usein myös rinnassa ja kasvoissa (Guillain-Barrén oireyhtymä), silmähermosairaus (optikusneuriitti), injektiokohdan välitön kipu, pistely ja polttava tunne.
Vakavia allergisia reaktioita (anafylaksia, anafylaktoidiset reaktiot, seerumitaudin kaltainen tila) voi esiintyä hyvin harvoin (harvemmin kuin kerran 10 000 rokotuksen jälkeen).
Vakavan allergisen reaktion merkkejä voivat olla ihottumat, jotka voivat olla kutisevia tai rakkulaisia, silmien ja kasvojen turvotus, hengitys- tai nielemisvaikeudet, verenpaineen äkillinen lasku ja tajuttomuus. Reaktiot saattavat ilmetä ennen lääkärin vastaanotolta poistumista. Mikäli koet mitään edellä mainituista oireista ota kiireellisesti yhteys lääkäriin.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan kansallisen ilmoitusjärjestelmän kautta. Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2°C – 8°C:ssa).
Säilytettävä alkuperäispakkauksessa. Herkkä valolle.
Ei saa jäätyä. Jäätyminen tuhoaa rokotteen.
Lääkkeitä ei tule heittää viemäriin, eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Twinrix Paediatric sisältää
- Vaikuttavat aineet ovat:
Hepatiitti A -virus (inaktivoitu)1,2 360 ELISA-yksikköä
Hepatiitti B ‑ pinta-antigeeni 3,4 10 mikrogrammaa
1 Tuotettu ihmisen diploidi (MRC-5) soluissa
2 Adsorboitu alumiinihydroksidiin (hydratoituun) 0,025 milligrammaa Al3+
3 Tuotettu hiivasoluissa (Saccharomyces cerevisiae)
rekombinantti DNA teknologian avulla
4 Adsorboitu alumiinifosfaattiin 0,2 milligrammaa Al3+ - Twinrix Paediatricin muut aineosat ovat: natriumkloridi, injektionesteisiin käytettävä vesi.
Twinrix Paediatricin kuvaus ja pakkauskoko
Injektioneste, suspensio
Twinrix Paediatric on valkoinen, hieman maitomainen neste.
Twinrix Paediatric on saatavana yhden annoksen esitäytetyssä ruiskussa erillisillä neuloilla tai ilman, pakkauskoot 1, 10 ja 50.
Kaikki pakkauskoot eivät välttämättä ole markkinoilla.
Myyntiluvan haltija ja valmistaja:
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja.
Suomi/Finland
GlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Tämä seloste on tarkistettu viimeksi 04/2023
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilla http://www.ema.europa.eu/
Ohjeet terveydenhuollon ammattilaiselle
Varastoitaessa voi muodostua hienojakoinen valkoinen sedimentti ja kirkas, väritön pintakerros.
Rokote on saatettava käyttökuntoon ennen antoa. Käyttökuntoon saatettu rokote on ulkonäöltään tasainen, samea ja valkoinen.
Rokotteen käyttökuntoon saattaminen, jotta muodostuu tasainen, samea, valkoinen suspensio.
Rokote saatetaan käyttökuntoon vaiheittain noudattamalla seuraavia ohjeita.
1.Pidä ruisku pystyasennossa käsi suljettuna
2.Ravista ruiskua kääntämällä se useita kertoja ylösalaisin ja takaisin oikein päin
3.Toista tätä liikettä voimakkaasti vähintään 15 sekunnin ajan
4.Tarkista rokote uudestaan:
a) Rokote on valmis käytettäväksi, jos suspensio on tasainen, samea ja valkoinen – rokote ei ole kirkas.
b) Jos rokote edelleen ei ole tasainen, samea, valkoinen suspensio – käännä ylösalaisin ja takaisin oikein päin vielä vähintään 15 sekunnin ajan – tarkista uudelleen
Ennen rokottamista rokote tarkastetaan silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta. Jos jompaakumpaa havaitaan, rokotetta ei tule antaa.
Esitäytetyn ruiskun käyttöohje käyttökuntoon saattamisen jälkeen
|
|
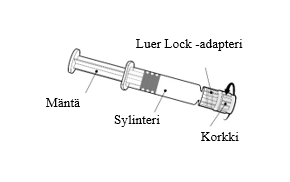
Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
|
|
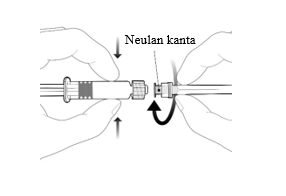
Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys
Käyttämätön lääkevalmiste ja jäte on hävitettävä paikallisten vaatimusten mukaisesti.