Pakkausseloste
PERGOQUIN tablett 1 mg
DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN
Pergoquin 1 mg tabletter för häst
DEKLARATION AV AKTIVA SUBSTANSER OCH ÖVRIGA SUBSTANSER
Varje tablett innehåller:
Aktiv substans:
Pergolid 1,0 mg
(motsvarande 1,31 mg pergolidmesilat)
Hjälpämnen:
Röd järnoxid (E172) 0,9 mg
Rosa rund och konvex tablett med en korsformad brytskåra på en sida. Tabletterna kan delas i 2 eller 4 lika stora delar.
ANVÄNDNINGSOMRÅDEN
För symptomatisk behandling av kliniska tecken på hypofysär pars intermediadysfunktion (PPID, pituitary pars intermedia dysfunction) (Cushings syndrom hos häst).
KONTRAINDIKATIONER
Använd inte vid överkänslighet mot den aktiva substansen eller andra ergotderivat eller mot något av hjälpämnena.
Använd inte till hästar under 2 år.
BIVERKNINGAR
Häst:
Sällsynta (1 till 10 av 10 000 behandlade djur):
Aptitlöshet, anorexi1, slöhet (letargi)1, påverkan på det centrala nervsystemet2 (t.ex. depression, bristande koordination (ataxi)), diarré, kolik.
Mycket sällsynta (färre än 1 av 10 000 behandlade djur, enstaka rapporterade händelser inkluderade): Svettningar
1 övergående biverkningar
2 lindriga biverkningar
Det är viktigt att rapportera biverkningar. Det möjliggör fortlöpande säkerhetsövervakning av ett läkemedel. Om du observerar biverkningar, även sådana som inte nämns i denna bipacksedel, eller om du tror att läkemedlet inte har fungerat, meddela i första hand din veterinär. Du kan också rapportera eventuella biverkningar till innehavaren av godkännande för försäljning eller den lokala företrädaren för innehavaren av godkännandet för försäljning genom att använda kontaktuppgifterna i slutet av denna bipacksedel, eller via ditt nationella rapporteringssystem: Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea webbplats: https://www.fimea.fi/web/sv/veterinar
DJURSLAG
Hästar (inte avsedda för humankonsumtion)
DOSERING FÖR VARJE DJURSLAG, ADMINISTRERINGSSÄTT OCH ADMINISTRERINGSVÄGAR
Ges via munnen, en gång dagligen.
Startdos
Startdosen är 2 mikrogram pergolid/kg (dosintervall: 1,7 till 2,5 mikrogram/kg kroppsvikt. Enligt studier från publicerad litteratur är den vanligaste, genomsnittliga dosen 2 mikgram pergolid/kg med ett intervall från 0,6 till 10 mikrogram pergolid/kg. Startdosen (2 mikrogram pergolid/kg, dvs. en tablett för 500 kg kroppsvikt) ska sedan titreras utifrån det individuella svaret som fastställts genom övervakning (se nedan).
Startdoser rekommenderas enligt följande tabell:
| Hästens kroppsvikt | Antal tabletter | Startdos | Dosintervall |
| 200-300 kg | ½ | 0,50 mg | 1,7-2,5 mikrogram/kg |
| 301-400 kg | ¾ | 0,75 mg | 1,9-2,5 mikrogram/kg |
| 401-600 kg | 1 | 1,00 mg | 1,7-2,5 mikrogram/kg |
| 601-850 kg | 1 ½ | 1,50 mg | 1,8-2,5 mikrogram/kg |
| 851-1000 kg | 2 | 2,00 mg | 2,0-2,4 mikrogram/kg |
Underhållsdos
Livslång behandling är att förvänta för denna sjukdom.
De flesta hästar svarar på behandling och stabiliseras vid en genomsnittlig dos på 2 mikrogram pergolid/kg kroppsvikt. Klinisk förbättring med pergolid förväntas inom 6 till 12 veckor. Hästar kan svara kliniskt vid lägre eller varierande doser och därför bör man titrera till lägsta effektiva dos per individ utifrån behandlingssvaret, oavsett om detta är effekt eller tecken på intolerans. Vissa hästar kan behöva doser upp till 10 mikrogram pergolid/kg kroppsvikt per dag. I dessa ovanliga situationer rekommenderas ytterligare övervakning.
Efter den initiala diagnosen, upprepa endokrinologiska tester för dostitrering och övervakning av behandlingen med 4 till 6 veckors intervall, fram till att de kliniska tecknen och/eller resultaten av de diagnostiska testen stabiliseras eller förbättras.
Om kliniska tecken eller diagnostiska tester ännu inte förbättrats efter det första intervallet på 4 till 6 veckor, kan den totala dagliga dosen ökas med 0,25-0,50 mg. Om de kliniska tecknen förbättrats men ännu inte är normaliserade, kan veterinären besluta att titrera eller inte titrera dosen med hänsyn till individens svar på/tolerans för dosen.
Om de kliniska tecknen inte är tillräckligt kontrollerade (klinisk utvärdering och/eller diagnostiska tester) rekommenderas en höjning av den totala dygnsdosen i steg om 0,25-0,5 mg (om läkemedlet tolereras vid den dosen) med 4 till 6 veckors mellanrum tills stabilisering uppnås. Vid tecken på dosintolerans ska behandlingen sättas ut i 2 till 3 dagar och återinsättas med halva den tidigare dosen. Den totala dygnsdosen kan sedan titreras tillbaka upp till önskad klinisk effekt i steg om 0,25-0,5 mg varannan till var fjärde vecka. Om en dos glöms bort ska nästa planerade dos ges enligt ordination.
Efter stabilisering ska regelbunden klinisk bedömning och diagnostiska tester genomföras var 6:e månad för att övervaka behandling och dos. Om inte någon uppenbar behandlingsrespons kan ses ska diagnosen utvärderas på nytt.
Tabletterna kan delas i 2 eller 4 lika stora delar för korrekt dosering. Placera tabletten på en plan yta med brytskåran vänd upp och den konvexa (runda) sidan vänd mot ytan.
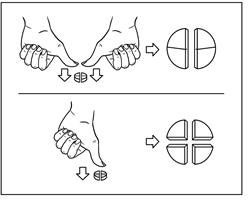
2 lika delar: tryck ner med tummen på båda sidor av tabletten. 4 lika delar: tryck ner med tummen i mitten av tabletten.
ANVISNING FÖR KORREKT ADMINISTRERING
För att underlätta administrering ska den erforderliga dagliga dosen lösas upp i en liten mängd vatten och omröras till den är upplöst, och/eller blandas med melass eller annat välsmakande foder. Tabletter som löses upp i vatten administreras med en spruta. Administrera hela mängden direkt. Tabletterna ska inte krossas.
KARENSTIDER
Ej godkänt för användning till hästar avsedda för humankonsumtion. Behandlade hästar får inte slaktas för humankonsumtion.
Det måste intygas att hästen inte är avsedd för humankonsumtion i enlighet med nationell lagstiftning om hästpass.
Ej godkänt för användning till djur som producerar mjölk avsedd för humankonsumtion.
SÄRSKILDA FÖRVARINGSANVISNINGAR
Förvaras utom syn- och räckhåll för barn. Inga särskilda förvaringsanvisningar.
Använd inte detta läkemedel efter utgångsdatumet på blister och kartong efter Exp. Utgångsdatumet är den sista dagen i angiven månad.
Hållbarhet av delade tabletter efter öppnande av innerförpackning: 3 dagar.
SÄRSKILDA VARNINGAR
Särskilda varningar:
Lämpliga endokrinologiska laboratorietester ska utföras, liksom utvärdering av kliniska tecken för att fastställa diagnosen PPID.
Särskilda försiktighetsåtgärder för säker användning hos det avsedda djurslaget:
Eftersom majoriteten av PPID-fallen diagnostiseras hos äldre hästar förekommer det ofta andra patologiska processer. För övervakning och testintervall se avsnitt ”Dosering för varje djurslag, administreringssätt och administreringsväg”.
Särskilda försiktighetsåtgärder för personer som ger läkemedlet till djur:
Läkemedlet kan vid delning orsaka ögonirritation, en irriterande lukt eller huvudvärk. Undvik kontakt med ögonen och inhalation vid hantering av tabletterna. Minimera risken för exponering när tabletterna delas. Tabletterna ska inte krossas.
Vid hudkontakt, skölj den exponerade huden med vatten. Vid ögonkontakt, skölj omedelbart det utsatta ögat med vatten och kontakta läkare. Vid nasal irritation, gå ut i friska luften och kontakta läkare om andningssvårigheter uppstår.
Detta läkemedel kan orsaka överkänslighetsreaktioner (allergiska reaktioner). Personer som är överkänsliga för pergolid eller andra ergotderivat ska undvika kontakt med läkemedlet.
Detta läkemedel kan orsaka biverkningar orsakade av minskade prolaktinnivåer, vilket utgör en särskild risk för gravida kvinnor och kvinnor som ammar. Gravida kvinnor och kvinnor som ammar ska undvika kontakt med huden eller kontakt mellan hand till mun genom att använda handskar när de administrerar läkemedlet.
Oavsiktligt intag, särskilt hos barn, kan orsaka biverkningar. För att undvika oavsiktligt intag ska läkemedlet förvaras utom syn- och räckhåll för barn. Tablettdelarna ska läggas tillbaka i det öppnade blistret. Blister ska läggas tillbaka i ytterförpackningen och förvaras på en säker plats. Vid oavsiktligt intag, uppsök genast läkare och visa bipacksedeln eller etiketten.
Du ska inte äta, dricka eller röka när du använder det här läkemedlet. Tvätta händerna efter användning.
Dräktighet:
Ska endast användas i enlighet med ansvarig veterinärs nytta/riskbedömning. Läkemedlets säkerhet har inte fastställts hos dräktiga ston. Laboratoriestudier på mus och kanin har inte givit belägg för teratogena effekter. Nedsatt fertilitet observerades på möss vid en dos på 5,6 mg/kg och dag.
Digivning:
Användning rekommenderas inte till digivande hästar, eftersom läkemedlets säkerhet inte fastställts hos dessa. Det är observerat brister i mjölkproduktion hos mus. Detta är orsakat av den farmakologiska hämningen av prolaktinsekretionen, vilket medförde lägre kroppsvikt och överlevnad hos avkomma.
Interaktioner med andra läkemedel och övriga interaktioner:
Använd läkemedlet med försiktighet vid samtidig administrering med andra läkemedel som man vet påverkar proteinbindningen.
Administrera inte läkemedlet samtidigt med dopaminantagonister, såsom neuroleptika (fentiaziner, t.ex. acepromazin), domperidon eller metoklopramid, eftersom dessa medel kan reducera effekten av pergolid.
Överdosering:
Ingen information finns tillgänglig.
SÄRSKILDA FÖRSIKTIGHETSÅTGÄRDER FÖR DESTRUKTION AV EJ ANVÄNT LÄKEMEDEL ELLER AVFALL, I FÖREKOMMANDE FALL
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall.
Använd retursystem för kassering av ej använt läkemedel eller avfall från läkemedelsanvändningen i enlighet med lokala bestämmelser. Dessa åtgärder är till för att skydda miljön.
Fråga veterinär hur man gör med läkemedel som inte längre används.
DATUM DÅ BIPACKSEDELN SENAST GODKÄNDES
29.09.2023
Utförlig information om detta läkemedel finns i unionens produktdatabas ( https://medicines.health.europa.eu/veterinary ).
För ytterligare upplysningar om detta läkemedel, kontakta den lokala företrädaren för innehavaren av godkännandet för försäljning.
NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND SOM ANSVARAR FÖR FRISLÄPPANDE AV TILLVERKNINGSSATS, OM OLIKA
Innehavare av godkännande för försäljning:
VetViva Richter GmbH Durisolstrasse 14
4600 Wels
Österrike
Tillverkare ansvarig för frisläppande av tillverkningssats:
Lelypharma BV Zuiveringsweg 42
8243 PZ Lelystad Nederländerna
Lokal företrädare och kontaktuppgifter för att rapportera misstänkta biverkningar:
FaunaPharma Oy c/o Oriola Oy PL8
02101 Espoo
p. +358505027788