Pakkausseloste
CINRYZE pulver och vätska till injektionsvätska, lösning 500 IU
Tilläggsinformation
Cinryze 500 IE pulver och vätska till injektionsvätska, lösning
human C1-esterashämmare
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Cinryze är och vad det används för
2. Vad du behöver veta innan du använder Cinryze
3. Hur du använder Cinryze
4. Eventuella biverkningar
5. Hur Cinryze ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Cinryze innehåller det humana proteinet som kallas ”C1-esterashämmare” som den aktiva substansen.
C1-esterashämmare är ett naturligt förekommande protein som normalt finns i blodet. Om du har en låg mängd C1-esterashämmare i blodet eller om C1-esterashämmaren inte fungerar normalt, kan detta leda till svullnadsattacker (kallas angioödem). Symtomen kan innefatta magsmärtor och svullnad av:
- händer och fötter
- ansikte, ögonlock, läppar eller tunga
- struphuvudet (larynx), vilket kan göra det svårt att andas
- könsorganen.
Hos vuxna och barn kan Cinryze öka mängden C1-esterashämmare i blodet och antingen förhindra (inför medicinska ingrepp eller tandvårdsingrepp) att svullnadsattackerna uppstår eller stoppa svullnadsattackerna när de har inletts.
Hos vuxna, ungdomar och barn (6 år och äldre) kan Cinryze öka mängden C1-esterashämmare i blodet och regelbundet förhindra att svullnadsattackerna uppstår.
Vad du behöver veta innan produkten används
Använd inte Cinryze
- om du är allergisk mot human C1-esterashämmare eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar). Det är viktigt att du talar om för läkaren om du tror att du någon gång har fått en allergisk reaktion mot något innehållsämne i Cinryze.
Varningar och försiktighet
- Innan du börjar behandlas med Cinryze är det viktigt att du talar om för läkaren om du har, eller har haft, problem med blodkoagulationen (tromboser). I så fall kommer du att kontrolleras noga.
- Om du börjar få utslag, åtstramning i bröstet, väsande andning eller snabba hjärtslag när du har tagit Cinryze bör du omedelbart tala om det för din läkare. Se avsnitt Eventuella biverkningar.
- När läkemedel är tillverkade av humant blod eller plasma vidtas särskilda åtgärder för att förhindra att infektioner överförs till patienter. I åtgärderna ingår att noga välja ut blod- och plasmagivare för att säkerställa att givare som kan bära på infektioner utesluts, och att alla donationer och plasmapooler analyseras avseende tecken på virus/infektioner. Tillverkarna av dessa produkter lägger dessutom in steg i bearbetningen av blodet eller plasman som kan inaktivera eller avlägsna virus. Trots dessa åtgärder kan risken för att överföra en infektion inte uteslutas helt när läkemedelsprodukter som tillverkats av humant blod eller plasma administreras. Detta gäller även eventuella okända eller nyutvecklade virus eller andra typer av infektioner.
- Åtgärderna som vidtas anses vara effektiva när det gäller höljeförsedda virus som t.ex. humant immunbristvirus (HIV), hepatit B- och hepatit C-virus, och icke höljeförsedda hepatit A-virus och parvovirus B19.
- Läkaren kan rekommendera dig att ta vaccinationer mot hepatit A och B om du regelbundet eller upprepade gånger får C1-esterashämmarprodukter som tillverkats av human plasma.
- För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras av sjuksköterskan eller läkaren.
Barn
Cinryze ska inte användas till barn under 6 år för rutinmässig prevention av angioödemattacker.
Andra läkemedel och Cinryze
Tala om för läkare om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel. Det finns endast begränsad information om säkerheten för Cinryze-användning under graviditet och amning. Läkaren kommer att tillsammans med dig diskutera riskerna och nyttan med att ta det här läkemedlet.
Körförmåga och användning av maskiner
Cinryze har mindre påverkan på förmågan att framföra fordon och använda maskiner.
Cinryze innehåller natrium
Detta läkemedel innehåller 11,5 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 0,5 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Hur produkten används
Behandlingen kommer att inledas och övervakas av en läkare med erfarenhet av behandling av patienter med hereditärt angioödem (HAE).
En läkare eller sjuksköterska kan förbereda och injicera Cinryze åt dig. Om läkaren bedömer att du kan injicera läkemedlet själv kommer en läkare eller sjuksköterska att instruera dig eller en familjemedlem i hur du eller ni förbereder och injicerar Cinryze. Läkaren kommer regelbundet att stämma av med dig eller en anhörig/anhörig vårdare hur det går med förberedelser och administrering.
Rekommenderad dos av Cinryze för vuxna, ungdomar, barn, äldre eller patienter som lider av njur- eller leverproblem är följande:
Användning för vuxna och ungdomar (12 år och äldre)
Behandling av svullnadsattacker
- En dos på 1 000 IE (två injektionsflaskor) Cinryze bör injiceras vid det första tecknet på en svullnadsattack.
- Ytterligare en injektion på 1 000 IE kan ges om symtomen inte avtar efter 60 minuter.
- Om du får en svår attack, särskilt om struphuvudet (larynx) svullnar, eller om insättningen av läkemedlet är fördröjd, kan den andra dosen om 1 000 IE ges tidigare än 60 minuter efter den första dosen, beroende på hur du reagerar.
- Cinryze ska injiceras intravenöst (i en ven).
Rutinmässig prevention av svullnadsattacker
- En dos på 1 000 IE (två injektionsflaskor) Cinryze injiceras med 3 eller 4 dagars mellanrum för rutinmässig prevention av svullnadsattacker.
- Doseringsintervallet kan justeras av din läkare beroende på hur du svarar på Cinryze.
- Cinryze ska injiceras intravenöst (i en ven).
Prevention av svullnadsattacker före operation
- En dos på 1 000 IE (två injektionsflaskor) Cinryze injiceras upp till 24 timmar före ett medicinskt, dentalt eller kirurgiskt ingrepp.
- Cinryze ska injiceras intravenöst (i en ven).
Användning för barn
| Behandling av angioödemattacker | Prevention av angioödemattacker före ingrepp | Rutinmässig prevention av angioödemattacker |
2 till 11 år, >25 kg: En dos på 1 000 IE (två injektionsflaskor) Cinryze ska injiceras vid det första tecknet på en svullnadsattack. Ytterligare en injektion på 1 000 IE kan ges om dina symtom inte förbättras efter 60 minuter. 2 till 11 år, 10–25 kg: En dos på 500 IE (en injektionsflaska) Cinryze ska injiceras vid det första tecknet på en svullnadsattack. Ytterligare en injektion på 500 IE kan ges om dina symtom inte har förbättrats efter 60 minuter. | 2 till 11 år, >25 kg: En dos på 1 000 IE (två injektionsflaskor) Cinryze ska injiceras upp till 24 timmar före ett medicinskt, tand- eller kirurgiskt ingrepp. 2 till 11 år, 10–25 kg: En dos på 500 IE (en injektionsflaska) Cinryze ska injiceras upp till 24 timmar före ett medicinskt, tand- eller kirurgiskt ingrepp. | 6 till 11 år: En dos på 500 IE (en injektionsflaska) Cinryze ska injiceras med 3 eller 4 dagars mellanrum för rutinmässig prevention av svullnadsattacker. Läkaren kan behöva anpassa doseringsintervallet beroende på hur du svarar på behandlingen med Cinryze. |
Beredning och administreringssätt
Cinryze injiceras vanligen i en ven (intravenöst) av din läkare eller sjuksköterska. Du eller din anhörigvårdare kan också ge Cinryze som en injektion, men bara efter att ha fått tillräcklig träning. Om du injicerar Cinryze själv, gör alltid som din läkare har visat dig. Rådfråga läkare om du är osäker. Om läkaren anser att du kan vara lämplig för sådan behandling i hemmet, får du noggranna anvisningar av honom/henne. Du måste föra en dagbok för att dokumentera varje behandling du tar/får hemma och ta med dagboken till alla dina besök hos läkaren. Man kommer att kontrollera din/din anhörigvårdares injektionsteknik regelbundet för att kunna säkra en fortsatt lämplig hantering.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Detta kan innefatta reaktioner av allergisk typ.
Tala omedelbart om för läkaren om du får något av följande symtom efter att ha tagit detta läkemedel. Även om symtomen är sällsynta kan de vara allvarliga.
Plötslig väsande andning, svårt att andas, svullnad i ögonlock, ansikte eller läppar, utslag eller klåda (särskilt om utslagen eller klådan påverkar hela kroppen).
Mycket vanliga biverkningar (kan förekomma hos fler än 1 av 10 användare): huvudvärk, illamående.
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 användare): överkänslighet, yrsel, kräkning, utslag, klåda eller rodnad, utslag eller smärta vid injektionsstället, feber.
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 användare): högt blodsocker, blodpropp, smärta i venerna, värmevallning, hosta, magsmärta, diarré, flagnande hud, ledsvullnad och ledvärk, muskelsmärta samt obehagskänsla i bröstet.
Biverkningar hos barn och ungdomar väntas vara liknande de hos vuxna.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och injektionsflaskorna efter Utg.dat.
Förvaras vid högst 25 °C. Får ej frysas. Förvaras i originalförpackningen. Ljuskänsligt.
När Cinryze-lösningen är beredd ska den användas omedelbart.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är human C1-esterashämmare som är framställd av plasma från humana givare. Varje injektionsflaska med pulver innehåller 500 IE human C1-esterashämmare. Efter beredning innehåller en injektionsflaska 500 IE human C1-esterashämmare per 5 ml, motsvarande en koncentration på 100 IE/ml. Två injektionsflaskor med beredd Cinryze innehåller 1 000 IE human C1-esterashämmare per 10 ml, motsvarande en koncentration på 100 IE/ml.
Det totala proteininnehållet i den beredda lösningen är 15 ± 5 mg/ml.
En internationell enhet (IE) motsvarar mängden C1-esterashämmare som finns i 1 ml normal human plasma.
Övriga innehållsämnen är natriumklorid, sackaros, natriumcitrat, L-valin, L-alanin, L-treonin (se avsnitt Vad du behöver veta innan produkten används).
Vätska: vatten för injektioner.
Läkemedlets utseende och förpackningsstorlekar
Pulver och vätska till injektionsvätska, lösning.
Cinryze är ett vitt pulver inneslutet i en injektionsflaska.
När pulvret är upplöst i vattnet för injektioner är lösningen klar och färglös till blåaktig.
Varje förpackning innehåller:
2 injektionsflaskor med Cinryze 500 IE pulver till injektionsvätska, lösning
2 injektionsflaskor med vatten för injektioner (5 ml i varje)
2 överföringsenheter med filter
2 engångssprutor om 10 ml
2 set för venpunktion
2 skyddsunderlägg
Använd endast en silikonfri spruta (medföljer förpackningen) för att administrera produkten.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wien
Österrike
Tillverkare
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wien
Österrike
Shire International Licensing B.V.
Mercuriusplein 11
2132 HA Hoofddorp
Nederländerna
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Takeda Oy
Tel: 0800 774 051
medinfoEMEA@takeda.com
Denna bipacksedel ändrades senast 05/2025.
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu. Där finns också länkar till andra webbplatser rörande sällsynta sjukdomar och behandlingar.
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Beredning och administrering av Cinryze
Beredning, produktadministrering och hantering av administreringsset och kanyler måste utföras med försiktighet.
Använd antingen överföringsenheten med filter som medföljer Cinryze eller en i handeln tillgänglig kanyl med dubbla ändar.
Använd endast en silikonfri spruta (medföljer förpackningen) för att administrera produkten.
Förberedelse och hantering
Cinryze är avsett för intravenös administrering (i en ven) efter beredning med vatten för injektioner.
Cinryze-injektionsflaskan är endast för engångsbruk.
Beredning
För en dos på 500 IE: 1 injektionsflaska med pulver, 1 injektionsflaska med vätska, 1 överföringsenhet med filter, 1 engångsspruta om 10 ml, 1 set för venpunktion och 1 skyddsunderlägg behövs. Förvara den återstående injektionsflaskan och administreringsutrustningen till nästa dos.
För en dos på 1 000 IE: 2 injektionsflaskor med pulver, 2 injektionsflaskor med vätska, 2 överföringsenheter med filter, 1 engångsspruta om 10 ml, 1 set för venpunktion och 1 skyddsunderlägg behövs.
Varje injektionsflaska med läkemedel ska beredas med 5 ml vatten för injektioner.
En injektionsflaska med beredd Cinryze motsvarar en dos på 500 IE. Bered därför endast en injektionsflaska med Cinryze för en dos på 500 IE.
Två injektionsflaskor med berett Cinryze motsvarar en dos på 1 000 IE. Därför kombineras två injektionsflaskor för en dos på 1 000 IE.
| 1. Arbeta på underlägget som medföljer och tvätta händerna innan du utför följande procedurer. | |
| 2. Aseptisk teknik ska användas under beredningsproceduren. | |
| 3. Försäkra dig om att injektionsflaskan med pulver och injektionsflaskan med vätska har rumstemperatur (15 °C–25 °C). | |
| 4. Avlägsna etiketten på injektionsflaskan med pulver genom att dra ned den lila remsan märkt med en pil. | |
| 5. Ta av plastlocken från injektionsflaskorna med pulver respektive vätska. | |
| 6. Rengör propparna med en desinfektionskompress och låt dem torka före användning. | |
| 7. Ta av skyddet från ovansidan på förpackningen med överföringsenheten. Ta inte ut enheten ur förpackningen. | 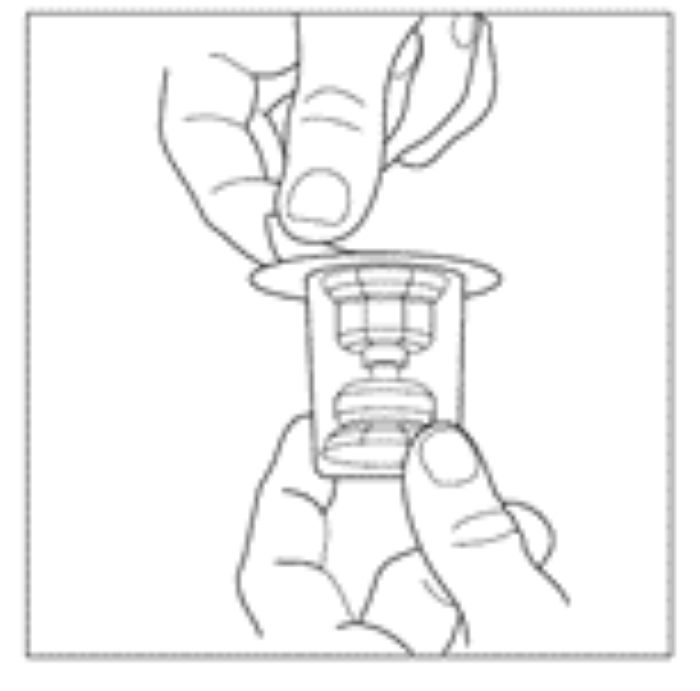 |
| 8. Obs! Överföringsenheten måste vara ansluten till injektionsflaskan med vätska innan den ansluts till injektionsflaskan med pulver, så att vakuumet i flaskan med pulver inte försvinner. Placera injektionsflaskan med vätska på en plan yta och stick in den blå änden på överföringsenheten i injektionsflaskan med vätska. Tryck nedåt tills kanylen penetrerar mitten på proppen på flaskan med vätska och enheten klickar på plats. Överföringsenheten måste vara vertikal innan kanylen penetrerar proppförslutningen. | 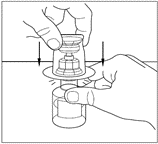 |
| 9. Ta av plastförpackningen från överföringsenheten och kasta förpackningen. Var noga med att inte vidröra den exponerade änden på överföringsenheten. | 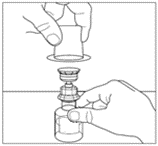 |
| 10. Placera injektionsflaskan med pulver på en plan yta. Vänd överföringsenheten och flaskan med vätska (vatten för injektioner) upp och ner och stick in den genomskinliga änden på överföringsenheten i flaskan med pulver. Tryck ned tills kanylen penetrerar gummiproppen och överföringsenheten klickar på plats. Överföringsenheten måste vara vertikal innan kanylen penetrerar proppförslutningen på pulverflaskan. Vakuumet i pulverflaskan suger in vätskan. Om det inte finns något vakuum i injektionsflaskan ska produkten inte användas. | 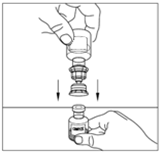 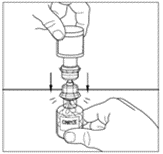 |
| 11. Snurra försiktigt runt injektionsflaskan med pulver tills allt pulver är upplöst. Skaka inte injektionsflaskan med pulver. Kontrollera att allt pulver är helt upplöst. | 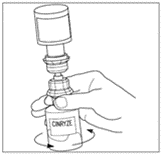 |
| 12. Lossa injektionsflaskan med vätska genom att vrida den moturs. Ta inte bort den genomskinliga änden på överföringsenheten från injektionsflaskan med pulver. | 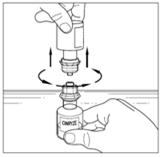 |
En injektionsflaska med berett Cinryze innehåller 500 IE human C1-esterashämmare i 5 ml, vilket ger en koncentration på 100 IE/ml. Fortsätt med administreringsprocessen om patienten får en dos på 500 IE.
Två injektionsflaskor med Cinryze-pulver måste beredas för att det ska bli en dos (1 000 IE/10 ml). Upprepa därför anvisningarna 1 till 12 ovan med ytterligare en förpackning innehållande en överföringsenhet för att bereda den andra av två injektionsflaskor med pulver. Överföringsenheten får inte återanvändas. Fortsätt med administreringsprocessen för en dos på 1 000 IE när de två injektionsflaskorna är beredda.
Administreringsprocess för en dos på 500 IE
| 1. Aseptisk teknik ska användas under administreringsproceduren. | |
| 2. Efter beredning är Cinryze-lösningarna färglösa till blåaktiga och genomskinliga. Använd inte produkten om lösningarna är grumliga eller missfärgade. | |
| 3. Använd en steril engångsspruta om 10 ml och dra upp kolven för att låta cirka 5 ml luft komma in i sprutan. | 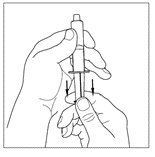 |
| 4. Anslut sprutan till toppen på överföringsenhetens genomskinliga ände genom att vrida den medurs. | 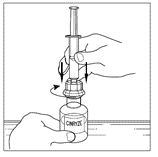 |
| 5. Vänd försiktigt injektionsflaskan upp och ner och injicera luft i lösningen. Dra sedan långsamt upp den beredda Cinryze-lösningen i sprutan. | 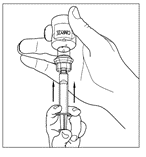 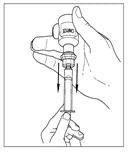 |
| 6. Lossa sprutan från injektionsflaskan genom att vrida den moturs och frigöra den från den genomskinliga änden på överföringsenheten. | 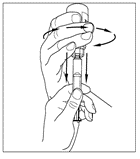 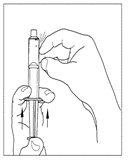 |
| 7. Inspektera den beredda Cinryze-lösningen avseende partiklar innan den administreras. Använd inte lösningen om några partiklar observeras. | |
| 8. Anslut setet för venpunktion till sprutan med Cinryze-lösning och injicera intravenöst (i en ven) i patienten. Administrera 500 IE (beredda i 5 ml vatten för injektioner) Cinryze med intravenös injektion (i en ven) vid en hastighet på 1 ml per minut under 5 minuter. | |
Administreringsprocess för en dos på 1 000 IE
| 1. Aseptisk teknik ska användas under administreringsproceduren. | |
| 2. Efter beredning är Cinryze-lösningarna färglösa till blåaktiga och genomskinliga. Använd inte produkten om lösningarna är grumliga eller missfärgade. | |
| 3. Använd en steril engångsspruta om 10 ml och dra upp kolven för att låta cirka 5 ml luft komma in i sprutan. | 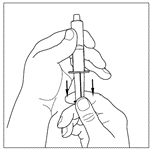 |
| 4. Anslut sprutan till toppen på överföringsenhetens genomskinliga ände genom att vrida den medurs. | 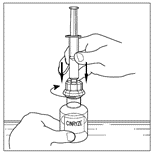 |
| 5. Vänd försiktigt injektionsflaskan upp och ner och injicera luft i lösningen. Dra sedan långsamt upp den beredda Cinryze-lösningen i sprutan. | 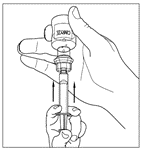 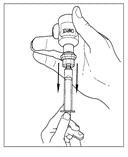 |
| 6. Lossa sprutan från injektionsflaskan genom att vrida den moturs och frigöra den från den genomskinliga änden på överföringsenheten. | 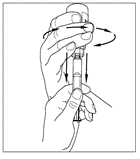 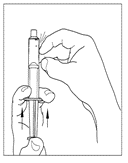 |
| 7. Använd samma spruta och upprepa steg 3 till 6 med den andra injektionsflaskan med berett Cinryze för att framställa en komplett dos om 10 ml. | |
| 8. Inspektera den beredda Cinryze-lösningen avseende partiklar innan den administreras. Använd inte lösningen om några partiklar observeras. | |
| 9. Anslut setet för venpunktion till sprutan med Cinryze-lösning och injicera intravenöst (i en ven) i patienten. Administrera 1 000 IE (beredda i 10 ml vatten för injektioner) Cinryze med intravenös injektion (i en ven) vid en hastighet på 1 ml per minut under 10 minuter. | |
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.