Pakkausseloste
FLIXOTIDE DISKUS inhalationspulver, avdelad dos 100 mikrog/dos, 250 mikrog/dos, 500 mikrog/dos
Tilläggsinformation
Flixotide Diskus 100 mikrog/dos
Flixotide Diskus 250 mikrog/dos
Flixotide Diskus 500 mikrog/dos
inhalationspulver, avdelad dos
flutikasonpropionat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har enbart ordinerats åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Flixotide Diskus är och vad det används för
2. Vad du behöver veta innan du använder Flixotide Diskus
3. Hur du använder Flixotide Diskus
4. Eventuella biverkningar
5. Hur Flixotide Diskus ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Flixotide Diskus är ett kortisonpreparat som motverkar inflammation och allergi i lungorna. Genom att minska inflammationen försöker man förebygga akuta astmaanfall.
Flixotide Diskus används regelbundet för att förebygga astmasymtom och behandla försämringen. Full effekt uppnås först efter några dagars behandling. Preparatet ger inte någon snabb lindring vid akuta astmabesvär.
Vad du behöver veta innan produkten används
Använd inte Flixotide Diskus
- om du är allergisk mot flutikasonpropionat, laktosmonohydrat eller mjölkprotein, som ingår i laktosmonohydrat (se avsnitt Vad du behöver veta innan produkten används ”Flixotide Diskus innehåller laktos”). .
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder Flixotide Diskus:
- om du har luftvägsinfektioner, så som lungtuberkulos, svamp- eller virusinfektioner. Tala om det då för läkaren. Läkaren kan sätta in kompletterande behandling.
- om du tidigare behandlats med kortisontabletter. Följ i så fall noggrant läkarens doseringsanvisningar för övergång till Flixotide Diskus. I samband med denna övergång kan dina tidigare allergiska besvär, t.ex. snuva och eksem, komma tillbaka. I början av behandlingen kan du även känna trötthet, få huvudvärk, muskel- och ledvärk, samt i enstaka fall bli illamående eller kräkas. Detta beror på att den totala mängden kortison i kroppen förminskas då sjukdomen behandlas lokalt.
- om den pipande andningen ökar genast efter intagandet av läkemedlet (s.k. paradoxal bronkospasm). Då behöver du genast ett luftrörsvidgande astmaläkemedel. Sluta användningen av Flixotide Diskus och kontakta läkare.
- om du har diabetes.
Om astmabesvären tilltar, ändra inte på doseringen utan att kontakta läkare.
Vid fall av akut försämring eller någon tillfällig stressituation kan en läkare ordinera dig kortison i tablettform som kompletterande behandling.
Kontakta läkare om du använder snabbverkande läkemedel avsedda för astmaattacker mer än vanligt eller om dessa inte verkar lika bra som vanligt.
Kontakta läkare om du upplever dimsyn eller andra synproblem som kan orsakas av grå starr eller glaukom.
Andra läkemedel och Flixotide Diskus
Tala om för läkare eller apotekspersonal om du använder eller nyligen har använt eller kan tänkas använda andra läkemedel. Detta gäller även naturläkemedel och receptfria läkemedel.
Tala om för läkaren eller apotekspersonalen om du tar någon av följande läkemedel:
- en typ av antiviralt läkemedel som kallas proteashämmare (såsom ritonavir) eller preparat som innehåller kobicistat, vilket kan öka effekten av flutikasonpropionat. Din läkare kan vilja kontrollera dig noggrannare om du tar någon av dessa produkter.
- läkemedel mot svampinfektioner (såsom ketokonazol).
Flixotide Diskus kan också ha interaktioner med vissa andra läkemedel.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Begränsad erfarenhet av användning under graviditet. Tala därför om användandet av Flixotide Diskus med en läkare, om du är gravid eller planerar en graviditet inom en snar framtid.
Man känner inte till om det aktiva innehållsämnet i detta preparat passerar över i modersmjölk. Rådfråga därför en läkare innan du ammar ditt barn i samband med behandling med Flixotide Diskus.
Körförmåga och användning av maskiner
Det anses inte troligt att Flixotide Diskus skulle inverka på din prestationsförmåga i trafiken eller på din förmåga att använda maskiner. Inga särskilda studier har dock utförts för att utreda preparatets eventuella effekter på körförmågan eller förmågan att använda maskiner.
Flixotide Diskus innehåller laktos
Använd inte detta läkemedel om du är allergisk mot laktosmonohydrat eller mot mjölkprotein som ingår i laktosmonohydrat. Däremot förorsakar den laktosmängd som ingår i Flixotide Diskus (högst 12,5 mg/dos) vanligen inte problem för personer som lider av vanlig laktosintolerans.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens anvisningar. Överskrid inte den rekommenderade dosen. Rådfråga läkare eller apotekspersonal om du är osäker.
Rekommenderad dosering för vuxna och ungdomar över 16 år är 100 – 1000 mikrogram två gånger om dagen.
För barn och ungdomar 4 – 16 år är 50 – 200 mikrogram två gånger om dagen.
Flixotide Diskus rekommenderas inte för barn under 4 år.
Skölj munnen med vatten genast efter varje inhalationstillfälle.
Detta läkemedel är avsett att användas endast som inhalation. Observera att det aktiva innehållsämnet i Flixotide Diskus, flutikasonpropionat, är ett ämne som används i förebyggande syfte. Läkemedlet skall därför användas regelbundet, också då du tycker dig vara symtomfri.
En korrekt inhalationsteknik är därför viktig för att bästa möjliga effekt skall kunna uppnås. Bruksanvisning för Flixotide Diskus inhalatorn finns i slutet av detta avsnitt.
Om du upplever att effekten av Flixotide Diskus är för stark eller för svag, kontakta läkare eller apoteket.
Om du har använt för stor mängd av Flixotide Diskus
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag, kontakta läkare, sjukhus eller Giftinformationscentralen (tfn. 0800 147 111) för bedömning av risken samt rådgivning.
Om du har glömt att använda Flixotide Diskus
Om du har glömt att ta en läkemedelsdos, fortsätt på sedvanligt sätt vid nästa doseringstillfälle.
Ta inte dubbel dos för att kompensera för glömd dos.
Om du slutar att använda Flixotide Diskus
En behandling med Flixotide Diskus skall inte avbrytas abrupt, eftersom symtomen då kan förvärras. Diskutera med en läkare, om du av någon orsak skulle önska avsluta behandlingen.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Bruksanvisning för Diskus inhalatorn
Läs noggrant igenom denna bruksanvisning, innan du börjar använda Diskus inhalatorn. Följ alltid givna råd och anvisningar.
Diskus är stängd när du tar den från förpackningen. Diskus är förseglad i en folieförpackning. Folieförpackningen skyddar mot fuktighet och får inte öppnas förrän du ska använda läkemedlet. Släng folien efter att förpackningen öppnats.
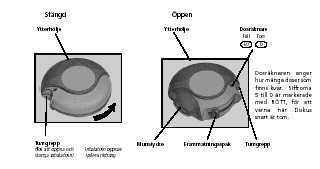
Dosräknaren anger hur många doser som finns kvar. Siffrorna 5 till 0 är markerade med RÖTT, för att varna när Diskus inhalatorn snart är tom.
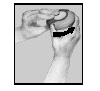
1. Öppna Diskus
Fatta tag om Diskus som på bilden och för tumgreppet i pilens riktning så långt det går.
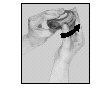
2. Förbereda Diskus
Håll Diskus med munstycket vänt mot dig. För frammatningsspaken bort från dig, så långt det går - tills ett klick hörs. Diskus är nu klar att användas.
3. Inhalera (andas in)
Läs noga igenom detta avsnitt innan du börjar andas in dosen.
- Håll Diskus bort från munnen och andas ut så mycket som känns bekvämt. Andas inte ut i Diskus.
- Placera Diskus på dina läppar och slut läpparna om munstycket. Andas in jämnt och djupt genom Diskus, inte genom näsan.
- Ta bort Diskus från munnen.
- Håll andan i ungefär 10 sekunder eller så länge som möjligt.
- Andas långsamt ut.
Det kan hända att du varken känner smak av eller känner att du har fått i dig läkemedlet, även om du använder inhalatorn på rätt sätt.

4. Stäng Diskus
Du stänger Diskus genom att föra tumgreppet mot dig så långt det går. Ett klick hörs när Diskus stängs. Frammatningsspaken har nu automatiskt återgått till sitt ursprungsläge. Diskus är klar att användas på nytt.

5. Skölj
Skölj munnen med vatten efter inandning.
Om du tar två inandningar, stäng Diskus och upprepa steg 1-4.
Kom ihåg
Förvara Diskus torrt.
Förvara Diskus stängd då du inte använder den.
Andas aldrig ut genom Diskus.
Rör endast frammatningsspaken, när du är redo att inhalera en dos (andas in).
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Eftersom Flixotide Diskus inhaleras direkt i lungorna i små mängder är risken för biverkningar liten.
Om du får följande mycket sällsynta symtom, sök läkarhjälp omedelbart: svullnad i ansiktet och svalget, andnöd och/eller sammandragningar i luftrören, livsfarlig allergisk reaktion (anafylaktisk chock).
Mycket vanliga biverkningar (hos mer än 1 av tio patienter):
- svampinfektion i munhålan och svalget (kandidos).
Vanliga biverkningar (hos mer än 1 av hundra patienter):
- heshet
- benägenhet för blåmärken.
Mindre vanliga biverkningar (hos färre än 1 av hundra patienter):
- överkänslighetsreaktioner i huden.
Sällsynta biverkningar (hos färre än 1 av tusen patienter):
- candidainfektion i matstrupen.
Mycket sällsynta biverkningar (hos färre än 1 av tiotusen patienter):
- Cushings syndrom och relaterade symtom (t.ex. svullnad i kroppen och ansikte (”månansikte”), muskelatrofi, benförlust, högt blodtryck och en rad psykiatriska symptom), binjurehypofunktion, fördröjd tillväxt hos barn och ungdomar, benskörhet, starr, glaukom
- för hög sockerhalt i blodet
- ångest, sömnstörningar, förändringar i beteende inklusive hyperaktivitet och retlighet (främst med barn).
- pipande andning efter intagandet av läkemedel (s.k. paradoxal bronkospasm).
Ej kända (frekvensen kan inte beräknas från tillgängliga data):
- nedstämdhet, aggressivt beteende (särskilt hos barn)
- näsblod
- dimsyn.
Infektionsrisken, hesheten och halsirritationen minskar, om du sköljer munnen med vatten efter varje inhalationstillfälle.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvaras utom syn- och räckhåll för barn.
Förvaras vid högst 30 °C, på en torr plats. Förvara Diskus i folieförpackningen tills du använder den för första gången. En öppnad folieförpackning ska slängas.
Används före utgångsdatum som anges på förpackningen. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är flutikasonpropionat och en dos innehåller 100, 250 eller 500 mikrog.
- Övriga innehållsämnen är laktosmonohydrat ca 12,5 mg/dos (innehåller mjölkprotein).
Läkemedlets utseende och förpackningsstorlekar
I förpackningen ingår en orangefärgad Diskus inhalator, som innehåller inhalationspulver i 60 färdigt avdelade doser.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
GlaxoSmithKline Oy
Porkalagatan 20 A
00180 Helsingfors
tfn: 010 303030
Tillverkare Glaxo Wellcome Production, Evreux, Frankrike
För ytterligare upplysningar om detta läkemedel, kontakta ombudet för innehavaren av godkännandet för försäljning:
GlaxoSmithKline Oy
Porkalagatan 20 A
00180 Helsingfors
tfn: 010 303030
Denna bipacksedel ändrades senast 1.5.2023