Pakkausseloste
FICOXIL tuggtablett 227 mg
DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN
Ficoxil 227 mg tuggtabletter för hund
DEKLARATION AV AKTIVA SUBSTANSER OCH ÖVRIGA SUBSTANSER
Varje tablett innehåller:
Aktiv substans:Firocoxib 227 mg
Hjälpämnen:Röd järnoxid (E172) 0,525 mg
Gul järnoxid (E172) 0,225 mg
Bikonvexa, rosaaktiga och runda tabletter med en korsformad brytskåra på ena sidan utan präglingar. Tabletten kan delas i två eller fyra lika stora delar.
ANVÄNDNINGSOMRÅDEN
Smärtlindring och inflammationshämning i samband med osteoartrit hos hund.
Postoperativ smärtlindring och inflammationshämning i samband med mjukdels-, ortopedisk- och tandkirurgi hos hund.
KONTRAINDIKATIONER
Använd inte till dräktiga eller lakterande tikar.
Använd inte till djur yngre än 10 veckor eller som väger mindre än 3 kg.
Använd inte till djur med gastrointestinala blödningar, sjuka blodbildsförändringar (bloddyskrasi) eller blödningsrubbningar.
Använd inte samtidigt med andra antiinflammatoriska icke-steroida läkemedel (NSAID) eller kortikosteroider.
Använd inte vid överkänslighet mot den aktiva substansen eller mot något av hjälpämnena.
BIVERKNINGAR
Kräkningar och diarréer har rapporterats. Dessa biverkningar är i de flesta fall av övergående natur och försvinner då behandlingen avbryts. Njur- och/eller leverrubbningar har i mycket sällsynta fall rapporterats hos hundar som fått rekommenderad dos. I sällsynta fall har störningar i centrala och perifera nervsystemet rapporterats hos behandlade hundar.
Avbryt behandling och kontakta veterinär om följande biverkningar inträffar: kräkning, upprepade diarréer, blod i avföringen, plötslig viktminskning, anorexi, håglöshet eller förändringar i biokemiska parametrar för njur- eller leverfunktion. Som med andra NSAID kan allvarliga biverkningar inträffa, som i mycket sällsynta fall kan vara fatala.
Frekvensen av biverkningar anges enligt följande:
- Mycket vanliga (fler än 1 av 10 behandlade djur som uppvisar biverkningar)
- Vanliga (fler än 1 men färre än 10 djur av 100 behandlade djur)
- Mindre vanliga (fler än 1 men färre än 10 djur av 1 000 behandlade djur)
- Sällsynta (fler än 1 men färre än 10 djur av 10 000 behandlade djur)
- Mycket sällsynta (färre än 1 djur av 10 000 behandlade djur, enstaka rapporterade händelser inkluderade)
Om du observerar biverkningar, även sådana som inte nämns i denna bipacksedel, eller om du tror att läkemedlet inte har fungerat, meddela din veterinär.
Du kan också rapportera biverkningar via det nationella rapporteringssystemet
DJURSLAG
Hund.

DOSERING FÖR VARJE DJURSLAG, ADMINISTRERINGSSÄTT OCH ADMINISTRERINGSVÄGAR
Dosera 5 mg firocoxib per kg kroppsvikt en gång om dagen.
Vid smärtlindring och inflammationshämning efter kirurgi kan djuren doseras med start cirka 2 timmar före det kirurgiska ingreppet och därefter i upp till 3 dagar vid behov. Efter ortopedisk kirurgi kan behandling med samma dagliga dos fortsätta längre än 3 dagar beroende på observerad respons och efter bedömning av behandlande veterinär.
Ges via munnen enligt tabellen nedan. Tabellen är avsedd som riktlinje för att ge läkemedlet i rekommenderad dos.
| Kroppsvikt (kg) |
Antal tabletter per styrka |
mg/kg |
|
| 57 mg |
227 mg |
||
| 3,0–5,5 |
½ |
5,2–9,5 |
|
| 5,6–7,5 |
¾ |
5,7–7,6 |
|
| 7,6–10 |
1 eller ¼ |
5,7-7,5 |
|
| 10,1–13 |
1 ¼ |
5,5–7,1 |
|
| 13,1–16 |
1 ½ |
5,3–6,5 |
|
| 16,1–18,5 |
1 ¾ |
5,4–6,2 |
|
| 18,6–22,5 |
½ |
5,0–6,1 |
|
| 22,6–34 |
¾ |
5,0–7,5 |
|
| 34,1–45 |
1 |
5,0–6,7 |
|
| 45,1–56 |
1 ¼ |
5,1–6,3 |
|
| 56,1–68 |
1 ½ |
5,0–6,1 |
|
| 68,1–79 |
1 ¾ |
5,0–5,8 |
|
| 79,1–90 |
2 |
5,0–5,7 |
|

 = ¼ tablett = ½ tablett = ¾ tablett = 1 tablett
= ¼ tablett = ½ tablett = ¾ tablett = 1 tablett
Tabletten kan delas i två eller fyra lika stora delar för att möjliggöra korrekt dosering.
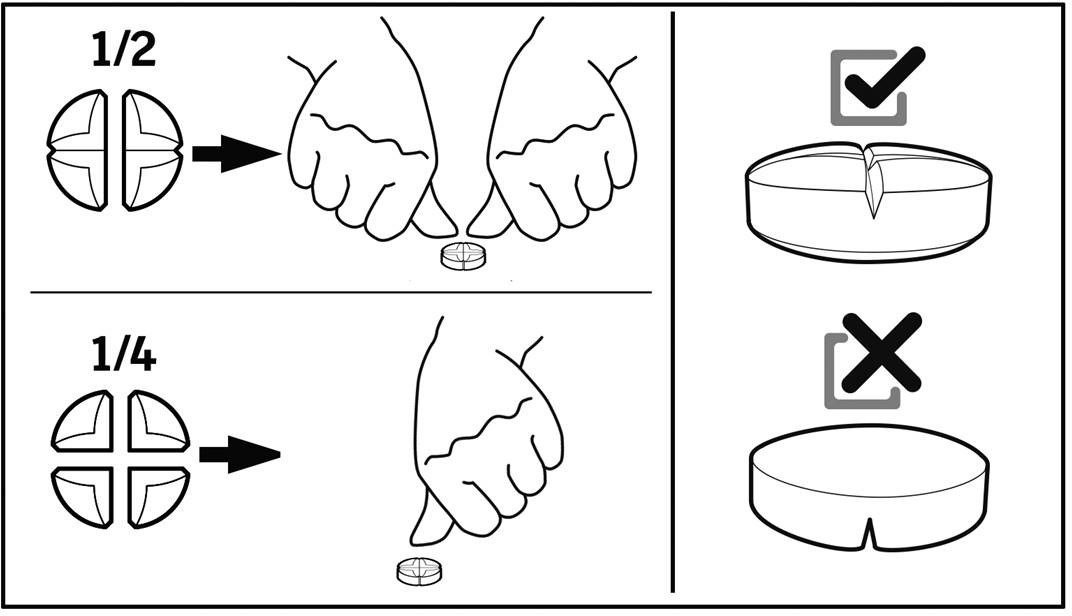
ANVISNING FÖR KORREKT ADMINISTRERING
Tabletter kan ges med eller utan foder. Överskrid inte rekommenderad dos.
Behandlingstidens längd beror på observerad respons. Långvarig behandling ska noga övervägas eftersom fältstudier var begränsade till 90 dagar och behandlingen ska regelbundet övervakas av veterinär.
KARENSTIDER
Ej relevant.
SÄRSKILDA FÖRVARINGSANVISNINGAR
Förvaras utom syn- och räckhåll för barn. Inga särskilda förvaringsanvisningar.
Delade tabletter ska förvaras i blisterförpackningen och ges vid nästa dos inom 7 dagar.
Använd inte detta läkemedel efter utgångsdatumet på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
SÄRSKILDA VARNINGAR
Särskilda varningar för respektive djurslag:
Inga.
Särskilda försiktighetsåtgärder för djur:
Eftersom tabletterna är smaksatta bör de förvaras på ett säkert ställe utom räckhåll för djur. Överskrid inte den rekommenderade dosen enligt doseringstabellen.
Behandling av mycket unga djur, eller djur med misstänkt eller konstaterad nedsatt njur-, hjärt- eller leverfunktion kan innebära en ökad risk. Om behandling inte kan undvikas kräver dessa djur noggrann övervakning av veterinär.
Undvik behandling av dehydrerade, hypovolemiska eller hypotensiva djur då en potentiellt ökad risk för njurtoxicitet föreligger. Samtidig behandling med potentiellt njurtoxiska läkemedel bör undvikas.
När risk för gastrointestinal blödning föreligger, eller om djuret tidigare uppvisat intolerans mot ickesteroida antiinflammatoriska läkemedel (NSAID), ska behandling med detta läkemedel noggrant övervakas av veterinär.
Njur- och/eller leverrubbningar har i mycket sällsynta fall rapporterats hos hundar som fått rekommenderad dos. En del av dessa fall kan ha haft subklinisk (asymtomatisk) lever- eller njursjukdom innan behandlingen påbörjades. Lämpliga laboratorietester för att fastställa utgångsvärden för biokemiska parametrar för njur- eller leverfunktion rekommenderas därför innan och periodvis under behandling.
Behandlingen ska avbrytas om följande symptom observeras: upprepade diarréer, kräkning, blod i avföringen, plötslig viktminskning, anorexi, håglöshet eller förändringar av biokemiska parametrar för njur- eller leverfunktion.
Särskilda försiktighetsåtgärder för personer som ger läkemedlet till djur:
Detta läkemedel kan vara skadligt vid oavsiktligt intag.
Tabletterna ska ges och förvaras utom syn- och räckhåll för barn för att förhindra att barn kan få tag i dem. Halverade tabletter eller fjärdedelar av tabletterna ska förvaras i den öppna blisterförpackningen som finns i den yttre kartongen.
Laboratoriestudier på råttor och kaniner har visat tecken på att firocoxib kan ge reproduktionseffekter och ge upphov till missbildningar hos foster. Gravida kvinnor eller kvinnor som avser att bli gravida bör hantera detta läkemedel med försiktighet.
Tvätta händerna efter hantering av läkemedlet.
Vid oavsiktligt intag av en eller flera tabletter, uppsök genast läkare och visa denna information eller etiketten.
Dräktighet och digivning:
Använd inte under dräktighet och digivning.
Laboratoriestudier på kanin har visat skadliga effekter på foster och moderdjur vid doser motsvarande rekommenderad dos för hund.
Andra läkemedel och Ficoxil:
Förbehandling med andra antiinflammatoriska läkemedel kan resultera i ytterligare eller ökad frekvens av biverkningar. Om andra antiinflammatoriska läkemedel används ska därför en behandlingsfri period på minst 24 timmar iakttas innan behandling med detta läkemedel påbörjas. Vid bestämning av den behandlingsfria perioden ska också det första läkemedlets farmakokinetiska egenskaper beaktas.
Detta läkemedel ska ej ges tillsammans med andra antiinflammatoriska icke-steroida läkemedel (NSAID) eller glukokortikosteroider. Gastrointestinala sår hos djur behandlade med icke-steroida antiinflammatoriska läkemedel kan förvärras av kortikosteroider.
Samtidig behandling med läkemedel som påverkar det renala flödet, t ex diuretika eller ACE-hämmare, ska övervakas kliniskt. Samtidig behandling med potentiellt njurtoxiska läkemedel bör undvikas då en ökad risk för njurskador kan föreligga. Då anestesimedel kan påverka det renala flödet ska parenteral vätsketerapi övervägas vid kirurgi för att minska risken för njurpåverkan vid perioperativ NSAID- behandling.
Samtidig behandling med andra substanser som har hög proteinbindningsgrad kan konkurrera med ficocoxibs proteinbindning och därmed orsaka biverkningar.
Överdosering (symptom, akuta åtgärder, motgift):
Hos hundar som var 10 veckor vid studiestart och behandlade med minst 25 mg/kg/dag (5 gånger rekommenderad dos) under 3 månader observerades följande biverkningar: viktminskning, aptitlöshet, leverförändringar (fettackumulering), hjärnförändringar (vakuolisering), förändringar i duodenum (sår) och även dödsfall. Liknande biverkningar observerades vid doser om minst 15 mg/kg/dag (3 gånger rekommenderad dos) under 6 månader, dock med lägre frekvens och allvarlighetsgrad samt avsaknad av duodenalsår. De observerade biverkningarna i dessa studier var reversibla hos en del hundar när behandlingen avbröts.
Hos hundar som var 7 månader vid studiestart och behandlade med minst 25 mg/kg/dag (5 gånger rekommenderad dos) under 6 månader observerades gastrointestinala biverkningar (kräkning).
Överdosering är inte studerad på djur äldre än 14 månader.
Om symptom på överdosering observeras ska behandlingen avbrytas. Blandbarhetsproblem:
Ej relevant.
SÄRSKILDA FÖRSIKTIGHETSÅTGÄRDER FÖR DESTRUKTION AV EJ ANVÄNT LÄKEMEDEL ELLER AVFALL, I FÖREKOMMANDE FALL
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall.
Fråga veterinären eller apotekspersonalen hur man gör med läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
DATUM DÅ BIPACKSEDELN SENAST GODKÄNDES
04.06.2021
Förpackningsstorlekar:
- 1 kartong innehållande 1 blister med 10 tabletter (10 tabletter).
- 1 kartong innehållande 3 blister med 10 tabletter (30 tabletter).
- 1 kartong innehållande 6 blister med 10 tabletter (60 tabletter).
- 1 kartong innehållande 10 blister med 10 tabletter (100 tabletter).
- 1 kartong innehållande 18 blister med 10 tabletter (180 tabletter).
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND SOM ANSVARAR FÖR FRISLÄPPANDE AV TILLVERKNINGSSATS, OM OLIKA
Innehavare av godkännande för försäljning
LIVISTO Int’l, S.L.
Av. Universitat Autònoma, 29
08290 Cerdanyola del Vallès (Barcelona), Spanien
Tillverkare ansvarig för frisläppande av tillverkningssats: aniMedica Herstellungs GmbH
Im Südfeld 9
48308 Senden-Bösensell Tyskland
aniMedica GmbH Im Südfeld 9
48308 Senden-Bösensell Tyskland
Industrial Veterinaria, S.A. Esmeralda 19,
08950 Esplugues de Llobregat (Barcelona), Spanien