Pakkausseloste
NIMENRIX pulver och vätska till injektionsvätska, lösning i förfylld spruta
Tilläggsinformation
Nimenrix pulver och vätska till injektionsvätska, lösning i förfylld spruta
Vaccin mot grupp A-, C-, W-135 och Y-meningokockinfektion, konjugerat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du får detta vaccin. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta vaccin har ordinerats enbart åt dig eller ditt barn. Ge det inte till andra.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna information har man antagit att det är personen som får vaccinet som även läser informationen, men eftersom vaccinet kan ges både till vuxna och barn kan det också tänkas att du läser informationen för ditt barn.
I denna bipacksedel finns information om följande
- Vad Nimenrix är och vad det används för
- Vad du behöver veta innan du får Nimenrix
- Hur Nimenrix ges
- Eventuella biverkningar
- Hur Nimenrix ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Nimenrix är och vad det används för
Nimenrix är ett vaccin som hjälper till att skydda mot infektioner orsakade av bakterier som kallas för ”Neisseria meningitidis” typ A, C, W-135 och Y.
”Neisseria meningitidis”-bakterier typ A, C, W-135 och Y kan orsaka allvarliga sjukdomar som t.ex.:
- hjärnhinneinflammation (meningit) – en infektion i hinnorna som omger hjärnan och i ryggmärgen
- blodförgiftning (sepsis) – en infektion i blodet
Dessa infektioner överförs lätt mellan personer och kan orsaka dödsfall om de inte behandlas.
Nimenrix kan ges till vuxna, ungdomar, barn och spädbarn över 6 veckors ålder.
Hur Nimenrix verkar
Nimenrix hjälper kroppen att producera sitt eget skydd (antikroppar) mot bakterierna. Dessa antikroppar hjälper till att skydda dig mot sjukdomarna.
Nimenrix skyddar endast mot infektioner som orsakas av "Neisseria meningitidis"-bakterier typ A, C, W-135 och Y.
Vad du behöver veta innan produkten används
Nimenrix ska inte ges:
- om du är allergisk mot den aktiva substansen eller något annat innehållsämne i detta vaccin (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Tecken på en allergisk reaktion kan bland annat vara kliande hudutslag, andfåddhet och svullnad av ansikte eller tunga. Sök omedelbart läkare om du märker något av dessa tecken.
Tala med läkare eller sjuksköterska innan du får Nimenrix om du känner dig osäker.
Varningar och försiktighet
Tala med läkare eller sjuksköterska innan du får detta vaccin om:
- du har en infektion med hög feber (över 38 °C). Om detta gäller dig, skjuts vaccinationen upp tills du känner dig bättre. En lindrig infektion som en förkylning bör inte vara något problem. Tala dock först med läkaren eller sjuksköterskan.
- du har blödningsrubbningar eller lätt får blåmärken.
Om något av ovanstående gäller dig (eller om du är osäker) ska du tala med läkaren eller sjuksköterskan innan du får Nimenrix.
Nimenrix ger eventuellt inte fullt skydd åt alla som är vaccinerade. Om du har svagt immunsystem (t.ex. på grund av HIV-infektion eller läkemedel som påverkar immunsystemet) får du eventuellt inte full nytta av Nimenrix.
Svimning kan förekomma (främst hos ungdomar) efter, eller till och med före, all nålinjektion. Tala därför om för läkaren eller sjuksköterskan om du eller ditt barn svimmat vid tidigare injektion.
Andra läkemedel och Nimenrix
Tala om för läkare eller sjuksköterska om du tar eller nyligen har tagit andra läkemedel, även andra vacciner och receptfria läkemedel.
Nimenrix verkar eventuellt inte lika bra om du tar läkemedel som påverkar ditt immunsystem.
Hos spädbarn kan Nimenrix ges samtidigt med kombinerade vacciner mot difteri-stelkramp-acellulär kikhosta (DTaP), inklusive kombinations DTaP-vacciner med hepatit B, inaktiverat poliovirus eller Haemophilus influenzae typ b (HBV, IPV eller Hib) såsom DTaP-HBV-IPV/Hib-vaccin, och med 10-valent konjugerat pneumokockvaccin.
Från 1 års ålder och uppåt, kan Nimenrix ges samtidigt med något av följande vacciner: hepatit A (HAV) och hepatit B (HBV) vaccin, mässling-påssjuke-röda hund-vaccin (MPR), mässling-påssjuke-röda hund-vattkopps-vaccin (MPRV), 10-valent konjugerat pneumokockvaccin eller vaccin mot säsongsinfluensa utan adjuvans.
Under det andra levnadsåret, kan Nimenrix även ges samtidigt med kombinerade vacciner mot difteri - stelkramp - acellulär kikhosta (DTaP), inklusive kombinations DTaP-vacciner med hepatit B, inaktiverat poliovirus eller Haemophilus influenzae typ b (HBV, IPV eller Hib) såsom DTaP-HBV-IPV/Hib-vaccin, och 13-valent konjugerat pneumokockvaccin.
Hos individer i åldern 9 till 25 år kan Nimenrix ges samtidigt med vaccin mot humant papillomvirus [typ 16 och 18] och kombinerat vaccin mot difteri (reducerat antigeninnehåll), stelkramp och acellulär kikhosta.
Om möjligt bör Nimenrix och ett TT innehållande vaccin, såsom DTaP-HBV-IPV/Hib-vaccin administreras samtidigt eller så bör Nimenrix administreras minst en månad före det TT innehållande vaccinet.
Olika injektionsställen används för varje vaccin.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, måste du tala om det för läkaren innan du får Nimenrix.
Körförmåga och användning av maskiner
Nimenrix påverkar sannolikt inte din förmåga att framföra fordon eller använda maskiner. Du ska dock inte köra bil eller använda maskiner om du inte känner dig bra.
Nimenrix innehåller natrium
Detta vaccin innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Hur produkten används
Nimenrix ges av en läkare eller sjuksköterska.
Nimenrix injiceras alltid i en muskel, vanligen i överarmen eller låret.
Primärvaccination
Spädbarn från 6 veckor upp till 6 månaders ålder
Två injektioner ges med 2 månaders mellanrum vid t.ex. 2 och 4 månaders ålder (den första injektionen kan ges från 6 veckors ålder).
Spädbarn från 6 månaders ålder, barn, ungdomar och vuxna
En injektion.
Påfyllnadsdoser
Spädbarn från 6 veckor upp till 12 månaders ålder
En påfyllnadsdos vid 12 månaders ålder, minst 2 månader efter den senaste dosen Nimenrix.
Tidigare vaccinerade personer från 12 månaders ålder
Tala om för din läkare om du tidigare har fått en injektion med ett annat meningokockvaccin än Nimenrix.
Din läkare kommer att meddela dig om och när du behöver ytterligare en dos Nimenrix, särskilt om du eller ditt barn:
- fick den första dosen vid 6-14 månaders ålder och kan löpa särskild risk att få en infektion orsakad av Neisseria meningitidis typ W‑135 eller Y
- fick dosen för mer än ett år sedan och kan löpa risk att få en infektion orsakad av Neisseria meningitidis typ A
- fick den första dosen i åldern 12–23 månader och kan löpa särskild risk att få en infektion orsakad av Neisseria meningitidis typ A, C, W-135 eller Y.
Du blir informerad om när det är dags för dig eller ditt barn att komma tillbaka för nästa injektion. Om du eller ditt barn missar en inbokad injektion är det viktigt att du beställer ny tid.
Se till att du eller ditt barn får hela vaccinationsserien.
Om du har ytterligare frågor om detta vaccin, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem. Följande biverkningar kan förekomma med detta läkemedel:
Mycket vanliga (kan förekomma vid fler än 1 av 10 doser av vaccinet):
- feber
- trötthet
- huvudvärk
- dåsighet
- aptitförlust
- irritationskänsla
- svullnad, smärta och rodnad där injektionen ges.
Vanliga (kan förekomma vid upp till 1 av 10 doser av vaccinet):
- blåmärke (hematom) där injektionen ges
- mag- och matsmältningsproblem som t.ex. diarré, kräkning och illamående
- hudutslag (spädbarn).
Mindre vanliga (kan förekomma vid upp till 1 av 100 doser av vaccinet):
- utslag
- nässelutslag
- klåda
- gråt
- yrsel
- muskelvärk
- smärta i armar eller ben
- allmän sjukdomskänsla
- sömnsvårigheter
- minskad känsel eller känslighet, speciellt i huden
- reaktioner där injektionen ges, t.ex. klåda, värmekänsla eller domningskänsla eller en lokal förhårdnad
- allergisk reaktion.
Sällsynta (kan förekomma vid upp till 1 av 1 000 doser av vaccinet):
- krampanfall vid feber.
Ingen känd frekvens: kan inte beräknas från tillgängliga data
- svullnad och rodnad vid injektionsstället; detta kan påverka en stor del av den vaccinerade kroppsdelen
- förstorade lymfkörtlar
- allvarlig allergisk reaktion.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljeer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
- Förvara detta vaccin utom syn- och räckhåll för barn.
- Används före utgångsdatum som anges på kartongen. Utgångsdatumet är den sista dagen i angiven månad.
- Förvaras i kylskåp (2 °C–8 °C).
- Förvaras i originalförpackningen. Ljuskänsligt.
- Får inte frysas.
- Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- De aktiva substanserna är:
- Efter beredning innehåller 1 dos (0,5 ml):
Neisseria meningitidis grupp A polysackarid1 5 mikrogram
Neisseria meningitidis grupp C polysackarid1 5 mikrogram
Neisseria meningitidis grupp W-135 polysackarid1 5 mikrogram
Neisseria meningitidis grupp Y polysackarid1 5 mikrogram
1konjugerat till bärarprotein av tetanustoxoid 44 mikrogram
- Efter beredning innehåller 1 dos (0,5 ml):
- Övriga innehållsämnen är:
- I pulvret: sackaros och trometamol
- I spädningsvätskan: natriumklorid (se avsnitt Vad du behöver veta innan produkten används ”Nimenrix innehåller natrium”) och vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
Nimenrix är ett pulver och en vätska till injektionsvätska, lösning.
Nimenrix levereras i form av ett vitt pulver eller kaka i en engångsinjektionsflaska av glas och en klar och färglös spädningsvätska i en förfylld spruta.
Dessa måste blandas före användning. Det färdigberedda vaccinet är en klar, färglös lösning.
Nimenrix finns i förpackningar om 1 och 10, med eller utan nålar.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning: Pfizer Europe MA EEIG Boulevard de la Plaine 17 1050 Bruxelles Belgien | Tillverkare som ansvarar för frisläppande av tillverkningssats: Pfizer Manufacturing Belgium NV Rijksweg 12 2870 Puurs-Sint-Amands Belgien |
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 430 040
Denna bipacksedel ändrades senast 09/2024
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu
Direktiv för experterna inom hälsovården
Vaccinet är endast avsett för intramuskulär användning. Får inte administreras intravaskulärt, intradermalt eller subkutant.
Om Nimenrix ges samtidigt med andra vacciner ska olika injektionsställen användas.
Nimenrix ska inte blandas med andra vacciner.
Anvisningar för beredning av vaccinet med spädningsvätska i förfylld spruta:
Nimenrix bereds genom att all spädningsvätska i den förfyllda sprutan överförs till injektionsflaskan med pulver.
Bilden visar hur nålen fästs på sprutan. Den spruta som medföljer Nimenrix kan dock skilja sig något (utan skruvgäng) från den spruta som ses på bilden. I så fall ska nålen fästas utan att skruvas.
1. Håll sprutcylindern med en hand (undvik att hålla i sprutans kolvstång), skruva av skyddslocket genom att vrida det moturs.
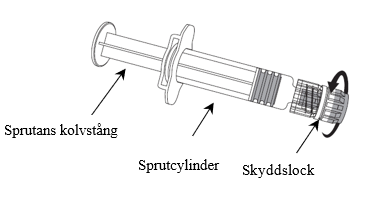
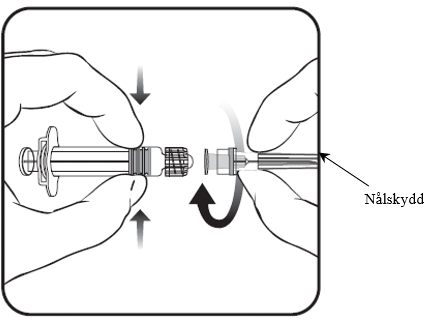
2. Fäst nålen på sprutan genom att skruva nålen medurs tills den låses fast (se bild).
3. Ta bort nålskyddet som ibland kan sitta hårt.
4. Tillsätt spädningsvätskan till pulvret. Skaka därefter blandningen väl tills pulvret är helt upplöst i spädningsvätskan.
Det färdigberedda vaccinet är en klar, färglös lösning.
Det färdigberedda vaccinet ska inspekteras visuellt med avseende på främmande partiklar och/eller fysikaliska förändringar före administrering. Om något av detta observeras ska vaccinet kasseras.
Vaccinet ska användas omedelbart efter beredning.
En ny nål ska användas för administrering av vaccinet.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.