Pakkausseloste
XEOMIN injektiokuiva-aine, liuosta varten 50 U, 100 U, 200 U
XEOMIN 50 yksikköä injektiokuiva-aine, liuosta varten
XEOMIN 100 yksikköä injektiokuiva-aine, liuosta varten
XEOMIN 200 yksikköä injektiokuiva-aine, liuosta varten
Clostridium botulinum A-tyypin neurotoksiini (150 kD), joka ei sisällä kompleksoivia proteiineja
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin sinulle annetaan tätä lääkettä, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä XEOMIN on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin saat XEOMIN-injektion
- Miten XEOMIN-valmistetta käytetään
- Mahdolliset haittavaikutukset
- XEOMIN-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
XEOMIN on lääke, joka sisältää vaikuttavana aineena A-tyypin botuliinitoksiinia, joka vähentää lihasjännitystä tai syljeneritystä injektion antokohdassa.
XEOMIN-valmistetta käytetään seuraavien tilojen hoitoon aikuisilla:
- blefarospasmi ("pakonomainen" luomikouristus) ja hemifasiaalispasmi (toispuolinen kasvolihaskouristus)
- spastinen tortikollis (kierokaula)
- olkapään, ranteen ja/tai käden lihasjännitys/kontrolloimaton lihasjäykkyys (yläraajan jäykkyys)
- neurologisista sairauksista johtuva krooninen runsas syljeneritys tai kuolaaminen (sialorrea).
XEOMIN-valmistetta käytetään ≥ 12 kg painavien 2–17-vuotiaiden lasten ja nuorten hoitoon seuraavassa tapauksessa:
- neurologisista/hermoston kehitykseen liittyvistä sairauksista johtuva krooninen runsas syljeneritys tai kuolaaminen (sialorrea).
Clostridium botulinum A-tyypin neurotoksiinia, jota XEOMIN sisältää, voidaan joskus käyttää myös muiden kuin tässä pakkausselosteessa mainittujen sairauksien hoitoon. Kysy neuvoa lääkäriltä, apteekkihenkilökunnalta tai muulta terveydenhuollon ammattilaiselta tarvittaessa ja noudata aina heiltä saamiasi ohjeita.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä XEOMIN-valmistetta
- jos olet allerginen A-tyypin botuliinitoksiinille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on jokin yleistynyt lihastoimintaa heikentävä sairaus (esim. myasthenia gravis, Lambert-Eatonin oireyhtymä)
- jos aiotussa injektiokohdassa on infektio tai tulehdus.
Varoitukset ja varotoimet
Väärin kohdistetusta A-tyypin botuliinitoksiini-injektiosta mahdollisesti aiheutuvana haittavaikutuksena saattaa esiintyä läheisten lihasryhmien tilapäinen lamaantuminen. Hyvin harvinaisia haittavaikutuksia, jotka saattavat liittyä toksiinin leviämiseen kauas injektiokohdasta ja joissa oireet vastaavat A-tyypin botuliinitoksiinin vaikutuksia, on raportoitu (esim. liiallista lihasheikkoutta, nielemisvaikeuksia tai ruuan tai juoman joutumista vahingossa hengitysteihin). Valmistetta suositeltuina annoksina saaneilla potilailla saattaa esiintyä liiallista lihasten heikkoutta.
Jos annos on liian suuri tai injektioita annetaan liian usein, vasta-aineiden muodostumisen riski saattaa suurentua. Vasta-aineiden muodostuminen saattaa johtaa A-tyypin botuliinitoksiinihoidon epäonnistumiseen riippumatta siitä, mihin tarkoitukseen hoitoa annetaan.
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin saat XEOMIN-injektion:
- jos sinulla on mikä tahansa verenvuotohäiriö
- jos saat veren hyytymistä estävää lääkitystä (esim. kumariinia, hepariinia, asetyylisalisyylihappoa, klopidogreeliä)
- jos sinulla on huomattavaa heikkoutta tai surkastumista lihaksessa, johon pistos tullaan antamaan
- jos sairastat amyotrofista lateraaliskleroosia (ALS-tautia), joka voi johtaa yleistyneeseen lihasten surkastumiseen
- jos sinulla on jokin muu sairaus, joka häiritsee hermojen ja luurankolihasten yhteistoimintaa (perifeerinen neuromuskulaarinen toimintahäiriö)
- jos sinulla on tai on ollut nielemisvaikeuksia
- jos sinulla on tai on ollut kouristuskohtauksia
- jos sinulla on aiemmin ollut ongelmia A-tyypin botuliinitoksiinipistosten yhteydessä
- jos sinulle aiotaan tehdä leikkaus.
Ota yhteyttä lääkäriin ja hakeudu heti hoitoon, jos sinulle ilmaantuu jotakin seuraavista:
- hengitys-, nielemis- tai puhevaikeuksia
- nokkosihottumaa, turvotusta, kuten kasvojen tai nielun turvotusta, hengityksen vinkumista, pyörrytyksen tunnetta ja hengenahdistusta (vaikean allergisen reaktion mahdollisia oireita).
Toistuvat XEOMIN-injektiot
Jos saat toistuvasti XEOMIN-injektioita, lääkkeen teho voi voimistua tai heiketä. Mahdollisia syitä tähän ovat
- lääkäri saattaa käyttää erilaista injektioliuoksen käyttökuntoon saattamistapaa
- erot hoitovälien pituuksissa
- injektiot annetaan toiseen lihakseen
- XEOMIN-valmisteen vaikuttavan aineen tehon vähäiset vaihtelut
- lääkkeen tehottomuus/hoidon epäonnistuminen hoidon aikana.
Blefarospasmi ("pakonomainen" luomikouristus) ja hemifasiaalispasmi (toispuolinen kasvolihaskouristus)
Kerro lääkärille ennen XEOMIN-hoidon saamista, jos
- sinulle on tehty silmäleikkaus. Tällöin lääkäri noudattaa erityisiä varotoimenpiteitä.
- sinulla on riski sairastua ahdaskulmaglaukoomaan. Tämä sairaus voi aiheuttaa silmänpaineen nousua ja vahingoittaa näköhermoa. Lääkärisi tietää, jos sinulla on tällainen vaara.
Silmäluomien pehmytkudokseen voi hoidon aikana tulla pieniä pistemäisiä verenpurkaumia. Lääkäri voi vähentää tätä painamalla injektion antokohtaa kevyesti välittömästi injektion annon jälkeen.
Silmän räpyttely voi vähentyä silmälihakseen annetun XEOMIN-injektion jälkeen. Tämä voi altistaa silmän läpinäkyvän etuosan (sarveiskalvon) kuivumiselle, mikä voi johtaa sarveiskalvon pinnan vaurioitumiseen ja tulehdukseen (sarveiskalvon haavauma).
Spastinen tortikollis (kierokaula)
Injektion jälkeen sinulle voi tulla lieviä tai vaikea-asteisia nielemisvaikeuksia. Tämä voi johtaa hengitysvaikeuksiin ja sinulla voi olla suurempi riski vetää henkeen vierasaineita tai nesteitä. Keuhkoissa oleva vierasaine voi johtaa tulehdukseen tai infektioon (keuhkokuume). Lääkäri antaa tarvittaessa erityishoitoa (esim. ruokintaletkun asennus).
Nielemisvaikeudet voivat kestää jopa kaksi tai kolme viikkoa injektion annon jälkeen. Yhdellä potilaalla tiedetään nielemisvaikeuksien kestäneen jopa viisi kuukautta.
Jos et ole harrastanut liikuntaa pitkään aikaan, liikuntaa pitää lisätä asteittain XEOMIN-injektion jälkeen.
Lihasjännitys/kontrolloimaton lihasjäykkyys
XEOMIN-valmistetta voidaan käyttää aivohalvauksen jälkeen esiintyvän käsivarren lihasjännityksen/kontrolloimattoman lihasjäykkyyden hoitoon esim. käsivarressa tai kädessä. XEOMIN tehoaa, kun sitä käytetään yhdessä tavanomaisten hoitomenetelmien yhteydessä. XEOMIN-valmistetta tulee käyttää yhdessä näiden hoitomuotojen kanssa.
On epätodennäköistä, että lääke parantaa nivelten liikkuvuutta, jos niitä ympäröivät lihakset ovat menettäneet venymiskykynsä.
Jos et ole harrastanut liikuntaa pitkään aikaan, liikuntaa pitää lisätä asteittain XEOMIN-injektion jälkeen.
Krooninen runsas syljeneritys tai kuolaaminen
Jotkin lääkkeet (esim. klotsapiini, aripipratsoli, pyridostigmiini) saattavat aiheuttaa liiallista syljeneritystä. Lääkityksen vaihtamista toiseen, annoksen pienentämistä tai jopa lääkityksen lopettamista on harkittava ennen XEOMIN-valmisteen käyttöä runsaan syljenerityksen hoitoon. XEOMIN-valmisteen käyttöä lääkityksen aiheuttaman runsaan syljenerityksen hoitoon ei ole tutkittu.
Jos XEOMIN-valmisteen käytön aikana ilmenee suun kuivumista, lääkäri harkitsee annoksen pienentämistä.
Jos XEOMIN vähentää syljeneritystä, se voi johtaa karieksen tai muiden hammasongelmien kehittymiseen tai pahenemiseen. Ota yhteyttä hammaslääkäriin, kun aloitat XEOMIN-valmisteen käytön kroonisen runsaan syljenerityksen tai kuolaamisen hoitoon. Hammaslääkäri päättää tarvittaessa kariesta ehkäisevistä toimista.
Lapset ja nuoret
Älä anna tätä lääkettä alle 2-vuotiaille lapsille, alle 12 kg:aa painaville lapsille tai lapsille ja nuorille muun kuin kroonisen kuolaamisen hoitoon, koska XEOMIN-valmisteen käyttöä tässä potilasryhmässä ei ole varmistettu, eikä sitä siksi suositella.
Muut lääkevalmisteet ja XEOMIN
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
XEOMIN-valmisteen vaikutus voi lisääntyä seuraavien lääkkeiden vaikutuksesta:
- tiettyjen infektiotautien hoitoon käytettävät lääkkeet (spektinomysiini- tai aminoglykosidiantibiootit [esim. neomysiini, kanamysiini, tobramysiini])
- muut lihaksia rentouttavat lääkkeet (esim. tubokurariinin kaltaiset lihasrelaksantit). Tällaisia lääkkeitä käytetään esim. yleisanestesiassa. Kerro nukutuslääkärille ennen leikkausta, jos olet saanut XEOMIN-valmisteen.
- käytettäessä valmistetta kroonisen runsaan syljenerityksen tai kuolaamisen hoitoon: muut syljeneritystä vähentävät lääkkeet (esim. antikolinergiset aineet, kuten atropiini, glykopyrronium tai skopolamiini) tai pään ja kaulan alueen (sylkirauhaset mukaan lukien) sädehoito. Kerro lääkärille, jos saat tai sinulle suunnitellaan sädehoitoa.
XEOMIN-valmisteen käytössä pitää olla näissä tapauksissa varovainen.
Tietyt malaria- ja reumalääkkeet (aminokinoliinit) voivat heikentää XEOMIN-valmisteen tehoa.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
XEOMIN-valmistetta ei saa käyttää raskauden aikana, ellei lääkäri katso, että hoidon välttämättömyys ja mahdollinen hyöty muodostavat perusteen sikiölle mahdollisesti aiheutuvalle riskille.
XEOMIN-valmisteen käyttämistä imettäville äideille ei suositella.
Ajaminen ja koneiden käyttö
Jos sinulla on riippuvat silmäluomet, voimattomuutta (asteniaa), lihasheikkoutta, huimausta tai näköhäiriöitä, et saa ajaa autoa etkä ryhtyä vaaran mahdollisesti aiheuttavaan toimintaan.
Jos olet epävarma, kysy neuvoa lääkäriltä.
Lääke voi heikentää kykyä kuljettaa moottoriajoneuvoa tai tehdä tarkkaa keskittymistä vaativia tehtäviä. On omalla vastuullasi arvioida, pystytkö näihin tehtäviin lääkehoidon aikana. Lääkkeen vaikutuksia ja haittavaikutuksia on kuvattu muissa kappaleissa. Lue koko pakkausseloste opastukseksesi. Keskustele lääkärin tai apteekkihenkilökunnan kanssa, jos olet epävarma.
Miten valmistetta käytetään
XEOMIN-valmistetta saavat antaa vain lääkärit, joilla on tarvittava pätevyys A-tyypin botuliinitoksiinin käyttöön.
Lääkärisi päättää sinulle parhaiten sopivan annoksen, antotiheyden ja injektiokohtien määrän. XEOMIN-hoidon alkutulokset arvioidaan, jonka jälkeen voi olla tarpeen säätää annosta, kunnes saavutetaan haluttu hoitotulos. Lääkäri määrittää hoitokertojen välin todellisen hoidon tarpeesi mukaan.
Jos sinusta tuntuu, että XEOMIN-valmistetta vaikutus on liian voimakas tai liian heikko, kerro tästä lääkärille. Jos hoitovaikutusta ei ilmene, on harkittava muita hoitokeinoja.
Blefarospasmi ("pakonomainen" luomikouristus) ja hemifasiaalispasmi (toispuolinen kasvolihaskouristus)
Suositeltu aloitusannos on enintään 25 yksikköä silmää kohden, ja jatkohoitoon suositeltu kokonaisannos on enintään 50 yksikköä per silmä. Lääkkeen vaikutus alkaa tavallisesti näkyä 4 vuorokauden kuluessa injektion annosta. Jokaisen hoitokerran vaikutus kestää yleensä noin 3–5 kuukautta. Se voi kuitenkin kestää huomattavasti pidemmän tai lyhyemmän ajan. Alle 12 viikon hoitoväliä ei suositella.
Alle kolmen kuukauden välein tapahtuva hoito ei yleensä lisää lääkkeen tehoa.
Jos sinulla on hemifasiaalispasmi (toispuolinen kasvolihaskouristus), lääkäri noudattaa blefarospasmin (”pakonomaisen” luomikouristuksen) hoitoa koskevia suosituksia ja rajoittaa hoidon kasvojen toiseen puoleen. Hemifasiaalispasmissa (toispuolisessa kasvolihaskouristuksessa) hoitoa annetaan vain kasvojen yläosaan, sillä kasvojen alaosaan annetuista XEOMIN-injektioista voi aiheutua tavanomaista suurempi haittavaikutusriski, kuten voimakkaan paikallisen heikkouden riski.
Spastinen tortikollis (kierokaula)
Suositeltu annos injektiokohtaa kohden on enintään 50 yksikköä, ja ensimmäisen hoitokerran enimmäisannos on 200 yksikköä. Lääkäri voi seuraavilla hoitokerroilla antaa saadun vasteen mukaan enintään 300 yksikköä. Lääkkeen vaikutus alkaa tavallisesti näkyä 7 vuorokauden kuluessa injektion annosta. Jokaisen hoitokerran vaikutus kestää yleensä noin 3–4 kuukautta. Se voi kuitenkin kestää huomattavasti pidemmän tai lyhyemmän ajan. Hoitokertojen väliksi ei suositella alle 10 viikkoa.
Olkapään, ranteen ja käden lihasjännitys/kontrolloimaton lihasjäykkyys (yläraajan jäykkyys)
Suositeltu annos on enintään 500 yksikköä hoitokertaa kohti, ja olkapään lihaksiin saa antaa enintään 250 yksikköä. Potilasraporttien mukaan vaikutus alkaa 4 vuorokauden kuluttua hoidosta. Lihastonus paranee 4 viikon kuluessa. Hoidon teho kestää yleensä 12 viikkoa. Se voi kuitenkin kestää huomattavasti pidemmän tai lyhyemmän ajan. Hoitokertojen välin tulee olla vähintään 12 viikkoa.
Krooninen runsas syljeneritys tai kuolaaminen aikuisilla
Suositeltu annos on 100 yksikköä hoitokertaa kohti. Enimmäisannosta ei pidä ylittää. Hoitokertojen välin tulee olla vähintään 16 viikkoa.
Krooninen runsas syljeneritys tai kuolaaminen lapsilla ja nuorilla
Suositeltu annos hoitokertaa kohti riippuu painosta. Enimmäisannos saa olla korkeintaan 75 yksikköä. Hoitokertojen välin tulee olla vähintään 16 viikkoa.
Antotapa
Käyttövalmis XEOMIN-liuos on tarkoitettu annettavaksi injektiona lihakseen (intramuskulaarinen käyttö) ja rauhaseen (sylkirauhaseen) (katso terveydenhuollon ammattilaisille suunnatut ohjeet pakkausselosteen lopusta). Aikuisille sylkirauhasten paikallistamiseen voidaan käyttää anatomisia maamerkkejä tai ultraääniohjausta, joskin ultraääniohjaus on suositeltavampi, koska se on tehokkaampi. Lasten ja nuorten hoidossa on käytettävä ultraääniohjausta.
Lapsille ja nuorille voidaan ennen injektiota antaa paikallispuudute (kuten puudutusvoide), rauhoituslääke tai sekä puudute että rauhoituslääke.
Jos sinulle annetaan enemmän XEOMIN-valmistetta kuin pitäisi
Jos olet saanut liian suuren lääkeannoksen tai vaikkapa lapsi on vahingossa saanut lääkettä, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111 Suomessa, 112 Ruotsissa) riskin arvioimiseksi ja lisäohjeiden saamiseksi.
Yliannoksen oireet:
Yliannoksen oireet eivät ilmaannu heti pistoksen jälkeen. Oireita voivat olla yleinen heikkous, silmäluomien riippuminen, kahtena näkeminen, hengitys- ja puhevaikeudet sekä hengityslihasten lamaantuminen tai nielemisvaikeudet, joista voi aiheutua keuhkokuume.
Toimenpiteet yliannoksen yhteydessä:
Jos huomaat yliannoksen oireita, hakeudu heti päivystyspoliklinikalle tai pyydä läheisiäsi viemään sinut sinne päästäksesi sairaalahoitoon. Lääkärin seuranta usean päivän ajan ja hengityksen avustaminen saattavat olla tarpeen.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Haittavaikutukset havaitaan tavallisesti ensimmäisen viikon aikana hoidon jälkeen ja ne ovat luonteeltaan tilapäisiä. Haittavaikutukset saattavat liittyä lääkkeeseen, injektiotekniikkaan tai kumpaankin. Haittavaikutukset voivat rajoittua injektiokohtaa ympäröivälle alueelle (esim. paikallinen lihasheikkous, paikallinen kipu, tulehdus, pistely (parestesiat), heikentynyt tuntoaisti (hypestesia), arkuus, turvotus (yleinen), pehmytkudosturvotus (edeema), ihon punoitus (eryteema), kutina, paikallinen infektio, verenpurkautuma, verenvuoto ja/tai mustelmat).
Pistos voi aiheuttaa kipua. Neulan aiheuttama kipu tai ahdistus voi johtaa pyörtymiseen, pahoinvointiin, tinnitukseen (korvien soimiseen) tai verenpaineen laskuun.
XEOMIN-injektiopaikasta kaukana sijaitsevien lihasten rentoutumisesta aiheutuvia haittavaikutuksia voivat olla mm. liiallinen lihasheikkous tai nielemisvaikeudet. Nielemisvaikeudet voivat aiheuttaa vierasaineen vetämisen henkeen, mistä aiheutuu keuhkotulehdus ja joissakin tapauksissa kuolema.
XEOMIN saattaa aiheuttaa allergisen reaktion. Vakavia ja/tai välittömiä allergisia reaktioita (anafylaksi) tai allergisia reaktioita valmisteen sisältämälle seerumille (seerumitauti), joista aiheutuu esimerkiksi hengitysvaikeuksia (dyspnea), nokkosihottumaa (urtikaria) tai pehmytkudosturvotusta (edeema), on raportoitu harvoin. Joitakin näistä reaktioista on havaittu tavanomaisen A-tyypin botuliinitoksiinikompleksin käytössä. Niitä on esiintynyt, kun toksiinia on annettu yksinään tai yhdessä samankaltaisia reaktioita aiheuttaviksi tiedettyjen lääkkeiden kanssa. Allerginen reaktio saattaa aiheuttaa mitä tahansa seuraavista oireista:
- hengitys-, nielemis- tai puhevaikeuksia kasvojen, huulten, suun tai kurkun turpoamisen seurauksena
- käsien, jalkaterien tai nilkkojen turpoamista.
Jos sinulla ilmenee mitä tahansa näistä haittavaikutuksista, kerro niistä lääkärillesi välittömästi tai pyydä läheisiäsi tekemään niin puolestasi ja mene lähimmän sairaalan ensiapuasemalle.
XEOMIN-valmisteen käytön yhteydessä on havaittu seuraavia haittavaikutuksia:
Blefarospasmi ("pakonomainen" luomikouristus)
Hyvin yleiset (saattavat esiintyä useammalla kuin 1 potilaalla 10:stä):
Riippuluomi (ptoosi).
Yleiset (saattavat esiintyä enintään 1 potilaalla 10:stä):
Silmien kuivuminen, näön sumeneminen, näkökyvyn heikentyminen, suun kuivuminen, injektiokohdan kipu.
Melko harvinaiset (saattavat esiintyä enintään 1 potilaalla 100:sta):
Päänsärky, kasvolihasten heikkous (kasvohalvaus), kahtena näkeminen (diplopia), lisääntynyt kyynelvuoto, nielemisvaikeudet (dysfagia), väsymys, lihasheikkous, ihottuma.
Hemifasiaalispasmi (toispuolinen kasvolihaskouristus)
Hemifasiaalispasmin hoidossa esiintyvät haittavaikutukset ovat oletettavasti samankaltaisia kuin blefarospasmin hoidossa esiintyvät haittavaikutukset.
Spastinen tortikollis (kierokaula)
Hyvin yleiset (saattavat esiintyä useammalla kuin 1 potilaalla 10:stä):
Nielemisvaikeudet (dysfagia).
Yleiset (saattavat esiintyä enintään 1 potilaalla 10:stä):
Niskakipu, lihasheikkous, tuki- ja liikuntaelimistön kipu (myalgia), tuki- ja liikuntaelimistön jäykkyys, lihasspasmit, päänsärky, huimaus, injektiokohdan kipu, heikotus (astenia), suun kuivuminen, pahoinvointi, lisääntynyt hikoilu (hyperhidroosi), ylempien hengitysteiden tulehdus, pyörrytyksen tunne (presynkopee).
Melko harvinaiset (saattavat esiintyä enintään 1 potilaalla 100:sta):
Puheen häiriöt (dysfonia), hengenahdistus (dyspnea), ihottuma.
Kierokaulaisuuden hoito saattaa aiheuttaa vaikeudeltaan vaihtelevia nielemisvaikeuksia. Tämä voi johtaa siihen, että potilaan hengitysteihin voi hengityksen mukana joutua vieraita aineita, mikä saattaa vaatia hoitotoimenpiteitä. Nielemisvaikeudet voivat kestää kaksi tai kolme viikkoa injektion annon jälkeen, mutta on raportoitu yksi tapaus, jossa nielemisvaikeudet kestivät viisi kuukautta. Nielemisvaikeudet näyttävät olevan annoksen suuruudesta riippuvaisia.
Olkapään, ranteen ja käden lihasjännitys/kontrolloimaton lihasjäykkyys (yläraajan jäykkyys)
Yleiset (saattavat esiintyä enintään 1 potilaalla 10:stä):
Suun kuivuminen.
Melko harvinaiset (saattavat esiintyä enintään 1 potilaalla 100:sta):
Päänsärky, heikentynyt ihon tuntoaisti (hypestesia), lihasheikkous, raajakipu, voimattomuus (astenia), lihaksiin ja luustoon liittyvä kipu (myalgia), nielemisvaikeudet (dysfagia), pahoinvointi.
Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin):
Injektiokohdan kipu.
Krooninen runsas syljeneritys tai kuolaaminen aikuisilla
Yleiset (saattavat esiintyä enintään 1 potilaalla 10:stä):
Suun kuivuminen, nielemisvaikeudet (dysfagia), pistely (parestesiat).
Melko harvinaiset (saattavat esiintyä enintään 1 potilaalla 100:sta):
Syljen sakeutuminen, puheen häiriöt, makuhäiriöt (dysgeusia).
Joissakin tapauksissa on ilmoitettu pitkäaikaista (> 110 vuorokautta), vaikea-asteista suun kuivumista, mistä voi aiheutua lisäkomplikaatioita, kuten ientulehdusta, nielemisvaikeuksia ja hampaiden reikiintymistä.
Krooninen runsas syljeneritys tai kuolaaminen lapsilla/nuorilla
Melko harvinaiset (saattavat esiintyä enintään 1 potilaalla 100:sta):
Nielemisvaikeudet (dysfagia)
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin):
Suun kuivuminen, syljen sakeutuminen, suukipu, hampaiden reikiintyminen
Markkinoille tulon jälkeinen käyttökokemus
Seuraavia haittavaikutuksia, joiden yleisyys on tuntematon, on ilmoitettu XEOMIN-valmisteen käytössä markkinoille tulon jälkeen riippumatta hoidetusta alueesta: flunssan kaltaiset oireet, pistoskohtana käytetyn lihaksen surkastuminen sekä yliherkkyysreaktiot, kuten turvotus, pehmytkudoksen turvotus (edeema, myös kaukana injektiokohdasta), punoitus, kutina, ihottuma (paikallinen ja yleistynyt) ja hengästyneisyys.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös kaikkia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä ulkopakkauksessa tai injektiopullon etiketissä (EXP) mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Avaamaton injektiopullo: Säilytä alle 25 °C.
Käyttökuntoon saatettu liuos: Valmisteen on osoitettu olevan kemiallisesti ja fysikaalisesti stabiili 24 tuntia 2–8 °C:ssa.
Mikrobiologiset näkökohdat huomioiden valmiste tulee käyttää välittömästi. Jos sitä ei käytetä heti, säilytysajat ja ‑olosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä tavallisesti saa ylittää 24 tuntia 2−8 ºC:n lämpötilassa, ellei valmistetta ole saatettu käyttökuntoon kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Lääkäri ei saa antaa XEOMIN-injektiota, jos liuos on sameaa tai sisältää silmämääräisesti näkyviä hiukkasia.
Katso ohjeet valmisteen hävittämiseen tämän pakkausselosteen lopusta hoitoalan ammattilaisille tarkoitetusta kohdasta.
Pakkauksen sisältö ja muuta tietoa
Mitä XEOMIN sisältää
- Vaikuttava aine on Clostridium botulinum A-tyypin neurotoksiini (150 kD), joka ei sisällä kompleksoivia proteiineja.
XEOMIN 50 yksikköä injektiokuiva-aine, liuosta varten
Yksi injektiopullo sisältää 50 yksikköä Clostridium botulinum A-tyypin neurotoksiinia (150 kD), ilman kompleksoivia proteiineja*.
XEOMIN 100 yksikköä injektiokuiva-aine, liuosta varten
Yksi injektiopullo sisältää 100 yksikköä Clostridium botulinum A-tyypin neurotoksiinia (150 kD), ilman kompleksoivia proteiineja*.
XEOMIN 200 yksikköä injektiokuiva-aine, liuosta varten
Yksi injektiopullo sisältää 200 yksikköä Clostridium botulinum A-tyypin neurotoksiinia (150 kD), ilman kompleksoivia proteiineja*.
* Clostridium botulinum A-tyypin neurotoksiinia, puhdistettu Clostridium Botulinum ‑viljelmästä (Hallin kanta)
- Muut aineet ovat: ihmisen albumiini, sakkaroosi
XEOMIN-valmisteen kuvaus ja pakkauskoot
XEOMIN on injektiokuiva-aine, liuosta varten. Jauhe on valkoista.
Kuiva-aineen saattamisessa käyttökuntoon muodostuva liuos on kirkasta ja väritöntä.
XEOMIN 50 yksikköä injektiokuiva-aine, liuosta varten: Pakkauskoot ovat 1, 2, 3 tai 6 injektiopulloa.
XEOMIN 100 yksikköä injektiokuiva-aine, liuosta varten: Pakkauskoot ovat 1, 2, 3, 4 tai 6 injektiopulloa.
XEOMIN 200 yksikköä injektiokuiva-aine, liuosta varten: Pakkauskoot ovat 1, 2, 3, 4 tai 6 injektiopulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija ja valmistaja:
Merz Pharmaceuticals GmbH
Eckenheimer Landstraße 100
60318 Frankfurt/Main
PL 11 13 53
60048 Frankfurt/Main
Saksa
Puhelin: +49-69/15 03-1
Faksi: +49-69/15 03-200
Tällä lääkevalmisteella on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä:
XEOMIN: Itävalta, Bulgaria, Kypros, Kroatia, Tšekin tasavalta, Tanska, Viro, Saksa, Kreikka, Suomi, Ranska, Unkari, Islanti, Irlanti, Italia, Latvia, Liechtenstein, Liettua, Luxembourg, Malta, Alankomaat, Norja, Puola, Portugali, Romania, Slovakia, Slovenia, Espanja, Ruotsi
XEOMEEN: Belgia
Tämä pakkausseloste on tarkistettu viimeksi 9.2.2024
Ohjeet terveydenhuollon ammattilaiselle
Ohjeet injektioliuoksen käyttökuntoon saattamiseen:
XEOMIN saatetaan käyttökuntoon injektiota varten liuottamalla injektiokuiva-aine 9 mg/ml (0,9-prosenttiseen) natriumkloridi-injektioliuokseen.
XEOMIN-valmistetta saa käyttää vain sen hyväksyttyyn käyttötarkoitukseen yhdelle potilaalle yhdellä käyttökerralla.
Injektiopullon sisällön käyttökuntoon saattaminen ja ruiskun valmistelu on hyvä tehdä muovitettujen paperipyyhkeiden päällä kaikkien roiskeiden saamiseksi talteen. Vedä ruiskuun sopiva määrä natriumkloridiliuosta (ks. laimennustaulukkoa). Valmisteen käyttökuntoon saattamiseen suositellaan lyhyttä 20–27 G:n viistokärkistä neulaa. Työnnä neula kohtisuoraan kumitulpan läpi ja ruiskuta liuotin varovasti injektiopulloon, jotta vältät vaahdon muodostumisen. Hävitä injektiopullo, jos alipaine ei vedä liuotinta injektiopulloon. Irrota ruisku injektiopullosta ja sekoita XEOMIN liuottimeen pyörittelemällä ja kääntelemällä injektiopulloa, mutta älä ravista sitä voimakkaasti. Valmisteen käyttökuntoon saattamiseen käytetty neula pitää tarvittaessa jättää kiinni injektiopulloon, jotta tarvittava määrä liuosta voidaan vetää uuteen injektion antamiseen soveltuvaan steriiliin ruiskuun.
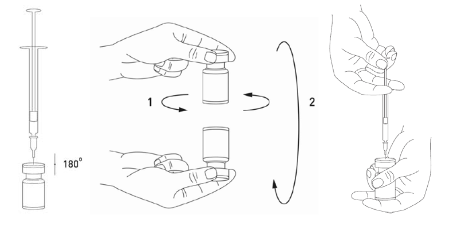
Käyttökuntoon saatettu XEOMIN on kirkas, väritön liuos.
XEOMIN-valmistetta ei saa käyttää, jos (edellä annettujen ohjeiden mukaisesti) käyttökuntoon saatettu liuos on sameaa tai sisältää haituvia tai hiukkasia.
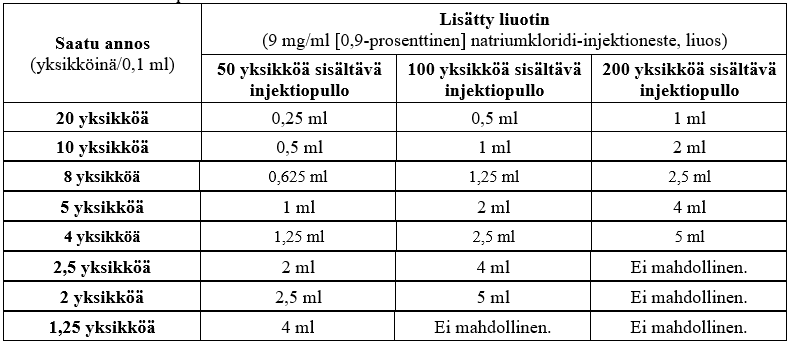
Tahattoman yliannoksen välttämiseksi ole huolellinen, että käytät valitsemaasi pakkauskokoon nähden oikean määrän liuotinta. Jos samassa toimenpiteessä injektion annossa käytetään erikokoisia XEOMIN-injektiopulloja, on oikea liuotinmäärä varmistettava huolellisesti saatettaessa käyttövalmiiksi tietty yksikkömäärä 0,1 ml:aa kohden. Käytettävä liuotinmäärä on erilainen, kun käytetään 50 yksikköä, 100 yksikköä ja 200 yksikköä sisältävää XEOMIN‑valmistetta. Jokainen ruisku on merkittävä vastaavasti.
Seuraavassa taulukossa on esitetty 50 yksikköä, 100 yksikköä ja 200 yksikköä sisältävän XEOMIN-valmisteen mahdolliset pitoisuudet:
Ohjeet valmisteen hävittämiseen
Injektioliuokset, joita on säilytetty yli 24 tuntia, ja käyttämätön injektioliuos on hävitettävä.
Injektiopullojen, ruiskujen ja käytettyjen materiaalien hävittäminen turvallisesti
Käyttämättömät injektiopullot sekä injektiopulloon ja/tai ruiskuun jäljelle jäävä liuos on autoklavoitava. Jäljelle jäänyt XEOMIN voidaan vaihtoehtoisesti inaktivoida lisäämällä siihen jotakin seuraavista liuoksista: etanoli (70 %), isopropanoli (50 %), SDS (0,1 %, anioninen detergentti), laimennettu natriumhydroksidiliuos (0,1 N NaOH) tai laimennettu natriumhypokloriittiliuos (vähintään 0,1 % NaOCl).
Käytettyjä injektiopulloja, ruiskuja ja muita materiaaleja ei saa tyhjentää inaktivoinnin jälkeen, vaan ne on laitettava asianmukaiseen astiaan ja hävitettävä paikallisten vaatimusten mukaisesti.
Suositukset mahdollisiin vaaratilanteisiin A-tyypin botuliinitoksiinin käsittelyssä
- Roiskeet on puhdistettava pyyhkimällä: tähän käytetään kuiva-ainetta siivottaessa jollakin edellä mainitulla liuoksella kyllästettyä imukykyistä pyyhettä, ja käyttövalmiiksi sekoitettua valmistetta siivottaessa kuivaa imukykyistä pyyhettä.
- Kontaminoituneet pinnat on puhdistettava jollakin edellä mainitulla liuoksella kyllästetyllä imukykyisellä pyyhkeellä, minkä jälkeen pinta kuivataan.
- Jos injektiopullo rikkoutuu, toimi edellä annettujen ohjeiden mukaisesti, kerää lasinsirut ja pyyhi valmiste pois varoen samalla, etteivät lasinsirut aiheuta viiltohaavoja.
- Jos valmistetta pääsee kosketuksiin ihon kanssa, huuhtele altistunut alue runsaalla vesimäärällä.
- Jos valmistetta pääsee silmiin, huuhtele silmät huolellisesti runsaalla vesimäärällä tai silmähuuhdeliuoksella.
- Jos valmistetta pääsee haavaan, viiltohaavaan tai rikkoutuneelle iholle, huuhtele altistunut alue huolellisesti runsaalla vesimäärällä ja ryhdy sen jälkeen asianmukaisiin hoitotoimenpiteisiin pistetyn annoksen mukaan.
Näitä valmisteen käytöstä, käsittelystä ja hävittämisestä annettuja ohjeita on noudatettava tarkasti.