Pakkausseloste
BEOVU injektionsvätska, lösning i förfylld spruta 120 mg/ml
Tilläggsinformation
Beovu 120 mg/ml injektionsvätska, lösning i förfylld spruta
brolucizumab
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du får detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Beovu är och vad det används för
2. Vad du behöver veta innan du får Beovu
3. Hur du får Beovu
4. Eventuella biverkningar
5. Hur Beovu ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Beovu är
Beovu innehåller den aktiva substansen brolucizumab, vilken tillhör en grupp läkemedel som kallas antineovaskulära medel. Beovu injiceras i ögat av din läkare för behandling av sjukdomar som kan påverka din syn.
Vad Beovu används för
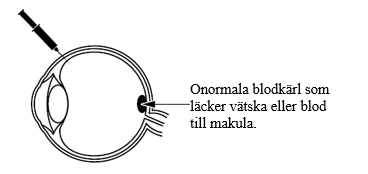
Beovu används hos vuxna för att behandla ögonsjukdomar som uppstår när onormala blodkärl bildas och växer under makula. Makula, som finns i ögats bakre del, gör att man kan se fina detaljer. De onormala blodkärlen kan läcka vätska eller blod in i ögat och kan störa makulafunktionen och ge sjukdomar som kan orsaka nedsatt syn såsom:
- våt åldersrelaterad makuladegeneration (våt AMD)
- diabetiska makulaödem (DME)
Hur Beovu verkar
Beovu kan göra så att sjukdomen utvecklas långsammare och kan därmed bibehålla, eller till och med förbättra, synen.
Vad du behöver veta innan produkten används
Du får inte behandlas med Beovu
- om du är allergisk mot brolucizumab eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har en infektion i eller runt ögat.
- om du har ont i ögat eller har rodnad i ögat (ögoninflammation).
Om något av detta gäller dig, ska du tala om det för din läkare. Du ska då inte få Beovu.
Varningar och försiktighet
Tala med läkare eller sjuksköterska innan du får Beovu, om något av följande stämmer in på dig:
- om du har glaukom (ett tillstånd som oftast orsakas av för högt tryck i ögat).
- om du tidigare har sett ljusblixtar eller grumling (mörka flytande fläckar) och om fläckarna plötsligt har blivit större och fler.
- om du har genomgått en ögonoperation under de senaste 4 veckorna eller ska göra det inom de kommande fyra veckorna.
- om du tidigare har haft ögonsjukdomar eller fått behandlingar för ögonen.
- om du tidigare har fått plötslig synförlust på grund av blockering av blodkärl i ögats bakre del (retinal vaskulär ocklusion) eller inflammation av blodkärl i ögats bakre del (näthinnevaskulit) under det senaste året.
Tala omedelbart om för läkaren om du:
- får rodnad i ögat, ökat obehag, förvärrad rodnad i ögat, dimsyn eller försämrad syn, ökat antal småpartiklar i synfältet eller ökad ljuskänslighet.
- utvecklar plötslig synförlust, vilket kan vara ett tecken på retinal vaskulär ocklusion.
Alla ovanstående symtom kan leda till att din läkare avbryter behandlingen med Beovu.
Dessutom är det viktigt för dig att veta att:
- säkerheten och effekten av Beovu, när det administreras till båda ögonen samtidigt, inte har studerats och att användning på detta sätt kan leda till en ökad risk för biverkningar.
- injektioner med Beovu kan orsaka en ökning av ögontrycket (intraokulärt tryck) hos vissa patienter inom 30 minuter efter injektionen. Din läkare kommer att övervaka detta efter varje injektion.
- din läkare kommer att kontrollera om du har andra riskfaktorer som kan öka risken för avlossning eller bristning i något av skikten i ögats bakre del (näthinnan eller näthinnepigmentepitelet). I sådana fall måste Beovu ges med försiktighet.
Den systemiska användningen av VEGF-hämmare, ämnen som liknar dem som finns i Beovu, är potentiellt kopplad till risk för blodproppar som blockerar blodkärlen (arteriella tromboemboliska händelser), vilket kan leda till hjärtattack eller stroke. Det finns en teoretisk risk för sådana händelser efter injektion av Beovu i ögat.
Barn och ungdomar
Beovu ges inte till barn och ungdomar under 18 år.
Andra läkemedel och Beovu
Tala om för läkaren om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du får detta läkemedel.
Amning rekommenderas inte under behandling med Beovu och i minst en månad efter att behandlingen med Beovu avslutats, eftersom det är okänt om Beovu utsöndras i bröstmjölk.
Kvinnor som kan bli gravida måste använda effektiva preventivmedel under behandling och under minst en månad efter att behandlingen med Beovu avslutats. Tala omedelbart om för läkaren om du blir gravid eller tror att du kan vara gravid under behandlingen. Beovu ska inte användas under graviditet såvida inte den förväntade nyttan överväger den potentiella risken för det ofödda barnet.
Körförmåga och användning av maskiner
Efter behandling med Beovu kan du tillfälligt få synproblem (till exempel se suddigt). Kör inte och använd inte maskiner så länge problemen finns kvar.
Beovu innehåller natrium
Läkemedlet innehåller mindre än 1 mmol (23 mg) natrium per dos, dvs. är näst intill ”natriumfritt”.
Beovu innehåller polysorbater
Läkemedlet innehåller 0,01 mg polysorbat 80 per dos (0,05 ml). Polysorbater kan orsaka allergiska reaktioner. Tala om för din läkare om du har några kända allergier.
Hur produkten används
Hur mycket Beovu ges och hur ofta
Den rekommenderade dosen är 6 mg brolucizumab.
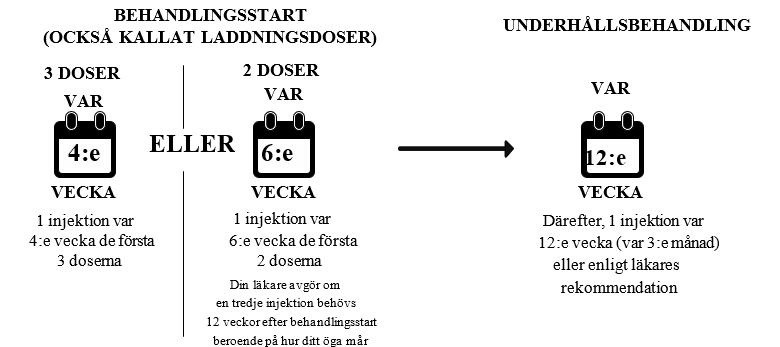
Våt AMD
Behandlingsstart (också kallat laddningsdoser)
- Du behandlas med en injektion varje månad under de första 3 månaderna.
- Alternativt kan du behandlas med en injektion var sjätte vecka de två första doserna. Din läkare kommer att avgöra om en tredje injektion behövs 12 veckor efter behandlingsstart baserat på hur ditt öga (dina ögon) mår.
Underhållsbehandling
- Därefter kan det hända att du får en injektion var 3:e månad. Din läkare avgör tiden mellan behandlingarna beroende på hur ditt öga mår. En del patienter behöver behandling varannan månad. Beroende på ditt ögas tillstånd kan din läkare förlänga eller förkorta ditt behandlingsintervall med högst 1 månad åt gången. Det finns begränsade data om behandlingsintervall längre än 5 månader. Behandlingsintervallet mellan två doser Beovu bör inte vara kortare än varannan månad.
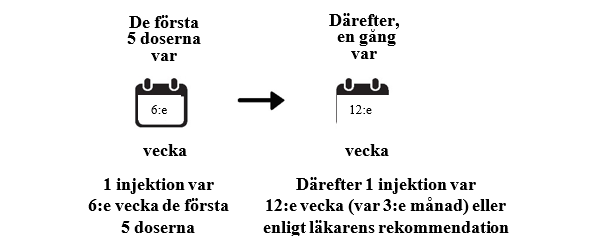
DME
- Du behandlas med en injektion var sjätte vecka de första fem injektionerna.
- Därefter kan det hända att du får en injektion var 3:e månad. Din läkare avgör tiden mellan behandlingarna beroende på hur ditt öga mår. En del patienter behöver behandling varannan månad. Vissa patienter kan få behandling var 4:e månad.
Administreringssätt
Beovu ges som en injektion i ögat (intravitrealt bruk) av en ögonläkare.
För att förhindra infektion rengör läkaren ögat noga före injektionen. Du får också ögondroppar (lokalbedövning) som bedövar ögat för att minska eller förhindra smärta från injektionen.
Hur länge varar behandlingen med Beovu
Beovu används för att behandla kroniska ögonsjukdomar vilket kräver långtidsbehandling under månader eller år. Din läkare kommer att kontrollera att behandlingen fungerar, när du kommer på dina bokade besök. Läkaren kan också kontrollera dina ögon mellan injektionerna. Tala med din läkare om du undrar hur länge du ska fortsätta att få Beovu.
Innan behandlingen med Beovu avbryts
Tala med din läkare innan du slutar med behandlingen. Om du slutar med behandlingen kan risken öka för att du ska förlora synen och din syn kan försämras.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem. Biverkningarna av injektion av Beovu kommer antingen från själva läkemedlet eller från injektionsproceduren och de påverkar främst ögat.
Vissa biverkningar kan vara allvarliga
Se till att få omedelbar vård om du får något av följande, som är tecken på allergiska reaktioner, inflammationer eller infektioner:
- En plötslig försämring eller förändring av synen.
- Smärta, ökat obehag, förvärrad rodnad i ögat.
Om du får några allvarliga biverkningar ska du meddela din läkare omedelbart.
Övriga möjliga biverkningar
Andra biverkningar som kan komma efter behandling med Beovu listas nedan.
De flesta av biverkningarna är milda till måttliga och försvinner i allmänhet inom en vecka efter varje injektion.
Om dessa biverkningar blir svåra ska du informera din läkare.
Vanliga: kan förekomma hos upp till 1 av 10 personer
- inflammation i ögats mellersta hinna (uveit)
- avlossning av den gelaktiga substansen inne i ögat (glaskroppsavlossning)
- bristning av näthinnan (delen i ögats bakre del som känner av ljus) eller i ett av dess skikt (ruptur av pigmentepitelet)
- försämrad syn (nedsatt synskärpa)
- blödning i näthinnan (retinalblödning)
- inflammation i iris, den färgade delen av ögat (irit)
- inflammation i iris och dess intilliggande vävnad i ögat (iridocyklit)
- plötslig förlust av synen på grund av blockering av blodkärl i ögats bakre del (retinal vaskulär ocklusion)
- blödning i ögat (blödning i glaskroppen)
- grumling av ögats lins (katarakt)
- blödning från små blodkärl i ögats yttre skikt (konjunktival blödning)
- prickar som rör sig i synfältet (grumlingar i glaskroppen)
- ögonvärk
- högre tryck inuti ögat (ökat intraokulärt tryck)
- rodnad av ögonvitan (konjunktivit)
- dimsyn eller dålig synskärpa
- skrapsår på hornhinnan, skada på det klara skiktet av ögongloben som täcker iris (kornealt skrapsår)
- skada på det klara skiktet av ögongloben som täcker iris (punktuell keratit)
- allergiska reaktioner (överkänslighet)
Mindre vanliga: kan förekomma hos upp till 1 av 100 personer
- svår inflammation inne i ögat (endoftalmit)
- blindhet
- plötslig förlust av synen på grund av blockering av en artär i ögat (ocklusion av retinalartär)
- avlossning av retina (näthinneavlossning)
- rodnad i ögat (konjunktival hyperemi)
- ökad tårproduktion
- onormal känsla i ögat
- avlossning av ett av skikten i retina (pigmentepitelavlossning)
- inflammation av den gelaktiga substansen inne i ögat (vitrit)
- inflammation i ögats främre del (inflammation eller ”flare” i främre kammaren)
- svullnad av hornhinnan, ögonglobens klara skikt (hornhinneödem)
- inflammation av blodkärl i ögats bakre del (näthinnevaskulit)
- inflammation i ögonvitan (sklerit)
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via
Webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 Fimea
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och etiketten efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C‑8 °C).
Får ej frysas.
Förvara den förfyllda sprutan i det förseglade blistret och i ytterkartongen. Ljuskänsligt.
Före användning kan det oöppnade blistret med den förfyllda sprutan förvaras vid rumstemperatur (under 25 °C) i upp till 24 timmar.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är brolucizumab. En ml lösning för injektion innehåller 120 mg brolucizumab. Varje förfylld spruta innehåller 19,8 mg brolucizumab i 0,165 ml lösning. Detta motsvarar en brukbar mängd tillräcklig för att administrera en enskild dos på 0,05 ml lösning innehållande 6 mg brolucizumab.
- Övriga innehållsämnen är natriumcitrat, sackaros, polysorbat 80, natriumhydroxid (för justering av pH) och vatten för injektionsvätskor (se avsnitt Vad du behöver veta innan produkten används).
Läkemedlets utseende och förpackningsstorlekar
Beovu 120 mg/ml injektionsvätska, lösning i förfylld spruta (injektion) är en klar till lätt opaliserande, färglös till lätt brungul vattenlösning.
Varje förpackning innehåller 1 förfylld injektionsspruta, endast avsedd för engångsbruk.
Innehavare av godkännande för försäljning
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4,
Irland
Tillverkare
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
Belgien
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
Denna bipacksedel ändrades senast 27.1.2026
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats: https://www.ema.europa.eu
Direktiv för experterna inom hälsovården
Bruksanvisning till förfylld spruta
Förvaring och inspektion
 | Förvara Beovu i kylskåp (2 °C‑8 °C). Får ej frysas. Förvara den förfyllda sprutan i det förseglade blistret och i ytterkartongen. Ljuskänsligt. |
 | Före användning kan det oöppnade blistret med den förfyllda sprutan med Beovu förvaras vid rumstemperatur (under 25 °C) i upp till 24 timmar. Kontrollera att förpackningen innehåller en steril förfylld spruta i ett förseglat blister. Efter att blistret har öppnats ska fortsatt hantering ske under aseptiska förhållanden. |
 | Beovu är en klar till opalskimrande, färglös till svagt brungul vattenlösning. |
 | Lösningen ska inspekteras visuellt när den tas ut ur kylskåpet och före administrering. Om partiklar eller grumlighet syns får den förfyllda sprutan inte användas och lämpliga åtgärder för byte av spruta ska vidtas. Den förfyllda sprutan är endast avsedd för engångsbruk. Används inte om förpackningen eller den förfyllda sprutan är skadade eller om utgångsdatum har passerats. |
Så här bereds och administreras Beovu
Den förfyllda sprutan innehåller mer än den rekommenderade dosen på 6 mg. Hela volymen i sprutan (0,165 ml) ska inte användas. Överskottet ska tryckas ut före injektionen. Om hela dosen i den förfyllda sprutan injiceras kan det innebära en överdosering.
Den intravitreala injektionsproceduren måste utföras under aseptiska förhållanden, vilket innefattar användning av kirurgisk handdesinfektion, sterila handskar, en steril duk och ett sterilt spekulum (eller motsvarande) liksom tillgång till utrustning för steril paracentes (vid behov).
Adekvat anestetikum och en lokal bredspektrummikrobicid till desinficering av huden runt ögat samt ögonlocket och ögats yta ska administreras före injektionen.
För intravitreal injektion, använd en 30G x ½ tum steril injektionskanyl. Injektionskanylen ingår inte i förpackningen med Beovu.
Var noga med att ge injektionen omedelbart efter beredning av dosen (steg 5).
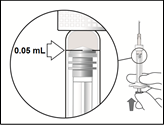
Observera: Dosen måste ställas in på 0,05 ml.
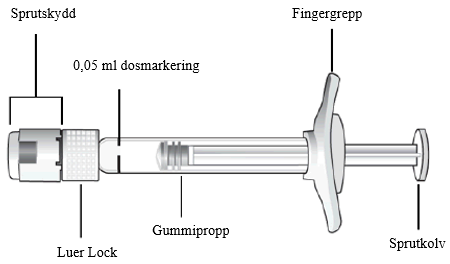
Injektionsprocedur
| 1. | Dra bort locket från blisterförpackningen och ta upp sprutan med aseptisk teknik. |
2.
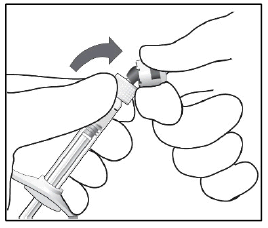
| Bryt av nålskyddet (vrid inte). |
| 3. | Sätt fast en 30G x ½ tums injektionskanyl ordentligt på sprutan under aseptiska förhållanden. |
4.
| För att ta bort luftbubblor från sprutan, håll sprutan med kanylen uppåt. Om det finns luftbubblor knackar du försiktigt på sprutan med fingret tills bubblorna stiger upp till ytan. Ta försiktigt bort nålskyddet från kanylen genom att dra det rakt utåt. |
5.
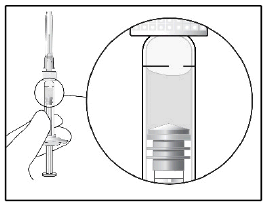
| Håll sprutan i ögonhöjd och tryck försiktigt in kolven tills kanten nedanför gummiproppens välvda del ligger i linje med dosmarkeringen. Luft och överflödig lösning trycks därmed ut och dosen sätts till 0,05 ml. Sprutan är nu klar för injektion. |
| 6. | Injicera långsamt tills gummiproppen når botten på sprutan så att 0,05 ml lösning avges. Säkerställ att hela dosen har administrerats genom att kontrollera att gummiproppen har nått änden av sprutcylindern. |
Observera: Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Vanliga frågor och svar
Fråga: Vad gör jag om jag inte får bort alla luftbubblor ur vätskan?
Svar: Det är viktigt att vätskan inte innehåller någon luft. Men de små luftbubblorna som sitter på proppen lossnar oftast inte från denna under injektionen och påverkar därför inte dosens volym.