Pakkausseloste
RYJUNEA silmätipat, liuos 0,1 mg/ml
Ryjunea 0,1 mg/ml silmätipat, liuos
atropiinisulfaatti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tai lapsesi aloittaa tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Ryjunea on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät Ryjunea-valmistetta
3. Miten Ryjunea-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. Ryjunea-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Ryjunea-silmätipat sisältävät vaikuttavana aineena atropiinisulfaattia.
Ryjunea-valmistetta käytetään likitaittoisuuden (likinäköisyyden) etenemisen hidastamiseen 3–14-vuotiailla lapsilla, joiden likitaittoisuus on -0,5 – -6 diopteria (silmän tarkennuskyvyn mittausarvo) ja likitaittoisuuden etenemisnopeus on vähintään 0,5 diopteria vuodessa Ryjunea-hoidon aloittamisen kohdalla.
Atropiinisulfaattisilmätippojen käytön etuna lapsille on paremman näön ylläpitäminen ja tulevien komplikaatioiden riskin vähentäminen.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Ryjunea-valmistetta
- jos olet allerginen atropiinisulfaatille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos olet allerginen nk. antikolinergeille (lääkeaineille, jotka estävät asetyylikoliini-nimisen hermoston välittäjäaineen toimintaa), kuten antihistamiineille, joillekin masennuslääkkeille, amantadiinille, kinidiinille, disopyramidille ja metoklopramidille.
- jos sinulla on avo- tai ahdaskulmaglaukooma (silmänsisäisen paineen aiheuttama silmän hermovaurio).
Varoitukset ja varotoimet
Sinulle tai lapsellesi voi tulla valonarkuutta (lisääntynyttä silmien herkkyyttä kirkkaalle valolle) tai akkomodaatiohäiriö (näön hämärtyminen silmien näön tarkentamisen vaikeuden takia) Ryjunea-valmistetta käytettäessä. Nämä vaikutukset voivat kestää jopa 14 päivän ajan. Jos silmät ovat herkempiä valolle, tällöin on suositeltavaa käyttää aurinkolaseja epämukavuuden vähentämiseksi.
Hoidon lopettaminen voi aiheuttaa likitaittoisuuden pahenemisen uudelleen (ks. kohta Miten valmistetta käytetään, Jos lopetat Ryjunea-valmisteen käytön). Kun tämän lääkkeen käyttö lopetetaan, silmätutkimuksia on jatkettava yhden vuoden ajan. Keskustele sinua tai lastasi hoitavan lääkärin kanssa, jos näkökyky heikkenee (uudelleen).
Tämän lääkkeen käyttö saattaa lisätä synekian (silmän värillisen osan (värikalvon) epänormaalin kiinnittymisen ympäröivään kudokseen) riskiä.
Ryjunea voi aiheuttaa näön hämärtymistä, joka voi vaikeuttaa näkemistä potilailla, joiden mykiö on samentunut (kaihi), tai joilla on amblyopia (toiminnallinen heikkonäköisyys) tai karsastus.
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät Ryjunea-valmistetta, jos seuraava koskee sinua tai lastasi:
- Sinulla on lapsuuden etenevä syndrominen likitaitteisuus, kuten silmänsisäisen paineen tavallisesti aiheuttama silmän hermovaurio (glaukooma), etenevä näön menetys (retinitis pigmentosa), päiväsokeus syntymästä asti (synnynnäinen hemeralopia) ja silmien hermosyiden sairaus (myeliinitupellisten hermosyiden aiheuttama oireyhtymä).
- Sinulla on sydänongelmia kuten takykardia (nopea sydämen syke), sydämen vajaatoiminta (sydän ei pumppaa verta niin kuin sen pitäisi), sepelvaltimon stenoosi (sydänlihakseen johtavien verisuonten ahtauma) tai hypertensio (korkea verenpaine). Äskettäisen sydänkohtauksen saaneilla potilailla voi ilmetä mahdollisesti hengenvaarallisia sydämen rytmin poikkeavuuksia tätä lääkettä käytettäessä.
- Sinulla voi olla mahdollisuus siihen, että kehon lämpötilan säätely häiriintyy hikoilun estymisestä, koska atropiinia on käytettävä varoen korkeissa lämpötiloissa ja kuumetta sairastaville potilaille korkean kehon lämpötilan riskin takia.
- Sinulla on spastinen halvaus (jalkojen lihassairaus)
- Sinulla on Downin oireyhtymä.
Lapset
Ryjunea-valmistetta ei suositella alle 3-vuotiaille lapsille, koska ei tiedetä, onko se turvallinen tai tehokas tässä ikäryhmässä.
Muut lääkevalmisteet ja Ryjunea
Ryjunea-valmisteella voi olla yhteisvaikutuksia muiden lääkkeiden kanssa. Ennen kuin käytät tai lapsesi käyttää Ryjunea-valmistetta, kerro lääkärille, lastasi hoitavalle lääkärille tai apteekkihenkilökunnalle, jos käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt. Kerro lääkärille erityisesti:
- jos käytät antikolinergisiä lääkkeitä, kuten antihistamiineja, fentiatsiinejä, trisyklisiä ja tetrasyklisiä masennuslääkkeitä, amantadiinia, kinidiiniä, disopyramidia, metoklopramidia
- jos käytät silmänpaineen alentamiseen lääkkeitä, jotka sisältävät karbakolia, pilokarpinia tai fysostigmiinia
- jos käytät sympatomimeettisia lääkkeitä, kuten dobutamiinia, dopamiinia, noradrenaliinia, adrenaliinia tai isoproterenolia
- jos käytät lihasheikkoutta estäviä lääkkeitä (lihasheikkouslääkevalmisteita, kuten pyridostigmiini ja neostigmiini), kaliumsitraattia tai kaliumravintolisiä)
- jos käytät aivojen tai selkäytimen (keskushermoston) toimintaa hidastavia lääkkeitä.
Jos et ole varma, koskevatko edellä olevat asia sinua tai lastasi, kysy asiasta lääkäriltä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Raskauden aikana, erityisesti viimeisten 3 kuukauden aikana, Ryjunea-valmistetta voidaan käyttää vain siinä tapauksessa, että lääkäri katsoo sen käytön olevan selvästi tarpeen.
Tämän lääkkeen käyttöä ei suositella imetyksen aikana, koska Ryjunea siirtyy äidinmaitoon.
Ajaminen ja koneiden käyttö
Ryjunea-valmisteella on kohtalainen vaikutus ajokykyyn, pyöräilykykyyn ja koneidenkäyttökykyyn, koska tämä lääke voi aiheuttaa näön poikkeavuutta tai hämärtymistä (ks. kohta Mahdolliset haittavaikutukset, Mahdolliset haittavaikutukset). Älä aja autolla, polkupyörällä tai skootterilla äläkä käytä koneita, ennen kuin näkösi on kirkastunut. Tämä vaikutus voi kestää enintään 14 päivää hoidon lopettamisen jälkeen.
Ryjunea sisältää bentsalkoniumkloridia
Tämä lääkevalmiste sisältää bentsalkoniumkloridia 0,1 mg per ml. Bentsalkoniumkloridi saattaa imeytyä pehmeisiin piilolinsseihin ja voi muuttaa niiden väriä. Poista piilolinssit ennen tämän lääkevalmisteen käyttöä ja laita piilolinssit takaisin 15 minuutin kuluttua.
Bentsalkoniumkloridi voi aiheuttaa silmä-ärsytystä erityisesti, jos sinulla on kuivat silmät tai sarveiskalvon sairauksia (silmän etuosan läpinäkyvä kerros). Jos silmääsi tulee poikkeavaa tunnetta, pistelyä tai kipua tämän lääkkeen käytön jälkeen, keskustele asiasta lääkärisi kanssa.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Suositeltu annos on yksi tippa Ryjunea 0,1 mg/ml -silmätippoja kumpaankin silmään päivässä. On suositeltavaa käyttää silmätippoja juuri ennen nukkumaanmenoaikaa, koska tämä voi auttaa vähentämään haittavaikutuksia kuten näön hämärtymistä tai epänormaalia silmien valoherkkyyttä (ks. kohta Mahdolliset haittavaikutukset, Mahdolliset haittavaikutukset). Lääkärisi kertoo sinulle tai lapsellesi, kuinka kauan tippoja on käytettävä.
Jos käytät muita silmätippoja, odota vähintään 15 minuuttia niiden käytön jälkeen ja käytä sitten Ryjunea-valmistetta. Jos käytät piilolinssejä, ne pitää poistaa ennen käyttöä (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä, Ryjunea sisältää bentsalkoniumkloridia). Jos käytät silmävoidetta, sitä tulee käyttää Ryjunea-silmätippojen käytön jälkeen. Näin Ryjunea pääsee paremmin silmään ja alkaa vaikuttamaan.
Käyttöohjeet
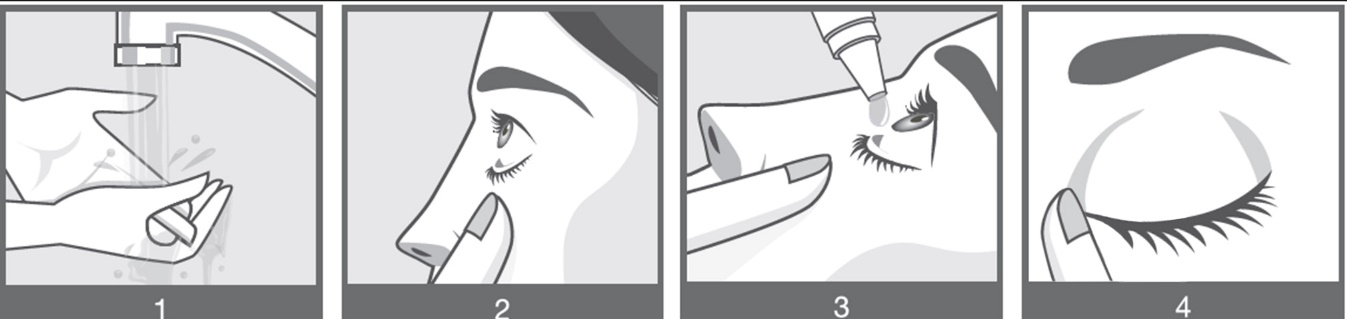
- Pese kätesi ennen aloittamista (kuva 1).
- Avaa pullo. Poista löysä muovirengas korkista, kun pullo avataan ensimmäisen kerran. Ole erityisen varovainen, että tiputinpullon kärki ei kosketa silmääsi, silmän ympärillä olevaa ihoa tai sormia.
- Älä käytä, jos peukalointia ilmaiseva rengas on rikkoutunut tai jos huomaat siinä selkeitä heikentymisen merkkejä.
- Kierrä pullon korkki irti ja aseta korkki puhtaalle pinnalle kyljelleen. Pidä pullosta kiinni ja varmista, että kärki ei kosketa mitään.
- Pidä pulloa alaspäin peukalon ja sormien välissä.
- Vedä alaluomea alaspäin puhtaalla sormella muodostaaksesi ”taskun” silmäluomen ja silmän välille (kuva 2). Tiputa tippa tähän taskuun.
- Kallista päätä taaksepäin.
- Vie tiputinkärki lähelle silmää. Tee tämä peilin edessä, jos se auttaa.
- Älä koske silmään, silmäluomeen, ympäröiviin kohtiin tai muihin pintoihin tiputinkärjellä. Se voi kontaminoida silmätippoja.
- Purista pulloa varovasti vapauttaaksesi yhden tipan Ryjuneaa silmääsi (kuva 3).
- Tiputa silmään vain yksi tippa. Jos tippa ei osu silmään, yritä uudelleen.
- Paina sormella silmän sisäkulmaa nenän vierestä. Paina 1 minuutin ajan ja pidä silmä suljettuna (kuva 4). Pieni tiehyt, josta kyyneleet poistuvat silmästä nenään, sijaitsee tässä kohtaa. Painamalla tätä kohtaa suljet tämän tyhjennystiehyeen aukon. Tämä auttaa estämään Ryjunea-valmisteen päätymisen muualle elimistöön.
- Sinun on käytettävä tippoja molempiin silmiin, toista vaiheet toisen silmäsi kohdalla, kun pullo on auki.
- Sulje pullo asettamalla pullon korkki takaisin paikoilleen.
Jos käytät enemmän Ryjunea-valmistetta kuin sinun pitäisi
Huuhtele silmäsi lämpimällä vedellä. Älä laita enempää tippoja, ennen kuin on seuraavan tavanomaisen annoksen aika..
Jos unohdat käyttää Ryjunea-valmistetta
Jos unohdat käyttää tätä lääkettä, jätä annos väliin ja käytä seuraava annos normaaliin aikaan. Älä ota kaksinkertaista annosta korvataksesi unohtamasi kerta-annoksen.
Jos lopetat Ryjunea-valmisteen käytön
Älä lopeta Ryjunea-valmisteen käyttöä keskustelematta ensin lääkärin tai lastasi hoitavan lääkärin kanssa. Tämän lääkkeen käytön lopettaminen voi johtaa likitaittoisuuden pahenemiseen (rebound). Lääkkeen käytön lopettamisen jälkeen on jatkettava silmätutkimuksia vuoden ajan. Keskustele lääkärisi tai lastasi hoitavan lääkärin kanssa, jos ilmenee näön heikkenemistä (rebound).
Jos sinulla on kysyttävää tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Ryjunea-valmisteen käytön yhteydessä on havaittu seuraavia haittavaikutuksia:
- Hyvin yleinen (voi esiintyä useammalla kuin yhdellä henkilöllä kymmenestä)
- epänormaali silmien valoherkkyys (fotofobia)
- epänormaali silmien valoherkkyys (fotofobia)
- Yleinen (voi esiintyä enintään yhdellä henkilöllä kymmenestä):
- näön hämärtyminen
- silmien ärsytys
- pupillien laajentuminen (mydriaasi)
- silmäkipu
- vierasesineen tunne silmissä
- päänsärky
- Melko harvinainen (voi esiintyä enintään yhdellä henkilöllä sadasta):
- näön tarkentamisen vaikeus (akkomodaatiohäiriö)
- tulehdustäplät sarveiskalvossa (punktaattikeratiitti)
- nystyt silmänvalkuaista ja silmäluomen sisäosaa reunustavalla limakalvolla (konjunktivaaliset papillat).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla):
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pullon etiketissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän ”EXP” jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Hävitä pullo 4 viikon kuluttua ensimmäisestä avaamisesta infektioiden estämiseksi ja käytä uutta pulloa.
Älä käytä tätä lääkettä, jos huomaat, että korkin ja kaulan ympärillä oleva muovirengas puuttuu tai on rikkoutunut ennen uuden pullon aloittamista.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Ryjunea sisältää
- Vaikuttava aine on atropiinisulfaatti. Yksi millilitra liuosta sisältää 0,1 mg atropiinisulfaattia.
- Muut aineet ovat bentsalkoniumkloridi (E330), sitruunahappo (E331), natriumsitraatti, natriumkloridi (E524), natriumhydroksidi/kloorivetyhappo (E507) (pH:n säätöön), deuteriumoksidi. Katso kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Ryjunea sisältää bentsalkoniumkloridia”.
Lääkevalmisteen kuvaus ja pakkauskoot
Ryjunea silmätipat, liuos (silmätipat) on kirkas, väritön neste moniannosmuovipullossa.
Jokainen pullo sisältää 2,5 ml lääkettä ja jokainen pakkaus sisältää 1 tai 3 pulloa, joissa on kierrekorkki.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
Santen Oy
Niittyhaankatu 20,
33720 Tampere, Suomi
Valmistaja
Santen Oy
Kelloportinkatu 1,
33100 Tampere, Suomi
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
| Suomi Santen Oy Puh: +358 (0) 974790211 |
Tämä pakkausseloste on tarkistettu viimeksi 06/2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu