Pakkausseloste
LUVERIS pulver och vätska till injektionsvätska, lösning 75 IU
Tilläggsinformation
Luveris 75 IE pulver och vätska till injektionsvätska, lösning
lutropin alfa
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Luveris är och vad det används för
2. Vad du behöver veta innan du använder Luveris
3. Hur du använder Luveris
4. Eventuella biverkningar
5. Hur Luveris ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Luveris är
Luveris är ett läkemedel som innehåller lutropin alfa, ett rekombinant luteiniserande hormon (LH), vilket är nästan identiskt med det hormon som finns naturligt i kroppen, men lutropin alfa tillverkas med hjälp av bioteknik. Det tillhör hormongruppen gonadotropiner, vilka är involverade i den normala regleringen av reproduktionen.
Vad Luveris används för
Luveris rekommenderas för behandling av vuxna kvinnor som har mycket låga nivåer av vissa hormoner involverade i den normala reproduktionscykeln. Läkemedlet används tillsammans med ett annat hormon som heter follikelstimulerande hormon (FSH) för att åstadkomma follikelutveckling. Det åtföljs av en enkel dos humant koriongonadotropin (hCG) vilket leder till frisättning av ägget från follikeln (ägglossning).
Vad du behöver veta innan produkten används
Använd inte Luveris
- om du är allergisk mot gonadotropiner (som t.ex. luteiniserande hormon, follikelstimulerande hormon eller humant koriongonadotropin) eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har äggstocks-, livmoder- eller bröstcancer.
- om du har haft hjärntumör.
- om du har förstorade äggstockar eller vätskeblåsor i ovarierna (cysta i äggstockarna) av okänt ursprung.
- om du har oförklarliga blödningar från slidan.
Använd inte Luveris om något av ovanstående gäller dig. Om du är osäker, rådfråga läkare eller apotekspersonal innan du börjar använda läkemedlet.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Luveris.
Du och din partners fertilitet bör utvärderas innan behandlingen påbörjas.
Användning av Luveris rekommenderas inte om du har något tillstånd som vanligen omöjliggör en normal graviditet, t.ex. att äggstockarna inte fungerar på grund av ett tillstånd som kallas primär ovarialsvikt eller missbildningar i könsorganen.
Porfyri
Om du eller någon i din familj har porfyri (en oförmåga att bryta ned porfyriner som kan ha överförts från föräldrar till barn) ska du tala om det för din läkare innan du påbörjar behandlingen.
Ovariellt överstimuleringssyndrom (OHSS)
Detta läkemedel stimulerar dina äggstockar. Detta ökar risken för utveckling av ett tillstånd som kallas ovariellt överstimuleringssyndrom eller OHSS. Vid ovariellt överstimuleringssyndrom utvecklas folliklarna för mycket och blir till stora cystor. Om du får ont i nedre delen av buken, börjar öka snabbt i vikt, mår illa eller kräks eller om du får svårt att andas, tala genast med din läkare som kanske kommer att be dig sluta använda detta läkemedel (se avsnitt Eventuella biverkningar under ”Allvarliga biverkningar”).
Om du inte har ägglossning och om du följer den rekommenderade dosen och administreringsschemat, är det mindre troligt att du råkar ut för OHSS. Behandling med Luveris ger sällan upphov till svårt OHSS. Detta blir mer sannolikt om det läkemedel som används för att inducera slutgiltig follikelmognad (som innehåller humant koriongonadotropin, hCG) administreras (se avsnitt Hur produkten används under ”Hur mycket du ska ta” för mer information). Om du skulle utveckla OHSS är det tänkbart att din läkare inte kommer att ge dig hCG under denna behandlingscykel och be dig att avstå från samlag eller att använda barriärpreventivmetoder under minst fyra dygn.
Din läkare kommer att se till att det ovariella svaret kontrolleras noggrant med hjälp av ultraljud och blodprov före och under behandlingen.
Flerbördsgraviditet
När du använder Luveris är det större risk att du blir gravid med fler än ett barn på samma gång (”flerbördsgraviditet”, oftast tvillingar) än vid naturlig befruktning. Flerbördsgraviditet kan leda till medicinska komplikationer för dig och de barn som du väntar. Du kan minska risken för flerbördsgraviditet genom att använda rätt dos av Luveris vid rätt tidpunkt. Vid assisterad reproduktionsteknologi är risken för flerbördsgraviditet relaterad till din ålder, kvaliteten på och antalet befruktningsdugliga ägg eller embryon som förts in i dig.
Missfall
Vid assisterad reproduktionsteknologi eller stimulering av äggstockarna för att producera ägg finns en missfallsrisk som ligger över genomsnittet.
Ektopisk graviditet
Kvinnor som har haft en äggledarsjukdom löper risk för ektopisk graviditet (graviditet där embryot fäster utanför livmodern), oberoende av om graviditeten uppkom genom spontan befruktning eller med fertilitetsbehandling.
Blodpropp (tromboembolism)
Tala med läkare innan du använder Luveris om du eller en familjemedlem någonsin har haft blodpropp i benet eller lungan, eller hjärtattack eller stroke. Du kan löpa större risk att få allvarliga blodproppar eller så kan existerande blodproppar förvärras vid behandling med Luveris.
Tumörer i könsorganen
Det har förekommit rapporter om tumörer i äggstockarna och andra könsorgan, både godartade och elakartade, hos kvinnor som har genomgått flera läkemedelsbehandlingar mot infertilitet.
Missbildningar
Missbildningar efter assisterad reproduktionsteknologi kan vara något högre än efter spontan befruktning. Det kan bero på olika faktorer hos föräldrarna, såsom moderns ålder, gener, samt assisterad reproduktionsteknologi procedurerna och flerbördsgraviditet.
Barn och ungdomar
Luveris ska inte användas av barn och ungdomar under 18 år.
Andra läkemedel och Luveris
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Använd inte Luveris blandat med andra läkemedel i samma injektion, med undantag för follitropin alfa, om läkaren ordinerat detta.
Graviditet och amning
Använd inte Luveris om du är gravid eller ammar.
Rådfråga läkare eller apotekspersonal innan du tar något läkemedel.
Körförmåga och användning av maskiner
Luveris har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Luveris innehåller natrium
Luveris innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Hur läkemedlet ska användas
Din läkare avgör vilken dos som är den mest lämpliga för dig och hur ofta du ska ta läkemedlet under behandlingen.
Hur mycket du ska ta
Luveris används vanligtvis varje dag i upp till tre veckor, samtidigt med injektioner av FSH.
- Vanlig startdos är 75 IE (1 injektionsflaska) Luveris tillsammans med 75 IE eller 150 IE FSH.
- Beroende på ditt svar kan din läkare öka dosen FSH i steg om 37,5–75 IE med 7 till 14 dagars mellanrum.
Din läkare kan förlänga din behandling upp till 5 veckor.
När önskat svar erhållits, ges en injektion av hCG 24 till 48 timmar efter de sista injektionerna av Luveris och FSH. Du rekommenderas att ha samlag på dagen för injektionen av hCG, och dagen efter. Alternativt kan intrauterin insemination eller någon annan medicinskt assisterad reproduktionsteknologi utföras baserat på läkarens bedömning.
Om svaret blir för kraftigt ska behandlingen avbrytas och hCG inte ges (se avsnitt Eventuella biverkningar under ”Ovariellt överstimuleringssyndrom). I nästa behandlingscykel kommer din läkare att föreskriva en lägre dos av FSH än vid den föregående behandlingen.
Administreringssätt
Luveris är avsett för subkutan användning d.v.s. att det ges som en injektion under huden. Injektionsflaskorna är endast avsedda för engångsbruk.
Om du ger dig själv Luveris, läs nedanstående instruktion noggrant:
- Tvätta händerna. Det är viktigt att händerna och de redskap du använder är så rena som möjligt.
- Samla allt du behöver, finn en ren yta och lägg ut allt:
- en injektionsflaska med Luveris
- en injektionsflaska med vätska
- två spritsuddar
- en spruta
- en nål för beredning, upplösning av pulvret i vätskan
- en fin nål för subkutan injektion
- en avfallsbehållare för glas och nålar
- Dra av den skyddande kapsylen från injektionsflaskan med vätska. Sätt beredningsnålen på sprutan, och dra upp lite luft i sprutan genom att dra tillbaka kolven ungefär till markeringen för 1 ml. Stick sedan ner nålen i injektionsflaskan och skjut in kolven för att avlägsna luften. Vänd injektionsflaskan med botten upp och dra försiktigt upp all vätska.
Lägg försiktigt ner sprutan på arbetsytan utan att vidröra nålen.
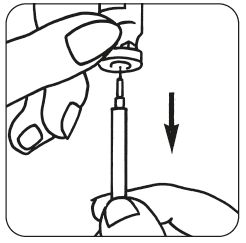
- Förbered injektionslösningen: Dra av den skyddande kapsylen från injektionsflaskan med Luveris pulver, ta upp sprutan och injicera vätskan långsamt ner i injektionsflaskan med Luveris. Rotera injektionsflaskan försiktigt utan att ta bort sprutan. Skaka inte.
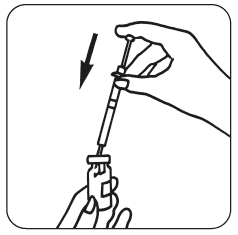
- När pulvret är upplöst (vilket vanligtvis sker omedelbart), kontrollera att lösningen är klar och inte innehåller några partiklar. Vänd injektionsflaskan upp och ner och dra försiktigt tillbaka lösningen in i sprutan.
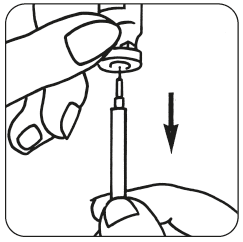
Du kan också blanda Luveris med follitropin alfa i stället för att injicera varje preparat separat. Efter att Luveris-pulvret har lösts upp, dra tillbaka lösningen in i sprutan och injicera den ner i behållaren med follitropin alfa-pulver. När pulvret är upplöst, drar tillbaka lösningen in i sprutan. Inspektera lösningen med avseende på partiklar på samma sätt som tidigare, använd inte lösningen om den inte är klar.
Upp till 3 behållare med pulver kan upplösas i 1 ml vätska.
- Byt till den fina nålen och avlägsna eventuella luftbubblor: Om du ser luftbubblor i sprutan, håll då sprutan med nålen pekande uppåt och knacka försiktigt på sprutan tills all luft samlas i toppen. Skjut upp kolven tills luftbubblorna har försvunnit.
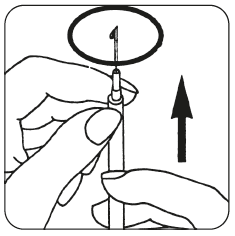
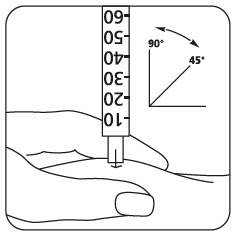
- Injicera lösningen genast: Din läkare eller sköterska har redan berättat för dig var du ska injicera (t.ex. magen, framsidan av låret). Tvätta det valda området med en spritsudd. Nyp ihop huden och stick in nålen i 45° till 90° vinkel med en rörelse som om du skulle kasta pil. Injicera under huden som du har lärt dig. Injicera inte direkt i en ven. Injicera lösningen genom att pressa försiktigt på kolven. Använd den tid du behöver för att injicera all lösning. Dra därefter ut nålen och tvätta huden med en cirkelrörelse med en spritsudd.
- Kassera alla använda saker: När du har avslutat injektionen, kassera omedelbart alla nålar och tomma glasbehållare i avfallsbehållaren som du har fått. Eventuell överflödig lösning måste kastas.
Om du använt för stor mängd av Luveris
Effekterna av en överdos av Luveris är okända men det är möjligt att ovariellt överstimuleringssyndrom kan inträffa (se avsnitt Eventuella biverkningar). Detta kan endast inträffa om hCG administrerats (se avsnitt Vad du behöver veta innan produkten används under ”Varningar och försiktighet”).
Om du har glömt att använda Luveris
Ta inte dubbel dos för att kompensera för glömd dos. Kontakta din läkare.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Allvarliga biverkningar
Kontakta genast läkare om du märker några av nedanstående biverkningar. Läkaren kan komma att be dig sluta använda Luveris.
Allergisk reaktion
Allergiska reaktioner, som hudutslag, hudrodnad, nässelutslag, ansiktssvullnad eller andningssvårigheter kan ibland bli allvarliga. Denna biverkning är mycket sällsynt (kan drabba uppemot 1 av 10 000 personer).
Ovariellt överstimuleringssyndrom (OHSS)
- Smärta i nedre delen av buken tillsammans med illamående eller kräkningar kan vara symtom på ovariellt överstimuleringssyndrom (OHSS). Dina äggstockar kan ha överreagerat på behandlingen och bildat stora vätskeblåsor eller cystor (se avsnitt Vad du behöver veta innan produkten används under ”Ovariellt överstimuleringssyndrom OHSS)"). Denna biverkning är vanlig (kan drabba uppemot 1 av 10 personer). Om detta inträffar måste läkaren undersöka dig så snart som möjligt.
- Allvarliga komplikationer med blodproppar (tromboembolism) vanligen tillsammans med svårt OHSS är mycket sällsynta. Det här kan orsaka bröstsmärtor, andnöd, stroke eller hjärtattack (se avsnitt Vad du behöver veta innan produkten används under ”Blodpropp”).
Andra vanliga biverkningar
- Huvudvärk
- Illamående, kräkningar, diarré, smärtor eller obehagskänslor i buken
- Vätskeblåsor på äggstockarna (cystor på äggstockarna), bröstsmärtor och bäckensmärtor
- Lokala reaktioner vid injektionsstället, såsom smärta, klåda, blåmärken, svullnad eller irritation.
Vridna äggstockar och blödning i bukhålan har inte rapporterats för Luveris, men det har i sällsynta fall rapporterats vid behandling med humant menopausgonadotropin (hMG), ett läkemedel extraherat ur urin, som också innehåller LH.
Ektopisk graviditet (utomkvedshavandeskap) kan uppkomma, speciellt hos kvinnor med tidigare sjukdom i äggledarna.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet:
www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
FI-00034 Fimea
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och injektionsflaskan efter Utg.dat. eller EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25 °C. Förvaras i originalförpackningen. Ljuskänsligt.
Använd inte detta läkemedel vid synliga tecken på försämring, såsom missfärgning av pulvret eller om behållaren är skadad.
Läkemedlet ska användas omedelbart efter upplösning av pulvret.
Den beredda lösningen ska inte injiceras om den innehåller partiklar eller inte är klar.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är lutropin alfa. En injektionsflaska med pulver innehåller 75 IE (Internationella Enheter).
- Lutropin alfa är ett rekombinant humant luteiniserande hormon (r‑hLH), producerat med rekombinant DNA-teknik.
- Övriga innehållsämnen i pulvret är polysorbat 20, sackaros, natriumdivätefosfatmonohydrat, dinatriumfosfatdihydrat, koncentrerad fosforsyra, natriumhydroxid, L-metionin och kväve.
- Vätskan är vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
- Luveris kommer som pulver och vätska till injektionsvätska, lösning.
- Varje injektionsflaska med pulver innehåller 75 IE lutropin alfa och varje flaska med vätska innehåller 1 ml vatten för injektionsvätskor.
- Luveris finns i förpackningar om 1, 3 eller 10 injektionsflaskor med pulver tillsammans med samma antal injektionsflaskor med vätska.
Innehavare av godkännande för försäljning
Merck Europe B.V.
Gustav Mahlerplein 102
1082 MA Amsterdam
Nederländerna
Tillverkare
Merck Serono S.p.A.
Via delle Magnolie 15
70026 Modugno (Bari)
Italien
Denna bipacksedel ändrades senast 06/2022
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.