Pakkausseloste
LUVERIS injektiokuiva-aine ja liuotin, liuosta varten 75 IU
Luveris 75 IU injektiokuiva-aine ja liuotin, liuosta varten
lutropiinialfa
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalletai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Luveris on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Luveris-valmistetta
- Miten Luveris-valmistetta käytetään
- Mahdolliset haittavaikutukset
- Luveris-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Luveris on
Luveris-lääkevalmiste sisältää lutropiinialfaa, rekombinanttia luteinisoivaa hormonia (LH), joka on hyvin samankaltainen ihmisessä luonnollisesti esiintyvän hormonin kanssa, mutta se on valmistettu bioteknologisesti. Se kuuluu hormoniperheeseen nimeltä gonadotropiinit, jotka osallistuvat lisääntymisen normaaliin säätelyyn.
Mihin Luveris-valmistetta käytetään
Luveris-valmistetta suositellaan käytettäväksi niiden aikuisten naisten hoitoon, joiden on osoitettu tuottavan hyvin vähäisiä määriä luonnolliseen lisääntymiskiertoon liittyviä hormoneja. Lääkettä käytetään yhdessä toisen, follikkelia stimuloivaksi hormoniksi (FSH) kutsutun hormonin kanssa munarakkuloiden, jotka ovat munasarjojen munasoluja kypsyttäviä osia, kehittymisen aikaansaamiseksi. Sen jälkeen hoitoa jatketaan antamalla yksi annos ihmisen istukkagonadotropiinia (hCG), joka johtaa munasolun vapautumiseen munarakkulasta (ovulaatioon).
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Luveris-valmistetta
- jos olet allerginen gonadotropiineille (kuten esimerkiksi luteinisoivalle hormonille, follikkelia stimuloivalle hormonille tai ihmisen istukkagonadotropiinille) tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on munasarja-, kohtu- tai rintasyöpä
- jos sinulla on todettu olevan aivokasvain
- jos sinulla on suurentuneet munasarjat tai jos munasarjoissasi on nestettä sisältävä rakkula (munasarjakysta), jonka syy on tuntematon
- jos sinulla on tuntemattomasta syystä johtuvaa verenvuotoa emättimestä.
Älä käytä Luveris-valmistetta, jos jokin edellä esitetyistä seikoista koskee sinua. Jos et ole varma, keskustele asiasta lääkärin tai apteekkihenkilökunnan kanssa ennen tämän lääkevalmisteen käyttämistä.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät Luveris-valmistetta.
Sinun ja kumppanisi hedelmällisyys on tutkittava ennen hoidon aloittamista.
Luveris-valmistetta ei suositella käytettäväksi, jos sinulla on jokin tila, jonka vuoksi normaali raskaus ei yleensä ole mahdollinen, esimerkiksi primääri munasarjojen toimintahäiriö tai sukuelinten epämuodostumia.
Porfyria
Kerro lääkärille ennen hoidon aloittamista, jos sinulla tai jollakin perheenjäsenelläsi on porfyria (elimistön kyvyttömyys pilkkoa porfyriineja; tämä sairaus voi periytyä vanhemmilta lapsille).
Munasarjojen hyperstimulaatio-oireyhtymä (OHSS)
Tämä lääkevalmiste stimuloi munasarjojasi. Tämä lisää munasarjojen hyperstimulaatio-oireyhtymän (OHSS) kehittymisen riskiä. Siinä munarakkulat kehittyvät liikaa, ja niistä tulee suuria kystia. Jos sinulla ilmenee vatsakipua, äkillistä painonnousua, pahoinvointia, oksentelua tai hengenahdistusta, ota välittömästi yhteyttä lääkäriin, joka saattaa kehottaa sinua keskeyttämään tämän lääkevalmisteen käytön (ks. kohta Mahdolliset haittavaikutukset, Vakavat haittavaikutukset).
Jos sinulla ei tapahdu ovulaatiota ja jos lääkevalmisteen annostelusuosituksia on noudatettu, OHSS:n esiintyminen on vähemmän todennäköistä. Luveris aiheuttaa harvoin vaikean OHSS:n. Tämä on todennäköisempää, jos munarakkulan lopullisen kypsymisen aikaansaamiseksi käytettävää lääkeainetta (sisältää ihmisen gonadotropiinia eli hCG:tä) annetaan (tarkemmat tiedot, ks. kohta Miten valmistetta käytetään, Paljonko lääkevalmistetta käytetään). Jos sinulle on kehittymässä OHSS, lääkäri voi päättää olla määräämättä sinulle hCG:tä tämän hoitojakson aikana, ja sinua voidaan kehottaa pidättäytymään yhdynnästä tai käyttämään mekaanista ehkäisymenetelmää vähintään neljän päivän ajan.
Lääkäri varmistaa, että munasarjavastetta seurataan huolellisesti ultraäänitutkimuksin ja verikokein ennen hoidon aloittamista ja sen aikana.
Monisikiöraskaus
Käyttäessäsi Luveris-valmistetta sinulla on suurempi monisikiöraskauden (useimmiten kaksoset) riski kuin luonnollisesti alkaneessa raskaudessa. Monisikiöraskaudesta voi aiheutua komplikaatioita sinulle ja vauvoillesi. Voit pienentää monisikiöraskauden riskiä käyttämällä Luveris-valmistetta oikeina annoksina oikeaan aikaan. Avusteisten lisääntymismenetelmien yhteydessä monisikiöraskauden riski liittyy ikääsi sekä hedelmöityneiden munasolujen tai kohtuun siirrettyjen alkioiden laatuun ja lukumäärään.
Keskenmeno
Avusteisten lisääntymismenetelmien tai munasolujen kypsyttämiseen tähtäävän munasarjojen stimulaatiohoidon yhteydessä keskenmenon riski on suurempi kuin naisilla keskimäärin.
Kohdunulkoinen raskaus
Naisilla, joilla on ollut munajohdinsairaus, on olemassa kohdunulkoisen raskauden (raskaus, jossa sikiö on kiinnittynyt kohdun ulkopuolelle) riski riippumatta siitä, onko raskaus alkanut spontaanilla hedelmöitymisellä vai hedelmällisyyshoidolla.
Veren hyytymisestä aiheutuvat ongelmat (tromboemboliset tapahtumat)
Keskustele lääkärin kanssa ennen kuin käytät Luveris-valmistetta, jos sinulla tai sukulaisellasi on joskus ollut laskimotukos sääressä tai keuhkoissa, sydänkohtaus tai halvaus. Sinulla saattaa olla suurentunut vakavien laskimotukosten riski tai olemassa olevat ongelmat voivat pahentua Luveris-hoidon aikana.
Sukuelinten kasvaimet
Naisilla, joita on hoidettu lääkkeillä useita hoitojaksoja hedelmättömyyden vuoksi, on raportoitu sekä hyvän- että pahanlaatuisia kasvaimia munasarjoissa ja muissa sukuelimissä.
Synnynnäiset epämuodostumat
Avusteisten lisääntymismenetelmien käytössä synnynnäisten epämuodostumien todennäköisyys saattaa olla hieman suurempi kuin spontaanin hedelmöittymisen jälkeen. Se saattaa johtua eroista vanhempien ominaisuuksissa, kuten äidin ikä, perinnölliset tekijät, sekä hedelmällisyyshoitotoimenpiteistä ja monisikiöraskaudesta.
Lapset ja nuoret
Luveris-valmistetta ei saa antaa lapsille ja alle 18-vuotiaille nuorille.
Muut lääkevalmisteet ja Luveris
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Älä käytä Luveris-valmistetta seoksena muiden lääkkeiden kanssa samassa injektiossa, lukuun ottamatta follitropiinialfaa, jos lääkäri on sitä määrännyt.
Raskaus ja imetys
Älä käytä Luveris-valmistetta, jos olet raskaana tai imetät.
Kysy lääkäriltä tai apteekista neuvoa ennen minkään lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
Luveris-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Luveris sisältää natriumia
Luveris sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Tämän lääkevalmisteen käyttö
Lääkäri päättää, mikä annos ja hoitoaikataulu on sinulle sopivin tätä hoitojaksoa varten.
Paljonko lääkevalmistetta käytetään
Luveris-valmistetta käytetään yleensä päivittäin korkeintaan kolmen viikon ajan samaan aikaan FSH-pistosten kanssa.
- Tavanomainen aloitusannos on 75 IU (yksi injektiopullo) Luveris-valmistetta yhdessä 75 IU tai 150 IU FSH:n kanssa.
- Hoitovasteesi mukaan lääkäri voi nostaa FSH:n annosta mieluiten 37,5–75 IU:n verran 7–14 päivän välein.
Lääkäri voi päättää, että hoitoa jatketaan aina viiteen viikkoon saakka.
Kun toivottu vaste on saavutettu, annetaan yksi pistos hCG:tä 24–48 tuntia viimeisten Luveris- ja FSH-pistosten jälkeen. On suositeltavaa olla yhdynnässä hCG-pistoksen antamispäivänä ja sitä seuraavana päivänä. Vaihtoehtoisesti sinulle voidaan tehdä kohdunsisäinen keinohedelmöitys tai käyttää jotakin muuta lääketieteellisesti avustettua lisääntymismenetelmää lääkärin arvion perusteella.
Jos vaste on liiallinen, hoito lopetetaan ja hCG:tä ei saa antaa (ks. kohta Mahdolliset haittavaikutukset, Munasarjojen hyperstimulaatio-oireyhtymä). Seuraavaa hoitojaksoa varten lääkäri määrää pienemmän FSH-annoksen kuin edellisessä hoitojaksossa.
Antotapa
Luveris on tarkoitettu ihonalaiseen käyttöön, eli se annetaan pistoksella ihon alle. Kukin injektiopullo on käytettävä yhdellä pistoskerralla.
Jos annat Luveris-pistoksen itse, lue seuraavat ohjeet huolellisesti:
- Pese kädet. On tärkeää, että kätesi ja käytettävät välineet ovat mahdollisimman puhtaat.
- Ota kaikki tarvittavat välineet esille. Aseta välineet puhtaalle alustalle:
- yksi Luveris-injektiopullo,
- yksi liuotinta sisältävä injektiopullo,
- kaksi desinfiointiaineella kostutettua lappua,
- yksi ruisku,
- yksi injektioliuoksen valmistusneula kuiva-aineen liuottamiseen oheisella liuottimella,
- ohut neula ihonalaisen pistoksen antoa varten,
- terävien esineiden keräysastia lasiastioiden ja neulojen turvallista hävittämistä varten.
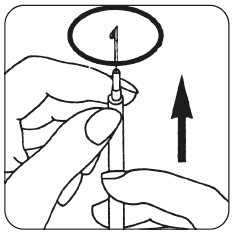
- Poista liuotinta sisältävän injektiopullon suojakorkki. Kiinnitä ruiskuun injektioliuoksen valmistusneula ja vedä ruiskuun hieman ilmaa vetämällä mäntää suunnilleen 1 ml:n merkkiin saakka. Työnnä sen jälkeen neula injektiopulloon, työnnä mäntää siten, että ilma poistuu ruiskusta, käännä injektiopullo ylösalaisin ja vedä kaikki liuotin varovasti ruiskuun.
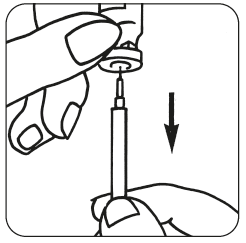
Aseta ruisku varovasti alustalle varoen koskemasta neulaan.
- Valmista injektioneste: Poista suojakorkki Luveris-kuiva-aineen injektiopullosta, ota ruisku ja ruiskuta liuotin hitaasti Luveris- injektiopulloon. Pyörittele pulloa hellävaraisesti ruiskua poistamatta. Älä ravista.
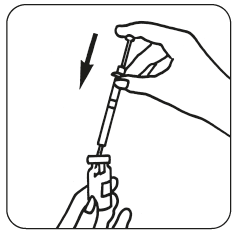
- Kun kuiva-aine on liuennut (tapahtuu yleensä välittömästi), tarkista, että muodostunut liuos on kirkas ja että se ei sisällä hiukkasia. Käännä injektiopullo ylösalaisin ja vedä liuos varovasti takaisin ruiskuun.
Voit myös sekoittaa Luveris-valmisteen follitropiinialfan kanssa vaihtoehtona valmisteiden pistämiselle erikseen. Kun Luveris-kuiva-aine on liuennut, vedä liuos takaisin ruiskuun ja ruiskuta se sen jälkeen follitropiinialfa-kuiva-aineen säilytysastiaan. Kun kuiva-aine on liuennut, vedä liuos takaisin ruiskuun. Tarkista liuos hiukkasten varalta kuten aiemmin, ja älä käytä liuosta jos se ei ole kirkas.
Korkeintaan kolme kuiva-ainetta sisältävää säilytysastiaa voidaan liuottaa yhteen millilitraan liuotinta.
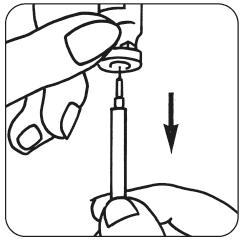
- Vaihda ruiskuun ohut neula ja poista mahdolliset ilmakuplat: Jos ruiskussa näkyy ilmakuplia, pidä ruiskua neula ylöspäin suunnattuna ja naputa ruiskua kevyesti, kunnes kaikki ilma on kertynyt ruiskun yläosaan. Työnnä varovasti ruiskun mäntää kunnes ilmakuplat ovat poistuneet.
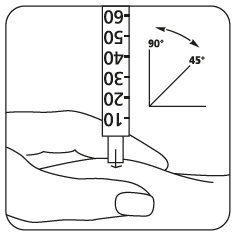
- Anna pistos välittömästi: Lääkäri tai sairaanhoitaja on jo neuvonut sinulle pistoskohdat (esim. vatsa tai reiden etuosa). Puhdista pistoskohta ihon desinfiointiaineella. Ota varma ote ihopoimusta ja työnnä neula 45–90 asteen kulmassa nopealla liikkeellä ihoon. Ruiskuta liuos ihon alle siten kuin sinulle on neuvottu. Älä ruiskuta liuosta verisuoneen. Ruiskuta liuos painamalla mäntää kevyesti. Ruiskuta koko annos kaikessa rauhassa. Vedä sen jälkeen neula heti pois ja puhdista iho desinfiointiaineeseen kastetulla lapulla pyörivin liikkein.
- Hävitä kaikki käytetyt välineet: Kun olet antanut pistoksen pane heti kaikki neulat ja tyhjät lasiset säilytysastiat saamaasi terävien esineiden keräysastiaan. Myös mahdollinen käyttämätön valmis lääkeliuos on hävitettävä.
Jos käytät enemmän Luveris-valmistetta kuin sinun pitäisi
Luveris-valmisteen yliannostuksen vaikutuksia ei tunneta, mutta siitä voi kuitenkin seurata munasarjojen hyperstimulaatio-oireyhtymä (ks. kohta Mahdolliset haittavaikutukset). Näin käy kuitenkin vain, mikäli hCG:tä annetaan (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä, Varoitukset ja varotoimet).
Jos unohdat käyttää Luveris-valmistetta
Älä ota kaksinkertaista annosta korvataksesi unohtamasi kerta-annoksen. Ota yhteyttä lääkäriin.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Vakavat haittavaikutukset
Ota heti yhteys lääkäriin, jos huomaat jonkin alla luetelluista haittavaikutuksista. Lääkäri saattaa pyytää sinua lopettamaan Luveris-valmisteen käytön.
Allerginen reaktio
Allergiset reaktiot, kuten ihottuma, ihon punoitus, nokkosihottuma sekä kasvojen turvotus, johon liittyy hengenahdistusta, voivat joskus olla vakavia. Tämä haittavaikutus on hyvin harvinainen (saattaa esiintyä alle 1 henkilöllä 10 000:sta).
Munasarjojen hyperstimulaatio-oireyhtymä (OHSS)
- Alavatsakipu, johon liittyy pahoinvointia tai oksentelua, voi olla munasarjojen hyperstimulaatio- oireyhtymän (OHSS) oire. Munasarjasi ovat mahdollisesti ylireagoineet hoitoon ja muodostaneet suuria nestettä sisältäviä rakkuloita eli kystia (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä, Munasarjojen hyperstimulaatio-oireyhtymä (OHSS)). Tämä haittavaikutus on yleinen (saattaa esiintyä alle 1 henkilöllä 10 :sta). Jos tämä haittavaikutus ilmenee, lääkärin on tutkittava sinut mahdollisimman pian.
Vakavia veren hyytymiseen liittyviä komplikaatioita (tromboembolisia tapahtumia), joihin yleensä liittyy vaikea OHSS, tavataan hyvin harvoin. Ne voivat aiheuttaa esimerkiksi rintakipua, hengenahdistusta, halvauksen tai sydänkohtauksen (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä, Veren hyytymisestä aiheutuvat ongelmat).
Muita yleisiä haittavaikutuksia
- Päänsärky
- Pahoinvointi, oksentelu, ripuli, epämukava tunne vatsan alueella tai vatsakipu
- Nestettä sisältävät rakkulat munasarjoissa (munasarjakystat), rintakipu ja lantiokipu
- Paikalliset reaktiot pistospaikassa, esimerkiksi kipu, kutina, mustelma, turvotus tai ärsytys.
Munasarjojen kiertymää ja verenvuotoa vatsan alueella ei ole raportoitu Luveris-valmisteen käytön yhteydessä, mutta tällaisia harvinaisia tapauksia on kuitenkin raportoitu ihmisen menopausaalisella gonadotropiinilla (hMG:llä) annetun hoidon jälkeen; se on myös LH:ta sisältävä virtsaperäinen lääkevalmiste.
Kohdunulkoinen raskaus (alkio kiinnittyy kohdun ulkopuolelle) on mahdollinen varsinkin naisilla, joilla on ollut munanjohtimen sairaus.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla).
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä kotelossa ja injektiopulloissa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä alle 25 °C.Säilytä alkuperäispakkauksessa. Herkkä valolle.
Älä käytä tätä lääkettä, jos huomaat näkyviä muutoksia lääkevalmisteen ulkonäössä, kuten kuiva-aineen värjäytymistä, tai mikäli säilytysastia on vaurioitunut.
Lääke tulisi antaa välittömästi kuiva-aineen liuottamisen jälkeen.
Liuosta ei tule käyttää, jos siinä on hiukkasia tai se ei ole kirkas.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Luveris sisältää
- Vaikuttava aine on lutropiinialfa. Yksi injektiokuiva-ainepullo sisältää 75 IU (International Units – kansainvälinen yksikkö, KY).
- Lutropiinialfa on rekombinantti ihmisen luteinisoiva hormoni (r-hLH), joka on valmistettu yhdistelmä-DNA-tekniikalla.
- Muut kuiva-aineen sisältämät aineet ovat polysorbaatti 20, sakkaroosi, natriumdivetyfosfaattimonohydraatti, dinatriumfosfaattidihydraatti, väkevä fosforihappo, natriumhydroksidi, L-metioniini ja typpi.
- Liuotin on injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
- Luveris toimitetaan injektiokuiva-aineena ja liuottimena, liuosta varten.
- Jokainen injektiokuiva-ainepullo sisältää 75 IU lutropiinialfaa ja jokainen liuotinta sisältävä injektiopullo sisältää 1 ml injektionesteisiin käytettävää vettä.
- Luveris toimitetaan 1, 3 tai 10 kuiva-aine-injektiopulloa sisältävissä pakkauksissa, yhdessä saman liuotinta sisältävän injektiopullomäärän kanssa.
Myyntiluvan haltija
Merck Europe B.V.
Gustav Mahlerplein 102
1082 MA Amsterdam
Alankomaat
Valmistaja
Merck Serono S.p.A.
Via delle Magnolie 15
70026 Modugno (Bari)
Italia
Tämä pakkausseloste on tarkistettu viimeksi 06/2022
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu.