Pakkausseloste
FIBRYGA pulver och vätska till injektions-/infusionsvätska, lösning 1 g
Tilläggsinformation
FIBRYGA, 1 g pulver och vätska till injektions-/infusionsvätska, lösning
Humant fibrinogen
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad FIBRYGA är och vad det används för
- Vad du behöver veta innan du använder FIBRYGA
- Hur du använder FIBRYGA
- Eventuella biverkningar
- Hur FIBRYGA ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad FIBRYGA är
FIBRYGA innehåller humant fibrinogen som är ett protein som är viktigt för att blodet ska levra sig (koagulering). Brist på fibrinogen innebär att blodet inte levrar sig så bra som det borde, vilket leder till en ökad blödningsbenägenhet. När man ersätter humant fibrinogen med FIBRYGA korrigeras koaguleringsdefekten.
Vad FIBRYGA används för
FIBRYGA används för:
- att behandla blödningsepisoder och profylax för operation hos patienter med medfödd fibrinogenbrist (hypo- eller afibrinogenemi) med blödningsbenägenhet.
- fibrinogensupplementering hos patienter med okontrollerad svår blödning i samband med förvärvad fibrinogenbrist under operation.
Vad du behöver veta innan produkten används
Använd INTE FIBRYGA:
- om du är allergisk mot humant fibrinogen eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du tidigare har haft allergiska reaktioner mot FIBRYGA.
Informera läkare om du är allergisk mot något läkemedel.
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder FIBRYGA.
Risk för blodproppar
Din läkare ska utvärdera fördelarna med detta läkemedel mot risken för blodproppar, särskilt om:
- du har fått en hög dos eller upprepad dos av detta läkemedel
- du har haft en hjärtattack (bakgrund med kranskärlssjukdom eller hjärtinfarkt)
- du har en leversjukdom
- du nyligen har genomgått en operation (postoperativa patienter)
- du ska genomgå en operation (preoperativa patienter)
- hos nyfödda barn (neonatala)
- det är sannolikt att du kommer att drabbas av blodproppar eller koaguleringsproblem i blodkärl (patienter som löper risk för tromboemboliska händelser eller disseminerad intravaskulär koagulering).
Läkaren kan be dig att genomgå ytterligare koaguleringstester för att övervaka risken.
Allergiska reaktioner eller reaktioner av anafylaktisk typ
Alla läkemedel, såsom FIBRYGA, som framställs från humant blod (som innehåller proteiner) och som injiceras i en ven (intravenöst administrerade) kan orsaka allergiska reaktioner. Om du tidigare har haft allergiska reaktioner mot FIBRYGA kommer läkaren att råda dig om huruvida allergimedicin behövs.
Läkaren kommer att informera dig om vilka varningstecknen för allergiska eller anafylaktiska reaktioner är.
Var uppmärksam på tidiga tecken på allergiska reaktioner (överkänslighet) såsom:
- nässelfeber
- hudutslag
- tryck över bröstet
- flåsande
- lågt blodtryck,
- eller anafylaktisk reaktion (när något av eller alla ovanstående symptom utvecklas snabbt och är intensiva).
Om de inträffar ska injektion/infusion av FIBRYGA omedelbart stoppas (dvs. avbryt injektionen).
Virussäkerhet
När läkemedel framställs från humant blod eller human plasma vidtas vissa åtgärder för att förhindra att infektioner överförs till patienter. Dessa omfattar:
- noggrant urval av blod- och plasmagivare för att säkerställa att personer med risk för att vara smittbärare utesluts.
- test av enskilda donationer och plasmapooler för tecken på virus/infektioner.
- inkludering av steg i hantering av blod eller plasma som kan inaktivera eller elminera virus.
Trots dessa åtgärder kan risken för överföring av infektion inte helt uteslutas när läkemedel som framställts från humant blod eller human plasma administreras. Detta gäller även nya, hittills okända virus eller andra typer av infektioner.
De åtgärder som vidtas anses effektiva för höljeförsedda virus, såsom humant immunbristvirus (HIV), hepatit B-virus och hepatit C-virus samt för icke-höljeförsett hepatit A-virus. Vidtagna åtgärder kan vara av begränsat värde mot icke-höljeförsedda virus såsom parvovirus B19.
Infektion av parvovirus B19 kan vara allvarligt för gravida kvinnor (infektion av ofött barn) och för personer med nedsatt immunförsvar eller som har vissa typer av anemi (t.ex. sicklecellsanemi eller onormal nedbrytning av röda blodkroppar).
Det rekommenderas starkt att man antecknar produktnamn och satsnummer varje gång man får FIBRYGA för att upprätthålla ett register på vilka satser som används.
Din läkare kan rekommendera att du överväger att vaccineras mot hepatit A och B om du regelbundet/upprepade gånger får fibrinogenprodukter från human plasma.
Barn och ungdomar
Det finns inga särskilda eller ytterligare varningar eller försiktighetsåtgärder för barn och ungdomar.
Andra läkemedel och FIBRYGA
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
FIBRYGA får inte blandas med andra läkemedel förutom de som nämns i avsnittet “Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal/Rekonstitution”.
Graviditet, amning and fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel. Denna produkt ska endast användas under graviditet eller amning på läkares eller apotekspersonals inrådan.
Körförmåga och användning av maskiner
FIBRYGA har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
FIBRYGA innehåller natrium
Detta läkemedel innehåller upp till 132 mg natrium (en annan ingrediens i koksalt/bordsalt) per flaska. Detta motsvarar 6,6 % av högsta rekommenderat daglig dos av natrium för vuxna. Ta hänsyn till detta om du äter en natriumreducerad kost.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
FIBRYGA ges som en intravenös infusion (infusion i en ven) av sjukvårdspersonal.
Dos och doseringsregim beror på:
- din vikt
- sjukdomens svårighetsgrad
- var blödningen uppstått eller
- typen av operation och
- ditt hälsotillstånd.
Användning för barn och ungdomar
Användning av FIBRYGA hos barn och ungdomar (intravenöst) skiljer sig inte från användning hos vuxna.
Om du använt för stor mängd av FIBRYGA
För att undvika risken för överdosering kommer din läkare att ta regelbundna blodprov för att mäta ditt fibrinogenvärde.
Vid överdosering kan risken för onormal blodproppsbildning öka.
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Administreringssätt
Detta läkemedel ska injiceras eller infuseras i vener efter beredning med den medföljande vätskan. Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Kontakta omedelbart läkare:
- om någon av biverkningarna inträffar.
- om du observerar någon biverkning som inte nämns i denna information.
Följande biverkningar har rapporterats för FIBRYGA och andra fibrinogenkoncentrat (frekvensen av de angivna biverkningarna är okänd):
- Allergiska reaktioner eller reaktioner av anafylaktisk typ: hudreaktioner såsom hudutslag eller rodnad i huden (se avsnitt Vad du behöver veta innan produkten används ”Varningar och försiktighet”)
- Kardiovaskulära: inflammation i vener och bildning av blodproppar (se avsnitt Vad du behöver veta innan produkten används ”Varningar och försiktighet”)
- ökad kroppstemperatur.
Om du upplever något av ovanstående symptom, kontakta läkare så fort som möjligt.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på etiketten och kartongen. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25 °C. Får ej frysas. Förvara flaskan i ytterkartongen. Ljuskänsligt.
Pulvret bör endast lösas upp precis före injektion/infusion. Stabiliteten hos den beredda lösningen har visats i 24 timmar vid rumstemperatur (max 25 °C). För att förhindra kontaminering bör lösningen dock användas omedelbart och endast vid ett tillfälle. Den rekonstituerade lösningen får inte förvaras i kylskåp eller frys.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är humant fibrinogen.
- FIBRYGA innehåller 1 g humant fibrinogen per flaska eller 20 mg/ml humant fibrinogen efter beredning med den medföljande vätskan (50 ml vatten för injektionvätskor).
- Övriga innehållsämnen är L-argininhydroklorid, glycin, natriumklorid och natriumcitratdihydrat.
Läkemedlets utseende och förpackningsstorlekar
FIBRYGA levereras som pulver och vätska till injektions-/infusionsvätska, lösning och finns tillgänglig i glasflaskor.
Pulvret är vitt eller blekgult och fuktabsorberande, även framstående som en söndersmulad massa.
Vätskan är klar och färglös.
Den beredda lösningen är nästan färglös och lätt opaliserande.
FIBRYGA säljs i en förpackning som innehåller:
- 1 flaska med pulver till injektions-/infusionsvätska, lösning
- 1 injektionsflaska med vätska (vatten för injektionsvätskor)
- 1 nextaro överföringsset.
Innehavare av godkännande för försäljning
Octapharma AB
112 75 Stockholm
Sverige
Tillverkare
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235, 1100 Wien, Österrike
Octapharma AB
112 75 Stockholm, Sverige
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet och i Förenade kungariket (Nordirland) under namnen:
Fibryga®: Österrike, Belgien, Bulgarien, Kroatien, Cypern, Tjeckien, Danmark, Estland, Finland, Frankrike, Tyskland, Ungern, Island, Irland, Italien, Lettland, Litauen, Luxemburg, Malta, Norge, Polen, Portugal, Rumänien, Slovakien, Spanien, Sverige, Nederländerna, Förenade kungariket (Nordirland).
Fibrema®: Slovenien
Denna bipacksedel ändrades senast 17.11.2023.
Direktiv för experterna inom hälsovården
Dosering
Substitutionsbehandlingens dosering och duration beror på sjukdomens svårighetsgrad, blödningens placering och omfattning, samt patientens kliniska tillstånd.
För att kunna beräkna individuell dos bör man fastställa funktionell fibrinogennivå, och mängd och administreringsfrekvens bör fastställas utifrån varje enskild patient genom regelbundna mätningar av fibrinogenvärde i plasma och kontinuerlig övervakning av patientens kliniska tillstånd, samt utifrån andra ersättningsbehandlingar som använts.
Vid större kirurgiska ingrepp är det mycket viktigt att man noggrannt övervakar ersättningssbehandlingen via koagulationsanalyser.
1. Profylax hos patienter med medfödd hypo- eller afibrinogenemi och känd blödningsbenägenhet.
För att förebygga kraftiga blödningar under kirurgiska ingrepp rekommenderas profylaktisk behandling som höjer fibrinogenvärdet till 1 g/l och att detta fibrinogenvärde upprätthålls tills hemostas är under kontroll och över 0,5 g/l tills såret är helt läkt.
Vid kirurgiskt ingrepp eller vid behandling av en blödning ska dosen beräknas enligt följande:
Dos (mg/kg kroppsvikt) = [Målvärde (g/l) - uppmätt värde (g/l)]
0,018 (g/l per mg/kg kroppsvikt)
Efterföljande dosering (doser och injektionsfrekvens) ska anpassas efter patientens kliniska tillstånd samt laboratorieresultat.
Den biologiska halveringstiden för fibrinogen är 3–4 dagar. Om fibrinogen inte förbrukas krävs därför oftast inte någon upprepad behandling med humant fibrinogen. Med hänsyn till den ackumulering som sker vid upprepad administrering för profylaktisk användning ska dosen och frekvensen fastställas enligt läkarens behandlingsmål för en specifik patient.
Pediatrisk population
Vid kirurgiskt ingrepp eller vid behandling av en blödningsepisod ska dosen hos ungdomar beräknas enligt formeln som beskrivs för vuxna ovan, medan dosen till barn under 12 år ska beräknas enligt följande:
Dos (mg/kg kroppsvikt) = [Målvärde (g/l) - uppmätt värde (g/l)]
0,014 (g/l per mg/kg kroppsvikt)
Efterföljande dosering ska anpassas efter patientens kliniska tillstånd samt laboratorieresultat.
Äldre patienter
Kliniska studier av FIBRYGA inkluderade inte patienter i åldern 65 år och äldre för att ge avgörande bevis om huruvida de uppvisar en annorlunda respons än yngre patienter.
2. Behandling av blödningar
Blödning hos patienter med medfödd hypo- eller afibrinogenemi
Blödningsepisoder ska behandlas enligt formeln ovan för vuxna/ungdomar och barn, för att uppnå ett rekommenderat målvärde för fibrinogen i plasma på 1 g/l. Detta värde ska upprätthållas tills hemostasen är under kontroll.
Blödning hos patienter med fibrinogenbrist
Vuxna
Generellt administreras till en början 1-2 g med påföljande infusioner vid behov. I fall av svår blödning, t.ex. vid omfattande kirurgi, kan en större mängd (4-8 g) fibrinogen krävas.
Pediatriska population
Doseringen bör fastställas utifrån kroppsvikt och kliniska behov men är vanligen 20-30 mg/kg.
Instruktioner för beredning och administrering
Allmänna instruktioner
- Den färdigberedda lösningen ska vara nästan färglös och lätt opaliserande. Använd inte lösningar som är grumliga eller som innehåller partiklar.
- FIBRYGA är endast avsett för engångsbruk. Återanvänd inte någon av komponenterna.
- Med tanke på den mikrobiologiska säkerheten ska lösningen administreras omedelbart efter beredning. Kemisk och fysikalisk stabilitet av den färdigberedda lösningen har visats i 24 timmar vid rumstemperatur (max. 25 °C). Färdigberedd FIBRYGA-lösning ska inte kylas eller frysas.
Beredning
| 1. Kontrollera att flaskan med pulver (FIBRYGA) och injektionsflaskan med spädningsvätska håller rumstemperatur. Samma temperatur ska bibehållas under beredningen. Om ett vattenbad används för att värma läkemedlet, är det viktigt att se till att vatten inte kommer i kontakt med behållarnas gummiproppar eller lock. Vattenbadets temperatur ska inte överstiga 37 °C. | ||
| 2. Ta av locket från flaskan med pulver (FIBRYGA) och locket från flaskan med spädningsvätska så att infusionsproppens centrala del exponeras. Rengör gummipropparna med en alkoholservett och låt gummipropparna torka. | ||
| 3. Öppna förpackningen med överföringssetet (nextaro) genom att dra av locket (fig. 1). Bevara sterilteten genom att låta den genomskinliga blisterförpackningen sitta kvar över överföringssetet. Vidrör inte spetsen. | 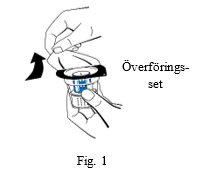 | |
4. Placera injektionsflaskan med spädningsvätska på en slät, ren yta och håll den i ett stadigt grepp. Låt blisterförpackningen sitta kvar över överföringssetet och placera överföringssetets blå del ovanpå injektionsflaskan med spädningsvätska. Tryck stadigt rakt ned tills överföringssetet snäpper på plats (fig. 2). Vrid inte när du fäster.
Obs! | 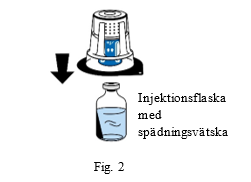
| |
| 5. Håll kvar greppet om injektionsflaskan med spädningsvätska och ta varsamt bort blisterförpackningen från överföringssetet (nextaro) genom att dra det rakt upp. Låt överföringssetet sitta kvar stadigt ansluten till injektionsflaskan med spädningsvätska (fig. 3). | 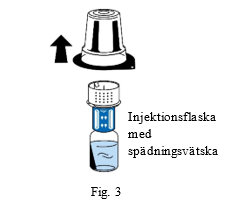
| |
| 6. Placera flaskan med pulver (FIBRYGA) på en slät, ren yta och håll den i ett stadigt grepp. Fatta injektionsflaskan med spädningsvätska med överföringssetet anslutet och vänd upp och ned. Placera kopplingen på överföringssetets vita del ovanpå flaskan med pulver (FIBRYGA). Tryck, utan att vrida, stadigt ned tills överföringssetet snäpper på plats (fig. 4). Spädningsvätskan rinner nu automatiskt ner i flaskan med pulver (FIBRYGA). | 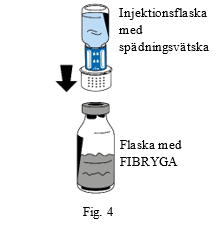 | |
| 7. Låt injektionsflaskan med spädningsvätska sitta kvar och snurra varsamt flaskan med FIBRYGA tills pulvret har lösts upp helt. Skaka inte flaskan eftersom detta kan orsaka skumbildning. Pulvret bör lösas upp helt inom cirka 5 minuter. Det ska inte ta längre än 20 minuter att lösa upp pulvret. Om pulvret inte har lösts upp inom 20 minuter ska produkten inte användas. | ||
| 8. I det sällsynta fall att oupplöst pulver ses flyta under överföringen av spädningsvätskan, eller om det tar oväntat lång tid att lösa upp pulvret, kan upplösningen påskyndas genom att injektionsflaskan roteras kraftigare horisontellt. | ||
| 9. Efter avslutad beredning ska överföringssetets blå del skruvas av moturs från den vita delen (fig. 5). Vidrör inte luerlock-kopplingen på överföringssetets vita del |
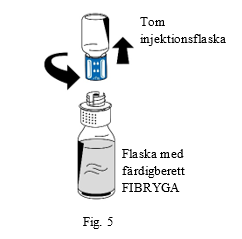 | |
| 10. Kasta den tomma injektionsflaskan tillsammans med överföringssetets blå del. | ||
Administrering
| 1. Anslut varsamt en spruta till luerlock-kopplingen på överföringssetets vita del (fig. 6) | 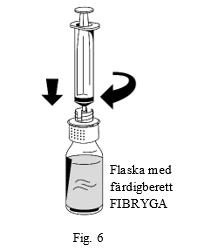 |
| 2. Vänd flaskan med FIBRYGA upp och ned och dra upp lösningen i sprutan (fig. 7). | 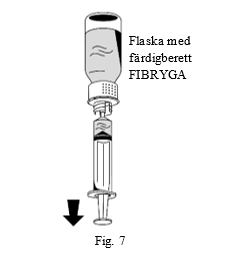 |
| 3. Håll sprutan med ett fast grepp om cylindern (med sprutans kolv pekande nedåt) och dra ut sprutan från överföringssetet när lösningen har överförts (fig. 8). | 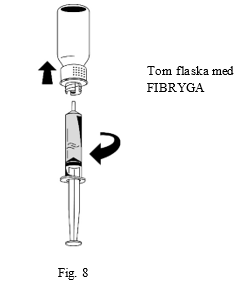 |
| 4. Kasta överföringssetets vita del tillsammans med den tomma FIBRYGA-flaskan. |
En standardinfusionssats rekommenderas för intravenös applicering av den rekonstituerade lösningen vid rumstemperatur.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Administreringssätt
Intravenös infusion eller injektion.
FIBRYGA ska administreras genom långsam intravenös infusion vid en rekommenderad maxhastighet på 5 ml per minut för patienter med medfödd hypo- eller afibrinogenemi och med en rekommenderad maxhastighet på 10 ml per minut för patienter med förvärvad fibrinogenbrist.
Inkompatibiliteter
Detta läkemedel får inte blandas med andra läkemedel.