Pakkausseloste
FIBRYGA injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 1 g
FIBRYGA, 1 g injektio- / infuusiokuiva-aine ja liuotin, liuosta varten
Ihmisen fibrinogeeni
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä FIBRYGA on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät FIBRYGA-valmistetta
- Miten FIBRYGA-valmistetta käytetään
- Mahdolliset haittavaikutukset
- FIBRYGA-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä FIBRYGA on
FIBRYGA sisältää ihmisen fibrinogeeniä, joka on veren hyytymiselle (koagulaatiolle) tärkeä proteiini. Fibrinogeenin puute merkitsee, että veri ei hyydy niin hyvin kuin sen pitäisi, mikä johtaa lisääntyneeseen verenvuototaipumukseen. Ihmisen fibrinogeenin korvaaminen FIBRYGA-valmisteella korjaa hyytymisvajeen.
Mihin FIBRYGA-valmistetta käytetään
FIBRYGA-valmistetta käytetään:
- verenvuototilanteiden hoidossa ja leikkauksen ennaltaehkäisyssä synnynnäistä fibrinogeenin puutetta (hypofibrinogenemiaa tai afibrinogenemiaa) sairastaville potilaille, joilla on verenvuototaipumus.
- fibrinogeenitäydennys potilaille, joilla on hallitsematon vakava verenvuoto, johon liittyy hankittu fibrinogeeninin puutos, leikkauksen aikana.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
ÄLÄ käytä FIBRYGA-valmistetta:
- jos olet allerginen ihmisen fibrinogeenille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos olet aiemmin saanut allergisia reaktioita FIBRYGA-valmisteesta.
Kerro lääkärille, jos olet allerginen jollekin lääkkeelle.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät FIBRYGA-valmistetta.
Verisuoniin muodostuvien hyytymien riski
Lääkärin on arvioitava tämän lääkkeen hyödyt verisuoniin muodostuvien hyytymien riskiä vasten, erityisesti:
- jos olet saanut suuren annoksen tai toistuvia annoksia tätä lääkettä
- jos sinulla on ollut sydänkohtaus (aiempi sepelvaltimotauti tai sydäninfarkti)
- sinulla on maksasairaus
- olet juuri ollut leikkauksessa (post-operatiiviset potilaat)
- olet menossa leikkaukseen (perioperatiiviset potilaat)
- vastasyntyneillä lapsilla
- saat mahdollisesti hyytymiä tai hyytymisongelmia verisuoniin (potilaat, joilla on tromboembolisten tapahtumien tai fibriininhukkaoireyhtymän riski).
Lääkäri voi pyytää sinua osallistumaan hyytymistä koskeviin lisätesteihin seuratakseen riskiä.
Allergiset tai anafylaksin kaltaiset reaktiot
Mikä tahansa lääke, myös FIBRYGA, joka on valmistettu ihmisverestä (sisältäen proteiineja) ja joka injektoidaan laskimoon (annetaan laskimoon) voi aiheuttaa allergisia reaktioita. Jos olet aiemmin saanut allergisia reaktioita FIBRYGA-valmisteesta, lääkäri kertoo, onko tarpeen käyttää allergialääkitystä.
Lääkäri selittää sinulle allergisen tai anafylaksin kaltaisia reaktioita koskevat varoitusmerkit.
Kiinnitä huomiota allergisten reaktioiden (yliherkkyyden) varhaisiin merkkeihin, kuten:
- nokkosihottuma
- ihottuma
- puristava tunne rinnassa
- vinkuva hengitys
- matala verenpaine
- tai anafylaksia (kun mikä tahansa tai kaikki yllä mainituista oireista kehittyy nopeasti ja on voimakas).
Jos näitä esiintyy, FIBRYGA-injektio/-infuusio on keskeytettävä välittömästi (ts. lopeta injektio).
Virusturvallisuus
Kun lääkkeitä valmistetaan ihmisen verestä tai plasmasta, otetaan käyttöön tiettyjä varotoimenpiteitä, joilla pyritään välttämään infektioiden siirtyminen potilaisiin. Näihin lukeutuvat:
- veren ja plasman luovuttajien huolellinen valinta sen varmistamiseksi, että luovuttajat, joilla on korkea infektioriski, suljetaan pois.
- jokaisen luovutuserän ja plasmapoolin testaaminen virusten/infektioiden varalta.
- työvaiheet veren tai plasman käsittelyssä, joilla pystytään inaktivoimaan tai poistamaan virukset.
Näistä varotoimenpiteistä huolimatta ihmisen verestä tai plasmasta valmistettuja lääkkeitä annettaessa ei taudinaiheuttajien siirtymisen mahdollisuutta voida kokonaan sulkea pois. Tämä koskee myös tuntemattomia tai uusia viruksia tai muun tyyppisiä infektioita.
Varotoimenpiteiden katsotaan olevan tehokkaita sellaisia viruksia vastaan, joilla on vaippa, esimerkiksi HI-virus sekä B- ja C-hepatiittivirus, ja vaipatonta A-hepatiittivirusta vastaan. Käytössä olevien varotoimenpiteiden hyöty vaipattomia viruksia, kuten parvovirus B19:ää, vastaan voi olla rajallista.
Parvovirus B19 -infektio voi olla vakava raskaana olevilla naisilla (syntymättömän lapsen infektio) ja ihmisillä, joiden immuunijärjestelmä on heikentynyt tai joilla on jonkin tyyppinen anemia (esim. sirppisolusairaus tai punasolujen epänormaalia rikkoutumista).
On erittäin suositeltavaa, että aina kun saat FIBRYGA-annoksen, valmisteen nimi ja eränumero kirjataan, jotta tieto käytetyistä tuote-eristä säilyy.
Lääkäri saattaa suositella, että harkitset A- ja B-hepatiittirokotuksen ottamista, jos saat säännöllisesti/toistuvasti ihmisen plasmasta peräisin olevia fibrinogeenituotteita.
Lapset ja nuoret
Erityisiä lasten ja nuorten kohdalla noudatettavia varoituksia ja varotoimenpiteitä ei ole.
Muut lääkevalmisteet ja FIBRYGA
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
FIBRYGA -valmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka on mainittu kohdassa ”Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille / Käyttökuntoon saattaminen”.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä. Tätä tuotetta saa käyttää raskauden tai imetyksen aikana vain, jos asiasta on keskusteltu lääkärin tai apteekkihenkilökunnan kanssa.
Ajaminen ja koneiden käyttö
FIBRYGA-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
FIBRYGA-valmiste sisältää natriumia
Tämä lääke sisältää enintään 132 mg natriumia (ruokasuolan toinen aineosa) kussakin pullossa. Tämä vastaa 6,6 prosenttia natriumin suositeltavasta päivittäisestä enimmäisvuorokausiannoksesta aikuiselle. Ota tämä huomioon, jos natriuminsaantiasi on rajoitettu.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Terveydenhuollon henkilökunta antaa FIBRYGA-valmisteen laskimoon infuusiona.
Annos ja hoito-ohjelma riippuvat:
- painostasi
- sairautesi vakavuudesta
- vuotokohdasta tai
- toimenpiteen luonteesta ja
- terveydentilastasi.
Käyttö lapsille ja nuorille
FIBRYGA-valmisteen annostelu lapsille ja nuorille (laskimoon) ei eroa annostelusta aikuisille.
Jos otat enemmän FIBRYGA-valmistetta kuin sinun pitäisi
Yliannostuksen välttämiseksi lääkäri mittaa fibrinogeenin pitoisuutta säännöllisesti.
Yliannostustapauksessa epänormaalien, verisuoniin muodostuvien hyytymien riski voi kohota.
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (p. 0800 147 111) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Antotapa
Tämä lääke annetaan injektiona tai infuusiona laskimoon, kun se on ensin saatettu käyttökuntoon pakkauksessa olevalla liuottimella. Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Ota välittömästi yhteys lääkäriin:
- jos havaitset haittavaikutuksia.
- jos havaitset haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa.
FIBRYGA-valmisteella ja muilla fibrinogeenituotteilla on raportoitu seuraavia haittavaikutuksia (lueteltujen haittavaikutusten esiintymistiheys on tuntematon):
- Allergiset tai anafylaksin kaltaiset ihoreaktiot kuten ihottuma tai ihon punoitus (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Varoitukset ja varotoimet”)
- Sydämeen ja verisuoniin liittyvät: laskimotulehdus ja verihyytymien muodostuminen (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Varoitukset ja varotoimet”)
- ruumiinlämmön nousu.
Jos havaitset jonkin yllä mainituista oireista, ota mahdollisimman nopeasti yhteyttä lääkäriin.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä etiketissä ja kotelossa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä alle 25 °C. Ei saa jäätyä. Säilytä pullo ulkopakkauksessa. Herkkä valolle.
Jauheen saa liuottaa vain juuri ennen injektiota/infuusiota. Käyttökuntoon saatetun liuoksen stabiilisuus on osoitetusti 24 tuntia huoneenlämmössä (enintään 25 °C). Kontaminaation välttämiseksi liuos on kuitenkin käytettävä välittömästi ja yhdellä kertaa. Käyttökuntoon saatettua tuotetta ei saa pakastaa tai säilyttää jääkaapissa.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä FIBRYGA sisältää
- Vaikuttava aine on ihmisen fibrinogeeni.
- FIBRYGA sisältää 1 g ihmisen fibrinogeeniä pulloa kohti tai 20 mg/ml ihmisen fibrinogeeniä, kun se on saatettu käyttökuntoon pakkauksessa olevalla liuottimella (50 ml injektionesteisiin käytettävää vettä).
- Muut aineosat ovat L-arginiinihydrokloridi, glysiini, natriumkloridi ja natriumsitraattidihydraatti.
Lääkevalmisteen kuvaus ja pakkauskoot
FIBRYGA on injektio- / infuusiokuiva-aine ja liuotin liuosta varten ja saatavilla lasipulloissa.
Jauhe on valkoinen tai vaaleankeltainen ja hygroskooppinen, se voi myös näyttää hauraalta kiinteältä massalta.
Liuotin on kirkas ja väritön neste.
Käyttökuntoon saatettu liuos on lähes väritön ja hieman opaalinhohtoinen.
FIBRYGA myydään yhdessä kotelossa, joka sisältää:
- 1 pullo injektio- / infuusiokuiva-ainetta liuosta varten
- 1 injektiopullo liuotinta (injektionesteisiin käytettävää vettä)
- 1 nextaro-siirtolaite
Myyntiluvan haltija
Octapharma AB
112 75 Tukholma
Ruotsi
Valmistajat
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235, 1100 Wien, Itävalta
Octapharma AB
112 75 Tukholma, Ruotsi
Tällä lääkevalmisteella on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa ja Yhdistyneessä kuningaskunnassa (Pohjois-Irlannissa) seuraavilla kauppanimillä:
Fibryga®: Itävalta, Belgia, Bulgaria, Kroatia, Kypros, Tshekki, Tanska, Viro, Suomi, Ranska, Saksa, Unkari, Islanti, Irlanti, Italia, Latvia, Liettua, Luxemburg, Malta, Norja, Puola, Portugali, Romania, Slovakia, Espanja, Ruotsi, Alankomaat, Yhdistynyt kuningaskunta (Pohjois-Irlanti).
Fibrema®: Slovenia
Tämä pakkausseloste on tarkistettu viimeksi 17.11.2023.
Ohjeet terveydenhuollon ammattilaiselle
Annostus
Korvaushoidon annostus ja kesto riippuvat häiriön vakavuudesta, verenvuodon sijainnista ja määrästä ja potilaan kliinisestä tilasta.
(Toiminnallinen) fibrinogeenipitoisuus on määritettävä yksilöllisen annoksen laskemiseksi, ja annosmäärä ja -väli on määritettävä yksilöllisesti mittaamalla säännöllisesti plasman fibrinogeenipitoisuutta ja seuraamalla jatkuvasti potilaan kliinistä tilaa ja muuta käytettyä korvaushoitoa.
Suuren leikkaustoimenpiteen yhteydessä korvaushoidon täsmällinen seuranta hyytymiskokeilla on oleellista.
1. Synnynnäistä hypofibrinogenemiaa tai afibrinogenemiaa sairastavien ja vuoto-oireisten potilaiden verenvuodon profylaksia.
Profylaktinen hoito liiallisen verenvuodon estämiseksi kirurgisten toimenpiteiden aikana on suositeltavaa, jotta fibrinogeenipitoisuus saadaan nostettua 1 g:aan/l ja pidettyä tällä tasolla, kunnes hemostaasi on turvattu, ja yli 0,5 g/l, kunnes haavan paraneminen on täydellistä.
Leikkaustoimenpiteen tai verenvuototilanteen hoidon yhteydessä annos on laskettava seuraavalla tavalla:
Annos (mg/kg kehon painoa) = [kohdepitoisuus (g/l) - mitattu pitoisuus (g/l)]
0,018 (g/l mg/kg kehon painoa kohti)
Tätä seuraava annostus (annokset ja injektioväli) on sovitettava potilaan kliinisen tilan ja laboratoriotulosten perusteella.
Fibrinogeenin biologinen puoliintumisaika on 3‑4 päivää. Näin ollen jos kulutusta ei ole, toistuva hoito ihmisen fibrinogeenillä ei yleensä ole tarpeen. Ehkäisevässä käytössä toistuvassa annostelussa tapahtuva kertyminen huomioon ottaen annos ja annosväli on määritettävä lääkärin tietylle potilaalle asettamien hoitotavoitteiden mukaisesti.
Pediatriset potilaat
Kirurgisen toimenpiteen yhteydessä tai hoidettaessa verenvuototilannetta nuorten annos lasketaan yllä kuvatun aikuisten kaavan mukaan, ja < 12-vuotiaiden lasten annos lasketaan seuraavalla tavalla:
Annos (mg/kg kehon painoa) = [kohdepitoisuus (g/l) - mitattu pitoisuus (g/l)]
0,014 (g/l mg/kg kehon painoa kohti)
Tätä seuraava annostus on sovitettava potilaan kliinisen tilan ja laboratoriotulosten perusteella.
Iäkkäät potilaat
FIBRYGA:n kliinisissä tutkimuksissa ei ollut mukana 65‑vuotiaita ja tätä vanhempia potilaita. Näin ollen varmaa näyttöä siitä, onko heillä erilainen vaste kuin nuoremmilla potilailla ei ole.
2. Verenvuodon hoito
Verenvuoto synnynnäistä hypofibrinogenemiaa tai afibrinogenemiaa sairastaville potilaille
Verenvuototilanteita on hoidettava yllä olevien aikuisia/nuoria ja lapsia koskevien kaavojen mukaan, jotta saavutetaan suositeltu 1 g/l plasman fibrinogeenipitoisuus. Tämä pitoisuus on säilytettävä, kunnes hemostaasi on turvattu.
Hankittua fibrinogeenipuutosta sairastavien potilaiden verenvuoto
°Yleensä aluksi annetaan 1-2 g infuusio ja sen jälkeen tarvittaessa lisäinfuusioita. Vakavan verenvuodon yhteydessä, esim. suuri leikkaustoimenpide, saatetaan tarvita suurempia annoksia (4-8 g) fibrinogeeniä.
Pediatriset potilaat
Annostus määritetään kehon painon ja kliinisen tarpeen perusteella, mutta on tavallisesti 20-30 mg/kg.
Ohjeet valmistelua ja antoa varten
Yleiset ohjeet
- Käyttökuntoon saatetun liuoksen on oltava lähes väritöntä tai hieman opaalinhohtoista. Älä käytä sameita liuoksia tai liuoksia, joissa on sakkaa.
- FIBRYGA on tarkoitettu vain kertakäyttöön. Älä käytä mitään osaa uudelleen.
- Mikrobiologisen turvallisuuden takia liuos on annettava välittömästi käyttökuntoon saattamisen jälkeen. Käyttökuntoon saatetun liuoksen kemiallinen ja fysikaalinen säilyvyys on osoitettu 24 tuntiin asti huoneenlämmössä (enintään 25 °C) säilytettynä. Älä laita FIBRYGA-liuosta jääkaappiin tai pakasta sitä käyttökuntoon saattamisen jälkeen.
Käyttökuntoon saattaminen
| 1. Varmista, että jauhetta (FIBRYGA) sisältävä pullo ja liuotinta sisältävä injektiopullo ovat huoneenlämpöisiä. Ylläpidä tämä lämpötila käyttökuntoon saattamisen ajan. Jos lämmittämiseen käytetään vesihaudetta, on oltava varuillaan, jotta vältetään veden pääseminen kosketuksiin pullojen kumitulppien tai korkkien kanssa. Veden lämpötila ei saa ylittää 37 °C:ta. | ||
| 2. Poista korkki jauhepullosta (FIBRYGA) ja liuotinpullosta niin, että tulpan keskiosa tulee näkyviin. Puhdista kumitulpat alkoholiin kastetulla vanutupolla ja anna kumitulppien kuivua. | ||
| 3. Avaa siirtolaitteen (nextaro) pakkaus vetämällä kansi pois (Kuva 1). Jätä siirtolaite puhtaaseen ulkopakkaukseen pitääksesi sen steriilinä. Älä koske piikkiin. | 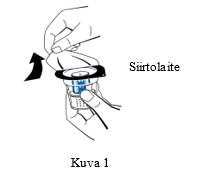 | |
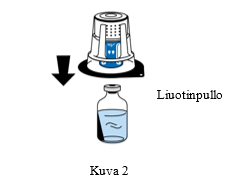
4. Aseta liuotinpullo tasaiselle, puhtaalle pinnalle ja ota siitä lujasti kiinni. Aseta siirtolaitteen sininen osa liuotinpullon päälle poistamatta siirtolaitteen ulkopakkausta. Paina siirtolaitetta suoraan ja lujasti alaspäin, kunnes se napsahtaa paikalleen (Kuva 2). Älä kierrä laitetta kiinnittämisen aikana.
Huomautus: Siirtolaite on liitettävä ensin liuotinta sisältävään injektiopulloon ja sitten kylmäkuivattua jauhetta sisältävään pulloon. Muuten laitteen tyhjiö häviää eikä liuos siirry. |
| |
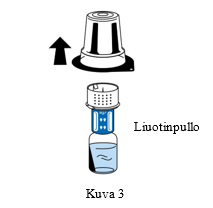
| 5. Pidä kiinni liuotinpullosta ja poista siirtolaitteen (nextaro) ulkopakkaus varovasti vetämällä sitä ylöspäin. Varmista, että siirtolaite jää lujasti kiinni liuotinpulloon (Kuva 3). |
| |
| 6. Aseta jauhetta (FIBRYGA) sisältävä pullo tasaiselle, puhtaalle alustalle ja pidä siitä tiukasti kiinni. Tartu liuotinpulloon, johon on kiinnitetty siirtolaite, ja käännä se ylösalaisin. Aseta siirtolaitteen liittimen valkoinen osa jauhetta (FIBRYGA) sisältävän pullon päälle ja paina siirtolaitetta lujasti alas, kunnes se napsahtaa paikoilleen (Kuva 4). Älä kierrä osia kiinnittämisen aikana. Liuotin virtaa automaattisesti jauhetta (FIBRYGA) sisältävään pulloon. | 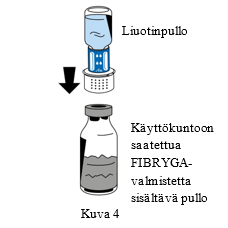 | |
| 7. Pidä liuotinpullo liitettynä ja sekoita FIBRYGA-pulloa varovasti, kunnes jauhe on liuennut kokonaan. Älä ravista pulloa, jotta vaahtoa ei muodostu. Jauheen pitäisi liueta täysin noin 5 minuutin kuluessa. Liukenemisen ei pitäisi kestää yli 20 minuuttia. Jos jauhe ei liukene 20 minuutin aikana, tuote pitää hävittää. | ||
| 8. Joskus harvoin liuoksessa voi kellua liukenematonta jauhetta injektionesteisiin käytettävän veden siirtämisen aikana tai käyttökuntoon saattamiseen kuluva aika voi pitkittyä odottamattomasti. Liukenemista voidaan nopeuttaa liikuttamalla injektiopulloa voimakkaammin vaakatasossa. | ||
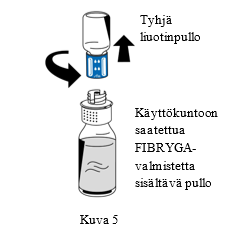
| 9. Kun käyttökuntoon saattaminen on valmis, kierrä siirtolaitetta (sininen osa) vastapäivään niin, että se irtoaa kahdeksi osaksi (Kuva 5). Älä koske siirtolaitteen Luer lock -liittimen valkoiseen osaan. |
| |
| 10. Hävitä tyhjä liuotinpullo ja siirtolaitteen sininen osa yhdessä | ||
Anto
| 1. Liitä ruisku varovasti siirtolaitteen valkoisen osan Luer lock -liittimeen (Kuva 6). | 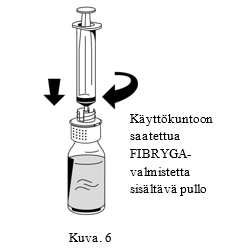 |
| 2. Käännä FIBRYGA-pullo ylösalaisin ja vedä liuos ruiskuun (Kuva 7). | 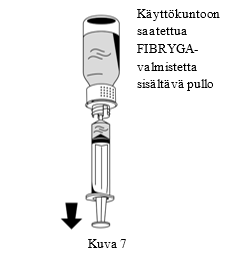 |
| 3. Kun liuos on siirretty, pidä lujasti kiinni ruiskun sylinteristä (pidä ruiskun mäntä alaspäin) ja poista ruisku siirtolaitteesta (Kuva 8). | 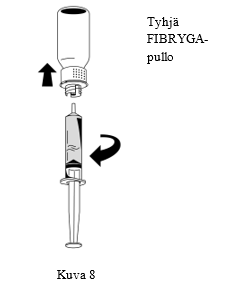 |
| 4. Hävitä siirtolaitteen valkoinen osa ja tyhjä FIBRYGA-pullo yhdessä. |
Käyttökuntoon saatetun liuoksen laskimoon antoon huoneenlämmössä suositellaan vakiomuotoista infuusiovälineistöä.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Antotapa
Infuusio tai injektio laskimoon.
FIBRYGA on annosteltava laskimonsisäisesti hitaasti suositellulla enimmäisnopeudella 5 ml/min potilaille, joilla on synnynnäinen hypo- tai afibrinogenemia ja suositellulla enimmäisnopeudella 10 ml/min potilaille, joilla on hankittu fibrinogeenipuutos.
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.