Pakkausseloste
PROCREN DEPOT PDS pulver och vätska till injektionsvätska, suspension i förfylld spruta 3,75 mg, 11,25 mg, 30 mg
Tilläggsinformation
Procren Depot PDS 3,75 mg pulver och vätska till injektionsvätska, suspension, förfylld spruta
Procren Depot PDS 11,25 mg pulver och vätska till injektionsvätska, suspension, förfylld spruta
Procren Depot PDS 30 mg pulver och vätska till injektionsvätska, suspension, förfylld spruta
leuprorelinacetat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Procren Depot PDS är och vad det används för
2. Vad du behöver veta innan du använder Procren Depot PDS
3. Hur du använder Procren Depot PDS
4. Eventuella biverkningar
5. Hur Procren Depot PDS ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Procren Depot PDS är en syntetisk nonapeptid, som hämmar testosteron- och östrogenproduktionen.
När skall Procren Depot PDS användas?Procren Depot PDS 3,75 mg, 11,25 mg och 30 mg används för vård av prostatacancer i avancerat stadium, då orkidektomi ej är indikerad. Procren Depot PDS 3,75 mg och 11,25 mg används också för behandling av svår endometrios och bröstcancer hos pre- och perimenopausala kvinnor då hormonterapi är indikerad. Procren Depot PDS 3,75 mg används också för att förminska livmodermyom (leiomyata uteri) hos kvinnor.
Leuprorelinacetat som finns i Procren Depot PDS kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apotekspersonal eller annan hälsovårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Användning för barn
Leuprorelin är ett syntetiskt hormon som kan användas för att sänka halten av testosteron och östrogen. Procren Depot PDS 3,75 mg och 11,25 mg används för behandling av för tidig pubertet som beror på utsöndring av vissa hormoner från hjärnbihanget (centralt betingad tidig pubertet) hos flickor som är yngre än 9 år och pojkar som är yngre än 10 år.
Vad du behöver veta innan produkten används
Din läkare fastställer den exakta diagnosen för centralt betingad tidig pubertet.
Använd inte Procren Depot PDS:
- om du är allergisk mot leuprorelinacetat eller mot andra liknande nonapeptider eller mot något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du är gravid, försöker bli gravid eller ammar.
- om du har blödningar från slidan, vars orsak inte är fastställd.
Hos flickor med centralt betingad tidig pubertet
- om flickan som ska få behandling är gravid eller ammar.
- om flickan har blödning från slidan vilken inte diagnostiserats.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Procren Depot PDS.
Allergiska reaktioner
Om du får allergiska reaktioner med symtom såsom trånghetskänsla i bröstet, väsande andning, yrsel, svullnad eller utslag, ska du sluta injicera Procren Depot PDS och kontakta din läkare omgående eftersom dessa reaktioner i sällsynta fall kan vara livshotande.
I början av behandlingen kan övergående ökning av symtom upptäckas.
Depression, som kan vara allvarlig, har rapporterats hos patienter som tar Procren Depot PDS. Informera din läkare om du blir nedstämd/deprimerad under tiden du tar Procren Depot PDS.
Om du (eller ditt barn) får svår eller återkommande huvudvärk, problem med synen och ringningar eller susningar i öronen, ska du omedelbart kontakta läkare.
Allvarliga hudutslag inklusive Steven-Johnsons syndrom, toxisk epidermal nekrolys (SJS/TEN) har rapporterats i samband med leuprorelin. Sluta genast att använda leuprorelin och sök omedelbart vård om du upplever något av de symtom som förknippas med dessa allvarliga hudreaktioner och som beskrivs i avsnitt Eventuella biverkningar.
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Procren Depot PDS:
- om du har metastaser kring ryggraden.
Män:
- om du har fettlever
- om du har en urinvägsobstruktion
- om du har hjärtkärlsjukdom inklusive hjärtrytmrubbningar (arytmi), eller om du tar medicin mot detta. Risken för att drabbas av hjärtrytmrubbningar kan vara förhöjd när man använder Procren Depot PDS.
- om du har högt blodsocker, diabetes och/eller högt kolesterol kommer din läkare vid behov undersöka dig för metabolt syndrom/metaboliska ändringar.
Kvinnor:
- om din endometrios tidigare har behandlats med leuprorelin
Barn och ungdomar
Om barnet har en progressiv hjärntumör bestämmer läkaren om leuprorelinbehandling är adekvat.
Läkaren följer upp din hormonnivå om det bildas en steril abscess på injektionsstället (rapporteras ofta efter injektion i muskeln), då absorptionen av leuprorelin kan minska från injektionsstället. Ofta uppkommer sterila abscesser på injektionsstället då Procren Depot PDS administrerats i högre dos än vad som rekommenderas och vid intramuskulär administration. Därför ger läkaren läkemedlet under huden t.ex. inom mag-, bak- eller lårområdet.
Flickor med centralt betingad tidig pubertet:
Efter första injektionen kan blödning (fläckblödning) och sekret från slidan förekomma, vilket är ett tecken på att hormoninverkan upphör. Om blödning från slidan förekommer ännu efter första/andra behandlingsmånaden, bör detta utredas.
Bentätheten kan sjunka under behandling av centralt betingad tidig pubertet med Procren Depot PDS. Efter avslutad behandling återfår dock skelettet bentätheten, och den högsta uppnådda bentätheten senare under puberteten förefaller opåverkad av behandlingen.
Då behandlingen avslutas kan detta leda till glidning av lårbenets tillväxtplatta. En orsak till detta kan vara att tillväxtplattan försvagats på grund av minskad halt av kvinnligt könshormon medan behandlingen pågår.
Om läkemedlet inte används enligt behandlingsprogrammet eller om för små doser används, kan utvecklingsprocessen under puberteten möjligen vara otillräckligt kontrollerad.
Andra läkemedel och Procren Depot PDS
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Procren Depot PDS kan påverka vissa andra läkemedel som används för att behandla hjärtrytmrubbningar (t.ex. kinidin, prokainamid, amiodaron och sotalol) eller kan öka risken för hjärtrytmrubbningar när det används tillsammans med andra läkemedel (t.ex. metadon (används mot smärta och vid behandling av drogberoende), moxifloxacin (ett antibiotikum), antipsykotika (används mot allvarlig psykisk sjukdom)).
Med tillägg av hormonell behandling (5 mg noretisteronacetat) i samband med Procren Depot PDS behandlingen kan effekterna av eventuella biverkningar på benbyggnaden och vasomotoriska symptom (blodvallningar) lindras.
Graviditet och amning
Gravida kvinnor och ammande mödrar bör ej vårdas med Procren Depot PDS (se också avsnitt ”Använd inte Procren Depot PDS”). Innan behandlingen inleds bör en eventuell graviditet uteslutas och användning av lämpligt icke-hormonellt preventivmedel bör försäkras under behandlingstiden.
Körförmåga och användning av maskiner
Ingen inverkan på körförmågan eller på förmågan att använda maskiner har påvisats.
Hur produkten används
Procren Depot PDS bör endast ges av din läkare eller en sjuksköterska som även färdigställer läkemedlet.
Hur och när skall jag använda Procren Depot PDS?
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Den rekommenderade dosen för män med prostatacancer är en subkutan engångsinjektion på 3,75 mg var fjärde (4) vecka, en subkutan engångsinjektion på 11,25 mg var 12:te vecka eller en subkutan engångsinjektion på 30 mg var sjätte (6) månad. Behandlingen bör ej avbrytas vid remission eller förbättring.
Den rekommenderade dosen för kvinnor som lider av endometrios är en subkutan engångsinjektion på 3,75 mg var fjärde vecka eller 11,25 mg var 12:te vecka under högst sex (6) månaders tid. Det har kunnat bevisas att benurkalkning och vasomotoriska symptom (blodvallningar) minskar då man vid behandling av endometrios med Procren Depot PDS tillägger hormonell behandling (5 mg noretisteronacetat).
Den rekommenderade dosen för kvinnor som lider av myom i livmodern är en subkutan engångsinjektion på 3,75 mg var fjärde vecka under högst tre (3) månaders tid. Den rekommenderade dosen för kvinnor med bröstcancer är en subkutan engångsinjektion på 3,75 mg var fjärde vecka eller en subkutan engångsinjektion på 11,25 mg med 12 veckors mellanrum.
Användning för barn
Vid behandling av barn, skall behandlingen som helhet övervakas av en pediatrisk endokrinolog.
Doseringen anpassas individuellt.
Den rekommenderade inledningsdosen beror på patientens kroppsvikt:
a) Barn som väger 20 kg eller över
Om inte annat ordineras, injiceras 1 ml Procren Depot PDS (3,75 mg leuprorelin acetat) en gång per månad eller 1 ml Procren Depot PDS (11,25 mg leuprorelin acetat) en gång per 3 månader i en injektion under huden t.ex. inom mag-, bak- eller lårområdet.
b) Barn som väger mindre än 20 kg
I dessa sällsynta fall måste man beakta tillståndets (centralt betingad tidig pubertet) kliniska aktivitet och mot bakgrund av detta gäller följande:
Om inte annat ordineras, injiceras 0,5 ml Procren Depot PDS 3,75 mg (1,88 mg leuprorelin acetat) en gång per månad eller 0,5 ml Procren Depot PDS 11,25 mg (5,625 mg leuprorelin acetat) en gång per 3 månader i en injektion under huden t.ex. inom mag-, bak- eller lårområdet. Kvarbliven suspension kasseras. Läkaren uppföljer barnets viktökning.
Beroende på tillståndets (centralt betingad tidig pubertet) aktivitet, kommer läkaren eventuellt att öka doseringen, om hämningen av hormoninverkan (t.ex. blödning ur slidan) är otillräcklig. Läkaren bestämmer minsta effektiva dos med hjälp av blodprov.
Behandlingens längd beror på de kliniska tecknen vid behandlingens början eller medan den pågår. Den bestäms av läkaren i samråd med barnets lagliga företrädare och barnet som behandlas, om detta är lämpligt. Läkaren bestämmer barnets skelettålder med jämna intervaller.
För flickor med en skelettmognadsålder på mer än 12 år och för pojkar med en skelettmognadsålder på mer än 13 år bedömer läkaren huruvida behandlingen ska avslutas, men detta beror på läkemedlets kliniska effekter hos barnet.
Graviditet ska uteslutas hos flickor innan behandlingen inleds. Graviditet under själva behandlingen kan inte allmänt taget uteslutas. Om graviditet uppkommer, tala med läkaren om detta.
Det är frågan om en långtidsbehandling som justeras individuellt. Ordna med läkarmottagningen så att Procren Depot PDS 3,75 mg administreras så exakt i en månads intervaller och regelbundet som möjligt eller att Procren Depot PDS 11,25 mg administreras så exakt i 3 månaders intervaller och regelbundet som möjligt. Om en förskjutning på några dagar (Procren Depot PDS 3,75 mg 30 ± 2 dagar, Procren Depot PDS 11,25 mg 90 ± 2 dagar) undantagsvis dock inträffar, inverkar detta inte på behandlingsresultatet.
Om du använt för stor mängd av Procren Depot PDS
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Eventuella biverkningar
Liksom alla läkemedel kan Procren Depot PDS orsaka biverkningar. Alla användare behöver ändå inte få dem. Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information.
De vanligaste biverkningarna är reaktioner vid injektionsstället såsom smärta, blåmärken, inflammation, böld och förhårdnad. Även huvudvärk, yrsel, kräkningar, illamående, utslag, acne, blodvallningar, humörförändringar (långtidsanvändning), depression (långtidsanvändning), andnöd, ökad svettning, muskelsmärtor och ledsymptom, smärta, vätskeansamlingar i kroppen (svullenhet), kraftlöshet och trötthet.
Hos män kan även förminskning av testiklarna, impotens och förändringar (QT-förlängning) i EKG (elektrokardiogram) förekomma.
Vanliga biverkningar hos kvinnor är vaginal infektion, minskad sexuell lust, ömhet och smärta i brösten, minskad bröststorlek och vaginal torrhet.
Mindre vanliga biverkningar är humörförändringar (kortvarig användning) och depression (kortvarig användning)*.
Sällsynta biverkningar kan vara viktförändringar, synstörningar, tryckkänsla över bröstet, sömnlöshet, anafylaktisk reaktion, muskelstelhet, tinnitus, hörselnedsättning, ökad hårväxt, feber, anemi, förändringar i blodbilden, EKG-förändringar/ischemi, takykardi, högt blodtryck, förändringar i känselupplevelse, kramper, anorexi, diarré, aptitförändringar, törst, förstoppning, stomatit, muntorrhet, klåda, hudsymptom, håravfall, störningar i nagelbildningen, förändrade levervärden såsom förhöjda transaminas- och fosfatasvärden, förhöjda triglycerid- och urinsyravärden, förhöjda kaliumvärden, smärtor i rygg och skelett, urineringsstörningar, ökat urineringsbehov, blod i urinet, förhöjda ureavärden och lunginflammation. Även förstoring av bröstkörtlarna hos män och smärtor vid samlag samt irritation hos kvinnor är sällsynta biverkningar.
Biverkningar som har rapporterats (förekommer hos ett okänt antal användare): interstitiell lungsjukdom. Allvarlig leverskada har rapporterats hos kvinnor och män och fettlever har rapporterats hos män efter godkännande för försäljning, men frekvensen är okänd. Idiopatisk intrakraniell hypertension (ökat tryck inuti skallen, runt hjärnan som kännetecknas av huvudvärk, dubbelseende och andra problem med synen samt ringningar eller susningar i ena eller båda öronen). Nekros (vävnadsdöd) vid injektionsstället.
Allergiska hudreaktioner såsom utslag med blåsor och fjällning (till exempel Steven-Johnsons syndrom (SJS)/toxisk epidermal nekrolys (TEN), exfoliativ dermatit eller blåsdermatos). Hudrodnad och kliande hudutslag (toxiskt hudutslag). En hudreaktion som orsakar röda prickar eller fläckar på huden som kan likna en måltavla och har ett mörkrött parti i mitten som omsluts av blekare röda ringar (erythema multiforme). Sök omedelbart vård om du upplever något av följande symtom: om du får rödaktiga, icke upphöjda, måltavleliknande eller runda fläckar på överkroppen, ofta med en liten blåsa i mitten, hudflagning, sår i mun, hals, näsa, könsorgan och ögon. Dessa allvarliga hudutslag kan föregås av feber och influensaliknande symtom (Steven-Johnsons syndrom/toxisk epidermal nekrolys).
Hos barn:
I början av behandlingen stiger halterna av könshormon för en kort tid och därefter sjunker de till den nivå som barn har före puberteten. På grund av detta fenomen kan biverkningar uppkomma särskilt då behandlingen påbörjas.
Vanliga:
- humörsvängningar
- huvudvärk
- buksmärta/bukkramper
- illamående/kräkningar
- akne
- blödning från slidan
- fläckblödning
- sekret
- reaktioner på injektionsstället
Mycket sällsynta:
- generella allergiska reaktioner (feber, utslag, klåda)
- allvarlig allergisk reaktion som leder till andningssvårigheter eller yrsel
- Följande gäller alla läkemedel inom denna läkemedelsklass: om du har en förändring i hjärnbihanget, kan risken för blödning eller cerebral infarkt i detta område vara förhöjd, och detta kan leda till bestående skada.
Observera:
Om blödning från slidan (fläckblödning) förekommer då behandlingen fortgår (efter eventuell bortfallsblödning under första behandlingsmånaden), kan detta vara ett tecken på eventuell underdosering. Tala om för läkaren om blödning från slidan förekommer.
Psykiska biverkningar:
Vissa personer som tar Procren Depot PDS eller liknande läkemedel, så kallade gonadotropinfrisättande hormonagonister (GnRH-agonister), kan få nya eller förvärrade psykiska problem. Psykiska problem kan inkludera följande symtom:
- gråt
- irritabilitet
- rastlöshet (otålighet)
- ilska
- aggressivt beteende.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
*: en högre frekvens kan vara lämplig för specifika produkter och indikationer baserad på deras egen kliniska data.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras under 25 °C. Förvara inte kallt. Får inte frysa. Förvara i originalförpackningen.
Används före utgångsdatum som anges på förpackningen. Utgångsdatumet är den sista dagen i angiven månad. Medicinen skall inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man gör med mediciner som inte längre används. Dessa åtgärder är till för att skydda miljön.
Den färdigställda 3,75 mg suspensionen är användbar i 24 timmar.
Den färdigställda 11,25 mg suspensionen är användbar i 12 timmar.
Den färdigställda 30 mg suspensionen är användbar i 24 timmar.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är leuprorelinacetat.
- Övriga innehållsämnen är:
3,75 mg:
Pulver till injektionsvätska: poly(mjölksyra/glykolsyra) sampolymer, mannitol och gelatin.
Vätska: karmellosnatrium, mannitol, polysorbat 80, koncentrerad ättiksyra (för pH justering) och
vatten för injektionsvätskor.
11,25 mg och 30 mg:
Pulver till injektionsvätska: Polymjölksyra och mannitol.
Vätska: karmellosnatrium, mannitol, polysorbat 80, koncentrerad ättikssyra (för pH justering) och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Förpackningen innehåller en 2-kammarspruta försedd med en nål. Sprutans kolv är separat packad i förpackningen. Förpackningen innehåller också en spritsudd.
Den engångsförpackade förfyllda sprutan innehåller: vitt pulver och klar färglös vätska.
Innehavare av försäljningstillstånd
AbbVie Oy
Lokvägen 11 T 132
00520 Helsingfors
Finland
Tillverkare
AbbVie Logistics B.V.
Zuiderzeelaan 53,
8017 JV Zwolle
Nederländerna
AbbVie Deutschland GmbH & Co. KG
Knollstrasse, 67061
Ludwigshafen
Tyskland
Denna bipacksedel ändrades senast 18.2.2025
Direktiv för användaren
Procren Depot PDS består av en 2-kammarspruta försedd med en nål. Den ena kammaren innehåller 3,75 mg, 11,25 mg eller 30 mg leuprorelinacetat i pulverform och den andra kammaren innehåller 1 ml lösningsmedel.
Kolven är packad separat i förpackningen. Injektionsvätskan färdigställs omedelbart innan administrering. Förberedelserna utförs alltid med sprutan i upprätt ställning.
1. För att förbereda en injektion skruvas den vita kolven fast i injektionssprutans botten tills den bakre gummiproppen börjar snurra. Försäkra dig om att nålen är ordentligt fastskruvad på sprutan. Knacka försiktigt på sprutan så att pulvret lossnar från kammarens vägg.
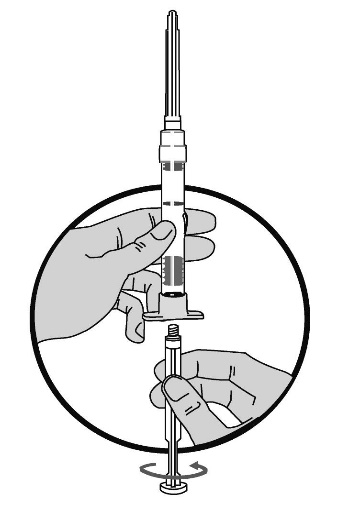
2. Håll sprutan i upprätt ställning med injektionsnålens spets uppåt. Tryck in kolven LÅNGSAMT tills den mellersta gummiproppens övre del når den blå linjen. Detta skall ta ca 6-8 sek.
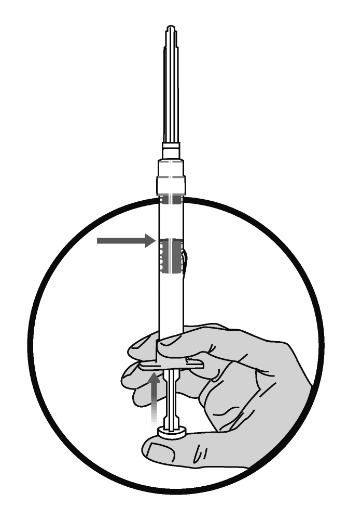
3. Skaka sprutan lätt eller rulla sprutan mellan handflatorna tills pulvret och lösningen har blandats ordentligt. Om pulvret fastnar vid gummiproppen, knacka försiktigt med fingret på injektionssprutan och blanda igen.
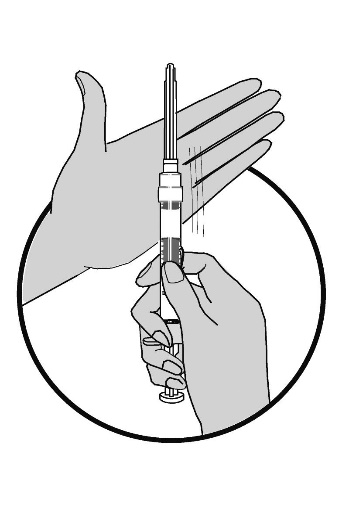
4. Avlägsna nålskyddet, kontrollera att nålen inte lossnar och tryck kolven framåt för att avlägsna eventuell luft från sprutan.
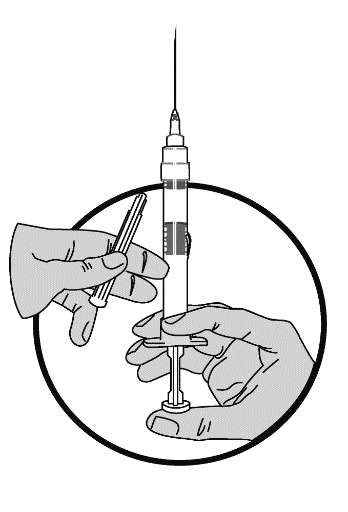
5. Rengör injektionsstället och injicera läkemedlet subkutant. Håll nålen under huden en stund före du avlägsnar den.