Pakkausseloste
DABIGATRAN ETEXILATE KRKA kapseli, kova 150 mg
Dabigatran etexilate Krka 150 mg kovat kapselit
dabigatraanieteksilaatti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Dabigatran etexilate Krka on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin otat Dabigatran etexilate Krka -valmistetta
3. Miten Dabigatran etexilate Krka -valmistetta otetaan
4. Mahdolliset haittavaikutukset
5. Dabigatran etexilate Krka -valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Dabigatran etexilate Krka sisältää vaikuttavana aineena dabigatraanieteksilaattia ja kuuluu veren hyytymistä estävien lääkkeiden ryhmään. Se vaikuttaa estämällä elimistön ainetta, joka on osallisena veritulppien muodostumisessa.
Dabigatran etexilate Krka -valmistetta käytetään aikuisille:
- estämään aivoveritulpan (aivohalvauksen) ja muiden veritulppien muodostumista, jos sinulla on ei-läppäperäiseksi eteisvärinäksi kutsuttu sydämen rytmihäiriö ja vähintään yksi lisäriskitekijä.
- veritulppien hoitoon jalkojen laskimoissa ja keuhkoverisuonissa sekä veritulppien uusiutumisen ehkäisyyn jalkojen laskimoissa ja keuhkoverisuonissa.
Dabigatran etexilate Krka -valmistetta käytetään lapsille:
- veritulppien hoitoon ja veritulppien uusiutumisen ehkäisyyn.
Dabigatraanieteksilaattia, jota Dabigatran etexilate Krka sisältää, voidaan joskus käyttää myös muiden kuin tässä pakkausselosteessa mainittujen sairauksien hoitoon. Kysy neuvoa lääkäriltä, apteekkihenkilökunnalta tai muulta terveydenhuollon ammattilaiselta tarvittaessa ja noudata aina heiltä saamiasi ohjeita.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä ota Dabigatran etexilate Krka -valmistetta
- jos olet allerginen dabigatraanieteksilaatille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on vaikea munuaisten vajaatoiminta
- jos sinulla on parhaillaan verenvuotoa
- jos sinulla on elimen vaurio, joka suurentaa vakavan verenvuodon riskiä (esim. mahahaava, aivovamma tai aivoverenvuoto tai äskettäin tehty aivo- tai silmäleikkaus)
- jos tiedät, että sinulla on lisääntynyt taipumus saada verenvuotoja. Tämä voi olla synnynnäistä, johtua tuntemattomasta syystä tai olla muiden lääkkeiden aiheuttamaa.
- jos käytät veren hyytymistä estäviä lääkkeitä (kuten varfariinia, rivaroksabaania, apiksabaania tai hepariinia), paitsi silloin kun antikoagulaatiohoitoa ollaan vaihtamassa tai kun sinulla on avattu laskimo- tai valtimoyhteys ja saat hepariinia tämän auki pitämiseksi tai kun sydämesi syke eteisvärinän vuoksi palautetaan normaaliksi toimenpiteellä, jota kutsutaan katetriablaatioksi
- jos sinulla on vaikea maksan vajaatoiminta tai sinulla on maksasairaus, joka voi mahdollisesti johtaa kuolemaan
- jos käytät suun kautta otettavaa ketokonatsolia tai itrakonatsolia, sieni-infektioiden hoitoon tarkoitettuja lääkkeitä
- jos käytät suun kautta otettavaa siklosporiinia, elinsiirron jälkeen käytettävää lääkettä hylkimisreaktion estämiseksi
- jos käytät dronedaronia, lääkettä, jota käytetään epäsäännöllisen sydämen rytmin hoitoon
- jos käytät yhdistelmävalmistetta, joka sisältää hepatiitti C:n hoitoon käytettäviä viruslääkkeitä glekapreviiria ja pibrentasviiria
- jos sinulle on asennettu sydämen tekoläppä, joka vaatii pysyvää verenohennushoitoa.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin otat Dabigatran etexilate Krka ‑valmistetta. Saatat myös joutua keskustelemaan lääkärin kanssa Dabigatran etexilate Krka -hoidon aikana, jos sinulle tulee oireita tai jos menet leikkaukseen.
Kerro lääkärille, jos sinulla on tai on ollut jokin sairaustila tai sairaus, etenkin jokin seuraavista:
- jos sinulla on suurentunut verenvuotoriski, kuten:
- jos sinulla on ollut äskettäin verenvuotoa
- jos sinulle on tehty biopsia (koepalan ottaminen) viimeisen kuukauden aikana
- jos sinulla on ollut vakava vamma (esim. luunmurtuma, pään vamma tai jokin kirurgista hoitoa vaativa vamma)
- jos sinulla on ruokatorvi- tai mahatulehdus
- jos sinulla on närästystä (mahahappoa nousee ruokatorveen)
- jos saat lääkkeitä, jotka voivat suurentaa verenvuotoriskiä. Ks. kohta ”Muut lääkevalmisteet ja Dabigatran etexilate Krka” alla.
- jos käytät tulehduskipulääkkeitä, kuten diklofenaakkia, ibuprofeenia tai piroksikaamia
- jos sinulla on sydäntulehdus (bakteeritulehdus sydämen sisäkalvossa)
- jos tiedät, että sinulla on heikentynyt munuaisten toiminta, tai jos sinulla on kuivumisen oireita, kuten janon tunnetta ja vähentynyt virtsamäärä, ja virtsan väri on tumma (väkevää virtsaa) tai virtsa vaahtoaa
- jos olet yli 75-vuotias
- jos olet aikuinen ja painat 50 kg tai vähemmän
- vain jos valmistetta käytetään lapsille: jos lapsella on infektio aivojen ympärillä tai aivoissa
- jos sinulla on ollut sydänkohtaus tai jos sinulla on todettu sairaus, joka suurentaa riskiä saada sydänkohtaus
- jos sinulla on maksasairaus, johon liittyy muutoksia verikokeissa. Tässä tapauksessa Dabigatran etexilate Krka -valmisteen käyttöä ei suositella.
Ole erityisen varovainen Dabigatran etexilate Krka -valmisteen suhteen
- jos tarvitset leikkaushoitoa:
Tällöin Dabigatran etexilate Krka -hoito on keskeytettävä väliaikaisesti, koska verenvuotoriski on suurentunut leikkauksen aikana ja heti sen jälkeen. On hyvin tärkeää, että Dabigatran etexilate Krka -valmistetta otetaan täsmälleen lääkärin määräämään aikaan ennen leikkausta ja sen jälkeen. - jos selkärankaasi laitetaan leikkauksen yhteydessä katetri tai ruiskutetaan lääkettä (esim. epiduraali- tai spinaalipuudutusta tai kivunlievitystä varten):
- on hyvin tärkeää, että Dabigatran etexilate Krka -valmistetta otetaan täsmälleen lääkärin määräämään aikaan ennen leikkausta ja sen jälkeen
- kerro lääkärille välittömästi, jos sinulla esiintyy jalkojen puutumista tai heikkoutta tai suolen tai rakon toimintahäiriöitä puudutuksen jälkeen, sillä kiireellinen hoito on tarpeen
- jos kaadut tai loukkaat itsesi hoidon aikana, varsinkin jos lyöt pääsi. Ota silloin välittömästi yhteyttä lääkäriin. Lääkäri saattaa joutua tutkimaan sinut, koska sinulla voi olla suurentunut verenvuotoriski.
- jos tiedät, että sinulla on fosfolipidivasta-aineoireyhtymä (immuunijärjestelmän häiriö, joka suurentaa veritulppariskiä), kerro asiasta lääkärille, joka päättää, onko hoitoa tarpeen muuttaa.
Muut lääkevalmisteet ja Dabigatran etexilate Krka
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä. On erityisen tärkeää kertoa lääkärille seuraavien lääkkeiden käytöstä, ennen kuin käytät Dabigatran etexilate Krka -valmistetta:
- veren hyytymistä estävät lääkkeet (esim. varfariini, fenprokumoni, asenokumaroli, hepariini, klopidogreeli, prasugreeli, tikagrelori, rivaroksabaani tai asetyylisalisyylihappo)
- sieni-infektiolääkkeet (esim. ketokonatsoli tai itrakonatsoli), ellei niitä käytetä ainoastaan iholle
- epäsäännöllisen sydämen rytmin hoitoon tarkoitetut lääkkeet (esim. amiodaroni, dronedaroni, kinidiini ja verapamiili).
Jos käytät verapamiilia sisältäviä lääkkeitä, lääkäri voi määrätä sinulle pienemmän Dabigatran etexilate Krka -annoksen sen mukaan, mihin tarkoitukseen se on sinulle määrätty. Ks. kohta Miten valmistetta käytetään.
- elinsiirron jälkeen hylkimisreaktion estämiseksi käytettävät lääkkeet (esim. takrolimuusi tai siklosporiini)
- yhdistelmävalmiste, joka sisältää glekapreviiria ja pibrentasviiria (hepatiitti C:n hoitoon käytettävä viruslääke)
- tulehduskipulääkkeet (esim. asetyylisalisyylihappo, ibuprofeeni tai diklofenaakki)
- mäkikuisma, rohdosvalmiste masennuksen hoitoon
- masennuslääkkeet, joita kutsutaan selektiivisiksi serotoniinin takaisinoton estäjiksi tai serotoniinin ja noradrenaliinin takaisinoton estäjiksi
- rifampisiini tai klaritromysiini (molemmat antibiootteja)
- viruslääkkeet AIDS:n hoitoon (esim. ritonaviiri)
- tietyt epilepsian hoitoon tarkoitetut lääkkeet (esim. karbamatsepiini tai fenytoiini).
Raskaus ja imetys
Dabigatran etexilate Krka -valmisteen vaikutuksia raskauteen ja syntymättömään lapseen ei tunneta. Sinun ei pidä ottaa Dabigatran etexilate Krka -valmistetta, jos olet raskaana, ellei lääkäri kerro, että se on turvallista. Jos olet nainen ja voit tulla raskaaksi, sinun on vältettävä raskaaksi tulemista käyttäessäsi Dabigatran etexilate Krka -valmistetta.
Sinun ei pidä imettää käyttäessäsi Dabigatran etexilate Krka -valmistetta.
Ajaminen ja koneiden käyttö
Dabigatran etexilate Krka -valmisteella ei ole tunnettuja vaikutuksia ajokykyyn tai koneidenkäyttökykyyn.
Lääke voi heikentää kykyä kuljettaa moottoriajoneuvoa tai tehdä tarkkaa keskittymistä vaativia tehtäviä. On omalla vastuullasi arvioida, pystytkö näihin tehtäviin lääkehoidon aikana. Lääkkeen vaikutuksia ja haittavaikutuksia on kuvattu muissa kappaleissa. Lue koko pakkausseloste opastukseksesi. Keskustele lääkärin tai apteekkihenkilökunnan kanssa, jos olet epävarma.
Miten valmistetta käytetään
Dabigatran etexilate Krka -kapseleita voidaan käyttää aikuisille sekä vähintään 8-vuotiaille lapsille, jotka pystyvät nielemään kapselit kokonaisina.
Alle 8-vuotiaiden lasten hoitoon on saatavana muita lääkemuotoja.
Ota tätä lääkettä juuri siten kuin lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Ota Dabigatran etexilate Krka -kapseleita ohjeiden mukaan seuraavasti:
Aivoveritulpan ja muiden veritulppien ehkäisy rytmihäiriöpotilailla sekä veritulppien hoito jalkojen laskimoissa ja keuhkoverisuonissa ja veritulppien uusiutumisen ehkäisy jalkojen laskimoissa ja keuhkoverisuonissa
Suositeltu annos on 300 mg (yksi 150 mg:n kapseli kahdesti vuorokaudessa).
Jos olet vähintään 80-vuotias, suositeltu Dabigatran etexilate Krka -annos on 220 mg (yksi 110 mg:n kapseli kahdesti vuorokaudessa).
Jos käytät verapamiilia sisältäviä lääkkeitä, Dabigatran etexilate Krka -annoksesi pitää pienentää 220 mg:aan (yksi 110 mg:n kapseli kahdesti vuorokaudessa), koska verenvuotoriskisi voi olla suurentunut.
Jos verenvuotoriskisi on mahdollisesti suurentunut, lääkäri saattaa määrätä 220 mg:n Dabigatran etexilate Krka -annoksen (yksi 110 mg:n kapseli kahdesti vuorokaudessa).
Voit jatkaa Dabigatran etexilate Krka -valmisteen ottamista, jos sydämesi syke täytyy palauttaa normaaliksi toimenpiteellä, jota kutsutaan rytminsiirroksi (kardioversio), tai sinulle täytyy tehdä eteisvärinän vuoksi toimenpide, jota kutsutaan katetriablaatioksi. Ota Dabigatran etexilate Krka -valmistetta lääkärin ohjeen mukaan.
Jos verisuoneesi on asetettu suonta auki pitävä lääkinnällinen laite (stentti) perkutaanisen sepelvaltimotoimenpiteen (pallolaajennus) yhteydessä, voit saada Dabigatran etexilate Krka -hoitoa lääkärin varmistettua, että veren hyytyminen on normaalia. Ota Dabigatran etexilate Krka -valmistetta lääkärin ohjeen mukaan.
Veritulppien hoito ja niiden uusiutumisen ehkäisy lapsilla
Dabigatran etexilate Krka otetaan kaksi kertaa vuorokaudessa, yksi annos aamulla ja yksi illalla. Annokset otetaan joka päivä suunnilleen samaan aikaan. Annosvälin on oltava mahdollisimman lähellä 12:ta tuntia.
Suositeltu annos riippuu potilaan painosta ja iästä. Lääkäri määrää oikean annoksen. Lääkäri voi muuttaa annosta myöhemmin hoidon aikana. Kaikkien muiden lääkkeiden käyttöä on jatkettava, paitsi jos lääkäri kehottaa lopettamaan jonkin lääkkeen käytön.
Taulukossa 1 on esitetty Dabigatran etexilate Krka -valmisteen kerta-annokset ja kokonaisvuorokausiannokset milligrammoina (mg). Annokset riippuvat potilaan painosta (kg) ja iästä (vuosina).
Taulukko 1: Annostustaulukko Dabigatran etexilate Krka -kapseleille
| Painon ja iän yhdistelmät | Kerta-annos (mg) | Kokonaisvuorokausiannos (mg) | |
| Paino (kg) | Ikä vuosina | ||
| 11 – alle 13 kg | 8 – alle 9 vuotta | 75 | 150 |
| 13 – alle 16 kg | 8 – alle 11 vuotta | 110 | 220 |
| 16 – alle 21 kg | 8 – alle 14 vuotta | 110 | 220 |
| 21 – alle 26 kg | 8 – alle 16 vuotta | 150 | 300 |
| 26 – alle 31 kg | 8 – alle 18 vuotta | 150 | 300 |
| 31 – alle 41 kg | 8 – alle 18 vuotta | 185 | 370 |
| 41 – alle 51 kg | 8 – alle 18 vuotta | 220 | 440 |
| 51 – alle 61 kg | 8 – alle 18 vuotta | 260 | 520 |
| 61 – alle 71 kg | 8 – alle 18 vuotta | 300 | 600 |
| 71 – alle 81 kg | 8 – alle 18 vuotta | 300 | 600 |
| vähintään 81 kg | 10 – alle 18 vuotta | 300 | 600 |
Kerta-annokset, jotka vaativat useampien kapselien yhdistelmiä:
300 mg: kaksi 150 mg:n kapselia tai neljä 75 mg:n kapselia
260 mg: yksi 110 mg:n kapseli ja yksi 150 mg:n kapseli tai yksi 110 mg:n kapseli ja kaksi 75 mg:n kapselia
220 mg: kaksi 110 mg:n kapselia
185 mg: yksi 75 mg:n kapseli ja yksi 110 mg:n kapseli
150 mg: yksi 150 mg:n kapseli tai kaksi 75 mg:n kapselia
Miten Dabigatran etexilate Krka -kapseleita otetaan
Dabigatran etexilate Krka voidaan ottaa ruuan kanssa tai ilman ruokaa. Kapseli niellään kokonaisena vesilasillisen kera, jotta varmistetaan lääkkeen kulkeutuminen mahaan. Älä riko tai pureskele kapselia äläkä tyhjennä kapselin sisältöä, koska se voi suurentaa verenvuodon riskiä.
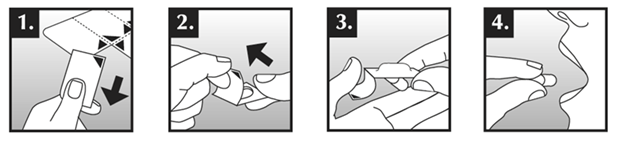
Läpipainopakkauksen avaamisohjeet
Seuraavissa kuvissa on esitetty, kuinka Dabigatran etexilate Krka -kapselit otetaan läpipainopakkauksesta.
Kapselin poistaminen läpipainopakkauksesta:
- Pidä kiinni läpipainolevyn kulmasta ja irrota yksi kapselilokero varovasti levystä repäisylinjaa myöten.
- Nosta suojafolion reunaa ja vedä se auki.
- Pudota kapseli kädellesi.
- Niele kapseli kokonaisena vesilasillisen kera.
- Älä paina kapseleita läpipainopakkauksen folion läpi.
- Älä avaa läpipainopakkauksen suojafoliota ennen kuin tarvitset kapselin.
Ohjeet purkkia varten
- Avaa painamalla ja kiertämällä.
- Kun olet ottanut kapselin, sulje purkki tiiviisti korkilla heti annoksen ottamisen jälkeen.
Veren hyytymistä estävän lääkityksen vaihto
Älä muuta veren hyytymistä estävää lääkitystäsi, ellet ole saanut tarkkoja ohjeita lääkäriltä.
Jos otat enemmän Dabigatran etexilate Krka -valmistetta kuin sinun pitäisi
Liian suuren Dabigatran etexilate Krka -annoksen ottaminen suurentaa verenvuotoriskiä. Ota välittömästi yhteyttä lääkäriin, jos olet ottanut liian monta Dabigatran etexilate Krka -kapselia. Erityisiä hoitovaihtoehtoja on olemassa.
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Jos unohdat ottaa Dabigatran etexilate Krka -valmistetta
Unohtunut annos voidaan vielä ottaa, jos seuraavan annoksen ottamiseen on vähintään 6 tuntia.
Jätä unohtunut annos väliin, jos seuraavan annoksen ottamiseen on alle 6 tuntia. Älä ota kaksinkertaista annosta korvataksesi unohtamasi kerta-annoksen.
Jos lopetat Dabigatran etexilate Krka -valmisteen oton
Ota Dabigatran etexilate Krka -valmistetta täsmälleen ohjeiden mukaisesti. Älä lopeta Dabigatran etexilate Krka -valmisteen käyttöä keskustelematta ensin lääkärin kanssa, sillä veritulpan riski voi suurentua, jos hoito lopetetaan liian aikaisin. Ota yhteyttä lääkäriin, jos sinulla esiintyy ruoansulatushäiriöitä Dabigatran etexilate Krka -valmisteen ottamisen jälkeen.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Dabigatran etexilate Krka vaikuttaa veren hyytymiseen, joten suurin osa haittavaikutuksista liittyy mustelmien tai verenvuodon kaltaisiin oireisiin.
Merkittäviä tai vakavia vuotoja saattaa esiintyä. Nämä ovat vakavimpia haittavaikutuksia, ja riippumatta sijaintipaikasta ne saattavat olla invalidisoivia tai henkeä uhkaavia tai jopa johtaa kuolemaan. Verenvuotoa ei ole aina helppoa huomata.
Jos sinulla on mitä tahansa verenvuotoa, joka ei lopu itsestään tai jos sinulla on oireita voimakkaasta verenvuodosta (voimakas heikotus, väsymys, kalpeus, huimaus, päänsärky tai selittämätön turvotus), kysy neuvoa lääkäriltä välittömästi. Lääkäri saattaa seurata tilaasi tarkemmin tai vaihtaa lääkityksesi.
Kerro lääkärille välittömästi, jos saat vakavan allergisen reaktion, joka aiheuttaa hengitysvaikeuksia tai heitehuimausta.
Mahdolliset haittavaikutukset on lueteltu alla, ja ne on ryhmitelty esiintymistodennäköisyytensä perusteella.
Aivoveritulpan ja muiden veritulppien ehkäisy rytmihäiriöpotilailla
Yleinen (saattaa ilmetä enintään 1 henkilöllä 10:stä):
- verenvuoto nenästä mahaan tai suolistoon, peniksestä/emättimestä tai virtsateistä (sisältäen veren esiintymisen virtsassa, mikä värjää virtsan vaaleanpunaiseksi tai punaiseksi) tai ihon alle
- veren punasolujen määrän väheneminen
- maha- tai vatsakipu
- ruoansulatushäiriö
- löysä vatsa, ripuli
- pahoinvointi
Melko harvinainen (saattaa ilmetä enintään 1 henkilöllä 100:sta):
- verenvuoto
- verenvuoto peräpukamista tai peräsuolesta tai aivoverenvuoto
- verenpurkaumien (mustelmien) muodostuminen
- veren yskiminen tai veriset yskökset
- verihiutaleiden määrän väheneminen veressä
- hemoglobiinin (punasolujen sisältämän aineen) määrän väheneminen veressä
- allerginen reaktio
- äkillinen ihomuutos, joka vaikuttaa ihon väriin ja ulkonäköön
- kutina
- maha- tai suolistohaava (myös ruokatorven haava)
- ruokatorvi- ja mahatulehdus
- mahahapon nousu ruokatorveen
- oksentelu
- nielemisvaikeus
- epänormaalit laboratorioarvot maksan toimintakokeissa
Harvinainen (saattaa ilmetä enintään 1 henkilöllä 1 000:sta):
- verenvuoto niveleen leikkausviillosta, vammasta, pistoskohdasta tai kohdasta, jossa katetri yhdistyy suoneen
- vakava allerginen reaktio, joka aiheuttaa hengitysvaikeuksia tai heitehuimausta
- vakava allerginen reaktio, joka aiheuttaa kasvojen tai kurkun turpoamista
- allergisen reaktion aiheuttama ihottuma, joka ilmenee tummanpunaisina, kohonneina, kutisevina paukamina
- verisolujen osuuden pieneneminen
- maksaentsyymiarvojen suureneminen
- ihon tai silmänvalkuaisten keltaisuus maksavaivojen tai veriarvojen muutosten vuoksi
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin):
- hengitysvaikeudet ja hengityksen vinkuminen
- valkosolujen (auttavat torjumaan infektioita) määrän väheneminen tai jopa valkosolujen puuttuminen
- hiustenlähtö
Kliinisessä tutkimuksessa sydänkohtausten määrä oli dabigatraanieteksilaattia käyttävillä lukumääräisesti suurempi kuin varfariinia käyttävillä. Kaiken kaikkiaan sydänkohtauksia havaittiin vähän.
Veritulppien hoito jalkojen laskimoissa ja keuhkoverisuonissa ja veritulppien uusiutumisen ehkäisy jalkojen laskimoissa ja keuhkoverisuonissa
Yleinen (saattaa ilmetä enintään 1 henkilöllä 10:stä):
- verenvuoto nenästä mahaan tai suolistoon, peräsuolesta, peniksestä/emättimestä tai virtsateistä (sisältäen veren esiintymisen virtsassa, mikä värjää virtsan vaaleanpunaiseksi tai punaiseksi) tai ihon alle
- ruoansulatushäiriö
Melko harvinainen (saattaa ilmetä enintään 1 henkilöllä 100:sta):
- verenvuoto
- verenvuoto niveleen tai vammasta
- verenvuoto peräpukamista
- veren punasolujen määrän väheneminen
- verenpurkaumien (mustelmien) muodostuminen
- veren yskiminen tai veriset yskökset
- allerginen reaktio
- äkillinen ihomuutos, joka vaikuttaa ihon väriin ja ulkonäköön
- kutina
- maha- tai suolistohaava (myös ruokatorven haava)
- ruokatorvi- ja mahatulehdus
- mahahapon nousu ruokatorveen
- pahoinvointi
- oksentelu
- maha- tai vatsakipu
- löysä vatsa, ripuli
- epänormaalit laboratorioarvot maksan toimintakokeissa
- maksaentsyymiarvojen suureneminen
Harvinainen (saattaa ilmetä enintään 1 henkilöllä 1 000:sta):
- verenvuoto leikkausviillosta, pistoskohdasta tai kohdasta, jossa katetri yhdistyy suoneen, tai aivoverenvuoto
- verihiutaleiden määrän väheneminen veressä
- vakava allerginen reaktio, joka aiheuttaa hengitysvaikeuksia tai heitehuimausta
- vakava allerginen reaktio, joka aiheuttaa kasvojen tai kurkun turpoamista
- allergisen reaktion aiheuttama ihottuma, joka ilmenee tummanpunaisina, kohonneina, kutisevina paukamina
- nielemisvaikeus
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin):
- hengitysvaikeudet ja hengityksen vinkuminen
- hemoglobiinin (punasolujen sisältämän aineen) määrän väheneminen veressä
- verisolujen osuuden pieneneminen
- valkosolujen (auttavat torjumaan infektioita) määrän väheneminen tai jopa valkosolujen puuttuminen
- ihon tai silmänvalkuaisten keltaisuus maksavaivojen tai veriarvojen muutosten vuoksi
- hiustenlähtö
Tutkimusohjelmassa sydänkohtausten määrä oli dabigatraanieteksilaattia käyttävillä suurempi kuin varfariinia käyttävillä. Kaiken kaikkiaan sydänkohtauksia havaittiin vähän. Dabigatraania käyttäneiden ja lumelääkettä saaneiden potilaiden sydänkohtausten lukumäärissä ei havaittu eroa.
Veritulppien hoito ja niiden uusiutumisen ehkäisy lapsilla
Yleinen (saattaa ilmetä enintään 1 henkilöllä 10:stä):
- veren punasolujen määrän väheneminen
- verihiutaleiden määrän väheneminen veressä
- allergisen reaktion aiheuttama ihottuma, joka ilmenee tummanpunaisina, kohonneina, kutisevina paukamina
- äkillinen ihomuutos, joka vaikuttaa ihon väriin ja ulkonäköön
- verenpurkaumien (mustelmien) muodostuminen
- verenvuoto nenästä
- mahahapon nousu ruokatorveen
- oksentelu
- pahoinvointi
- löysä vatsa, ripuli
- ruoansulatushäiriö
- hiustenlähtö
- maksaentsyymiarvojen suureneminen
Melko harvinainen (saattaa ilmetä enintään 1 henkilöllä 100:sta):
- valkosolujen (auttavat torjumaan infektioita) määrän väheneminen
- verenvuoto mahaan tai suolistoon, aivoista, peräsuolesta, peniksestä/emättimestä tai virtsateistä (sisältäen veren esiintymisen virtsassa, mikä värjää virtsan vaaleanpunaiseksi tai punaiseksi) tai ihon alle
- hemoglobiinin (punasolujen sisältämän aineen) määrän väheneminen veressä
- verisolujen osuuden pieneneminen
- kutina
- veren yskiminen tai veriset yskökset
- maha- tai vatsakipu
- ruokatorvi- ja mahatulehdus
- allerginen reaktio
- nielemisvaikeus
- ihon tai silmänvalkuaisten keltaisuus maksavaivojen tai veriarvojen muutosten vuoksi
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin):
- valkosolujen (auttavat torjumaan infektioita) puuttuminen
- vakava allerginen reaktio, joka aiheuttaa hengitysvaikeuksia tai heitehuimausta
- vakava allerginen reaktio, joka aiheuttaa kasvojen tai kurkun turpoamista
- hengitysvaikeudet ja hengityksen vinkuminen
- verenvuoto
- verenvuoto niveleen tai vammasta, leikkausviillosta, pistoskohdasta tai kohdasta, jossa katetri yhdistyy suoneen
- verenvuoto peräpukamista
- maha- tai suolistohaava (myös ruokatorven haava)
- epänormaalit laboratorioarvot maksan toimintakokeissa
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä kotelossa ja läpipainopakkauksessa tai purkin etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Läpipainopakkaus:
Tämä lääke ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä valolle. Herkkä kosteudelle.
Purkki:
Tämä lääke ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä valolle. Herkkä kosteudelle.
Pidä purkki tiiviisti suljettuna.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Dabigatran etexilate Krka sisältää
- Vaikuttava aine on dabigatraanieteksilaatti. Yksi kova kapseli sisältää 150 mg dabigatraanieteksilaattia (dabigatraanieteksilaattimesilaattina).
- Muut aineet kapselin sisällä ovat viinihappo, hypromelloosi, hydroksipropyyliselluloosa ja talkki.
- Muut aineet kapselin kuoressa ovat titaanidioksidi (E171), indigokarmiini (E132), karrageeni, kaliumkloridi ja hypromelloosi.
- Muut aineet painovärissä ovat shellakka, musta rautaoksidi (E172) ja kaliumhydroksidi.
Lääkevalmisteen kuvaus ja pakkauskoot
Dabigatran etexilate Krka 150 mg kovat kapselit (kapselit): Kapselin kansi on sininen, kapselissa runko on valkoinen tai lähes valkoinen ja siihen on painettu pituussuunnassa musta merkintä ”150”. Kapselin pituus: noin 24 mm.
Kapselin sisällä on kellertävän valkoisia tai vaaleankeltaisia pellettejä.
Dabigatran etexilate Krka 150 mg kovat kapselit ovat saatavilla rasioissa, joissa on:
- 10 x 1, 30 x 1, 60 x 1 tai 100 x 1 kovaa kapselia, tai monipakkauksissa, joissa on 100 (2 x 50 x 1) tai 180 (3 x 60 x 1) kovaa kapselia yksittäispakatuissa läpipainopakkauksissa, joissa on irti vedettävä suojakalvo.
- 60 kovaa kapselia purkissa, jossa on sinetöity lapsiturvallinen korkki.
- tai 3 purkkia, joissa jokaisessa 60 kovaa kapselia. Purkeissa on sinetöity lapsiturvallinen korkki.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija ja valmistaja
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Slovenia
Myyntiluvan haltijan paikallinen edustaja
KRKA Finland oy, Bertel Jungin aukio 5, 02600 Espoo, Suomi
Tämä pakkausseloste on tarkistettu viimeksi 20.10.2023
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Lääkealan turvallisuus- ja kehittämiskeskus Fimean verkkosivuilla www.fimea.fi.