Pakkausseloste
MENOPUR pulver och vätska till injektionsvätska, lösning 600 IU
Tilläggsinformation
menotropin
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Menopur är och vad det används för
2. Vad du behöver veta innan du använder Menopur
3. Hur du använder Menopur
4. Eventuella biverkningar
5. Hur Menopur ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Detta läkemedel tillhandahålls som ett pulver som ska lösas upp i vätska (lösningsmedel) före användning. Det är avsett för injektion under huden.
Det aktiva innehållsämnet i Menopur är högrenat och kallas menotropin. Menotropin är utvunnet ur urin från kvinnor i övergångsåldern (menopaus) och innehåller tre hormoner: follikelstimulerande hormon (FSH), humant koriongonadotropin (hCG) och luteiniserande hormon (LH).
hCG som är utvunnet ur urin från gravida kvinnor kan tillsättas i Menopur för att bidra till den totala LH-bioaktiviteten.
FSH, hCG och LH är naturliga hormoner producerade i kvinnor. De hjälper produktionsorganen att fungera normalt.
Menopur används för behandling av kvinnlig infertilitet (barnlöshet) i följande två situationer:
i. Kvinnor som inte kan bli gravida för att deras äggstockar inte producerar ägg (inklusive kvinnor som lider av polycystiskt ovariesyndrom, en sjukdom som ger cystbildning i äggstockarna). Menopur används till kvinnor som ej har svarat på behandling med klomifencitrat (ett annat läkemedel som används för att behandla infertilitet).
ii. Kvinnor som genomgår reproduktionsteknologi för assisterad befruktning (ART) inklusive in vitro fertilisering/embryo transfer (IVF/ET), ”gamete intra-fallopian transfer” (GIFT) och intra-cytoplasmatisk spermieinjektion (ICSI).
Menopur stimulerar kvinnans äggstockar till att utveckla flera äggblåsor (folliklar), i vilka ägg kan mogna (multipel follikelutveckling).
Högrenat menotropin som finns i Menopur kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apoteks- eller annan hälso- och sjukvårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Innan behandlingen med Menopur påbörjas ska din och din partners fruktsamhet utvärderas. Uppmärksamhet ska göras speciellt på följande tillstånd så att en eventuell annan passande behandling kan ges:
- Nedsatt aktivitet i sköldkörtel eller binjurar
- Hög koncentration av ett hormon som kallas prolaktin (hyperprolaktinemi)
- Tumörer i hypofysen (en hormonproducerande körtel i hjärnan)
- Tumörer i hypotalamus (ett område lokaliserat i hjärnan som kallas thalamus)
Om du vet att du har något av de tillstånd listade ovan, tala om detta för läkaren innan du påbörjar behandling med Menopur.
Använd inte Menopur
- om du är allergisk mot menotropin eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- om du har tumörer i livmodern (uterus), äggstockarna, brösten, eller delar av hjärnan såsom hypofysen eller hypotalamus
om du har vätskefyllda cystor (ovariecystor) på äggstockarna, eller förstorade äggstockar som inte beror på polycystiskt ovariesyndrom (blåsor på äggstockarna)
- om du har missbildningar av livmodern (uterus ) eller sexualorganen
- om du har gynekologisk blödning utan känd orsak
- om du har myom (godartade muskelknutor) i livmodern (uterus)
- om du är gravid eller ammar
- om du tidigt har kommit i övergångsåldern
Varningar och försiktighet
Tala med läkare
- om du får magsmärtor
- om du får svullnad i buken
- om du blir illamående
- om du får kräkning
- om du får diarré
- om du upplever viktökning
- om du får andningsproblem
- om du får minskad urinproduktion
Informera omedelbart läkaren även om symtomen kommer några dagar efter den sista injektionen har givits. Det kan vara tecken på förhöjd aktivitet i äggstockarna som kan leda till allvarliga konsekvenser.
Om något av dessa symtom blir allvarligt ska infertilitetsbehandlingen avbrytas och du bör få behandling på sjukhus.
Om den rekommenderade dosen följs och noggrann övervakning av din behandling sker, minskar risken för dessa symtom.
Om du slutar att använda Menopur, kan du ändå få dessa symtom. Kontakta i dessa fall omedelbart läkare.
Då du behandlas med detta läkemedel gör läkaren vanligtvis ultraljudsundersökningar av äggstockarna med jämna mellanrum och ibland tas även blodprov för att övervaka svaret på behandlingen.
Behandling med hormoner som Menopur kan öka risken för:
- Ektopisk graviditet (utomkvedshavandeskap), hos kvinnor med tidigare skada i äggledarna
- Missfall
- Flerbörd (fler än ett foster)
- Medfödda missbildningar hos barnet
Enstaka kvinnor som har fått flera olika läkemedel för behandling mot barnlöshet har utvecklat tumörer i äggstockarna eller i andra könsorgan. Det är ännu okänt om behandling med hormoner som Menopur kan orsaka dessa problem.
Risken för blodproppsbildning på insidan av blodkärl (vener och artärer) förekommer oftare hos gravida kvinnor. Behandling av infertilitet kan öka risken för att detta sker, speciellt om du har kraftig övervikt eller har en sjukdom med blodproppsbildning (trombofili) eller om någon i din familj (föräldrar eller syskon) har blodproppssjukdom. Tala om för läkaren om detta stämmer in på dig.
Barn
Menopur är inte avsett för användning hos barn.
Andra läkemedel och Menopur
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel, även receptfria sådana.
Klomifencitrat är ett annat läkemedel som används för behandling av infertilitet. Om Menopur används tillsammans med klomifencitrat kan detta leda till ökad follikelreaktion.
Graviditet och amning
Menopur får inte användas under graviditet och amning.
Körförmåga och användning av maskiner
Det är osannolikt att detta läkemedel har effekter på förmågan att köra bil eller använda maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Menopur innehåller natrium
Menopur innehåller mindre än 1 mmol natrium (23 mg) per dos, d.v.s. är näst intill ”natriumfritt”.
Hur produkten används
Använd alltid Menopur enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
i. Behandling av kvinnor som inte har ägglossning:
Behandling bör påbörjas inom de 7 första dagarna av din menstruationscykel (dag 1 är den dag du får din menstruation). Behandling ska ges varje dag under minst 7 dagar.
En vanlig startdos är 75-150 IE per dag men kan anpassas efter behandlingssvaret upp till maximalt 225 IE per dag. Samma dos ska ges under 7 dagar innan din läkare gör en dosjustering. Rekommenderad dosökning är 37,5 IE per justering (och inte mer än 75 IE). Om behandlingen inte gett resultat efter 4 veckor ska behandlingscykeln avslutas.
När ett optimalt svar har uppnåtts, får du en injektion på 5000- 10 000 IE av ett annat hormon kallat humant koriongonadotropin (hCG) en dag efter den sista Menopurdosen. Du rekommenderas att ha samlag denna dag och dagen därpå. Alternativt kan intrauterin insemination (införing av sperma direkt i livmodern) utföras. Du kommer att följas upp av läkaren under minst två veckor efter det att du fått hCG-injektionen.
Läkaren kommer att följa effekten av behandlingen med Menopur. Beroende på utvecklingen kan läkaren välja att avbryta behandlingen med Menopur och inte ge dig en hCG-injektion. Om detta inträffar kommer du att bli uppmanad att avhålla dig från samlag eller använda icke-hormonell preventivmetod (t ex kondom) till din nästa menstruation har startat.
ii. Behandling av kvinnor i samband med assisterad reproduktionsteknologi (ART):
Om du också får behandling med en GnRH-agonist (ett läkemedel som hjälper ett hormon kallat gonadotropin-frisättande hormon (GnRH) att fungera), bör Menopur behandlingen starta ungefär två veckor efter det att behandling med GnRH-agonist startat.
Om du också får behandling med GnRH-antagonist ska behandlingen med Menopur starta på 2:a eller 3:e dagen av menstruationscykeln (1:a dag är första blödningsdag).
Menopur ska ges varje dag under minst 5 dagar. En vanlig startdos av Menopur är 150-225 IE. Denna dos avpassas till din respons på behandlingen och kan ökas upp till maximalt 450 IE per dag. Varje enskild dosändring bör inte vara större än 150 IE. I de flesta fall bör behandlingen inte pågå mer än 20 dagar.
Om det finns tillräckligt med äggblåsor (folliklar), ges en injektion av upp till 10 000 IE humant koriongonadotropin (hCG) för att framkalla slutgiltig äggmognad.
Du kommer att följas upp av läkaren under minst två veckor efter det att du fått hCG-injektionen.
Läkaren kommer att följa effekten av behandlingen med Menopur. Beroende på utvecklingen kan läkaren välja att avbryta behandlingen med Menopur och inte ge dig en hCG-injektion. Om detta inträffar kommer du att bli uppmanad att avhålla dig från samlag eller använda icke-hormonell preventivmetod (t ex kondom) till din nästa menstruation har startat.
Bruksanvisning
Om kliniken bett dig att själv injicera Menopur ska du följa deras instruktioner.
Den första injektionen av Menopur bör ges under tillsyn av läkare eller sjuksköterska.
Menopur tillhandahålls som ett pulver i en injektionsflaska som ska lösas upp av spädningsvätskan i en spruta innan det injiceras. Spädningsvätskan som du ska lösa upp Menopur i erhålls i en förfylld spruta som finns i förpackningen
Menopur 600 IE ska lösas i innehållet av en förfylld spruta med spädningsvätska före användning.
Efter pulvret lösts i spädningsvätskan, innehåller injektionsflaskan läkemedel för flera dagars behandling. Du måste därför vara noggrann med att endast dra upp så mycket läkemedel som läkaren ordinerat.
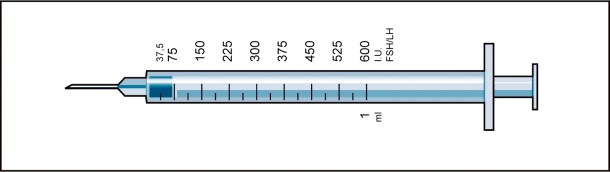
Läkaren har ordinerat en dos Menopur angiven i IE (enheter). För att erhålla rätt dos ska du använda en av de 9 medföljande injektionssprutorna som är graderade i FSH/LH IE (enheter). På sprutan uttrycks detta som IU (units).
För att göra detta:
 |
 |
 |
 |
 |
 |
| 1 | 2 | 3 | 4 | ||
- Ta bort skyddskapsylen från injektionsflaskan med pulver och skyddshatten från den förfyllda sprutan med spädningsvätska (bild 1).
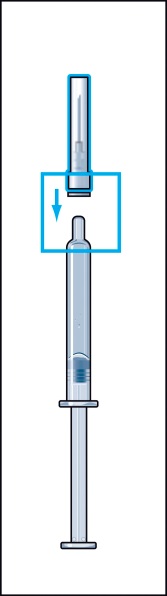
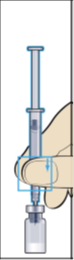
- Sätt fast den tjocka nålen (nål för beredning) i den förfyllda sprutan med spädningsvätska och ta bort skyddshatten från nålen (bild 2).
- Håll nålen lodrätt och stick den genom mitten på gummiproppen på injektionsflaskan med pulver och spruta sakta in all spädningsvätska för att undvika bubblor (bild 3).
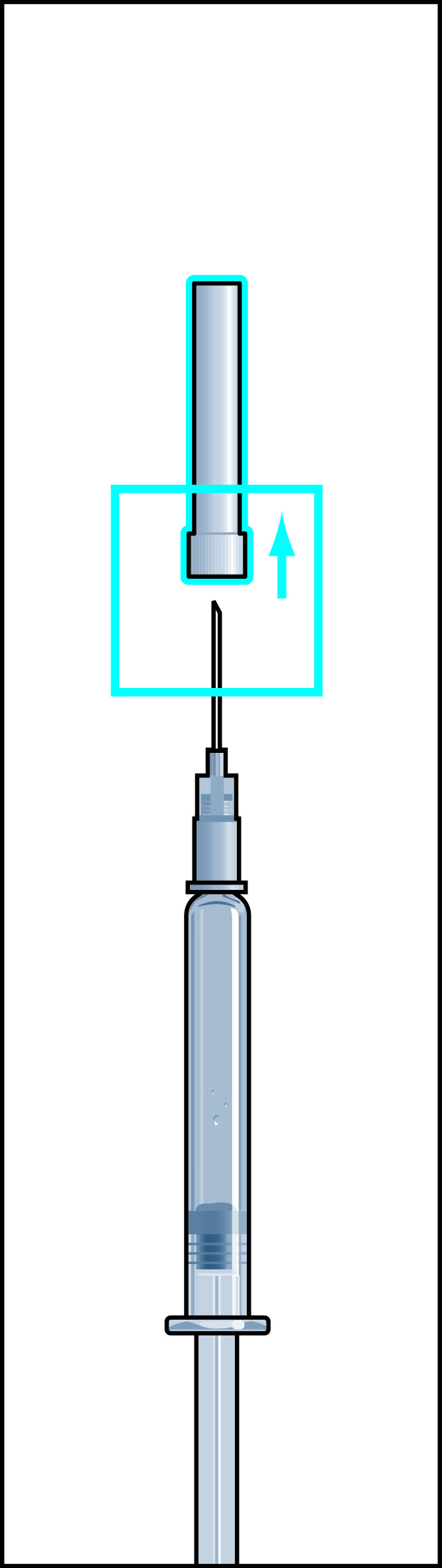
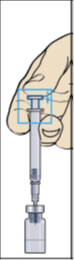
- När spädningsvätskan överförs till injektionsflaskan uppstår ett litet övertryck. Låt därför sprutkolven glida upp av sig själv under cirka 10 sekunder. Detta gör att övertrycket i injektionsflaskan försvinner (bild 4).
Ta bort sprutan och nålen för beredning.
 |
 |
 |
 |
  |
| 5 | 6 | 7 | 8 | |
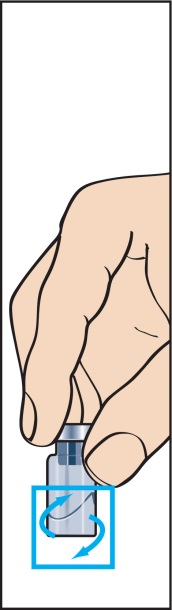
5. Pulvret ska lösa sig snabbt (inom 2 minuter) och ge en klar lösning. Även om detta normalt inträffar efter det att endast några droppar har överförts till injektionsflaskan, ska hela mängden spädningsvätska överföras. Rulla på flaskan för att få pulvret att lösa sig (bild 5). Skaka inte flaskan eftersom det då kan bildas bubblor.
Lösningen ska inte användas om den innehåller partiklar eller om den är grumlig.
Pulvret i injektionsflaskan är nu upplöst med innehållet av en spruta och lösningen är färdig att användas.
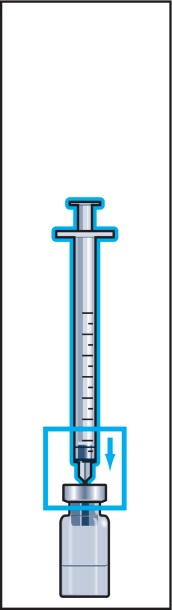
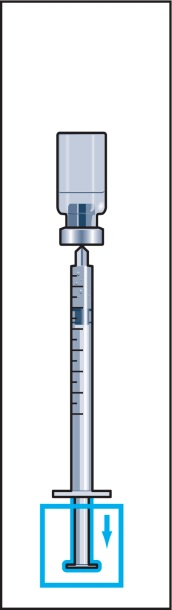
6. Håll injektionssprutan med fast nål lodrätt och stick in nålen i mitten på injektionsflaskan. Injektionssprutan innehåller en liten mängd luft som ska injiceras ovanför vätskan. Vänd flaskan upp- och ner och dra upp ordinerad dos Menopur i injektionssprutan (bild 6).
KOM IHÅG: Eftersom injektionsflaskan innehåller läkemedel för flera dagars behandling måste du vara noggrann med att endast dra upp så mycket läkemedel som läkaren ordinerat.
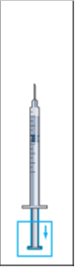
7. Avlägsna sprutan från injektionsflaskan och dra upp en liten mängd luft i sprutan (bild 7)
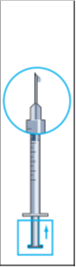
8. Knacka försiktigt på injektionssprutan för att få upp alla bubblor i toppen (bild 8). Pressa försiktigt på sprutan tills den första droppen vätska kommer ut från nålen.
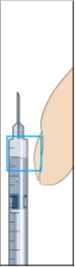
Läkaren eller sjuksköterskan kommer att berätta var du ska injicera (t ex framsidan på låret, magen etc.). Rengör injektionsstället före injektion.
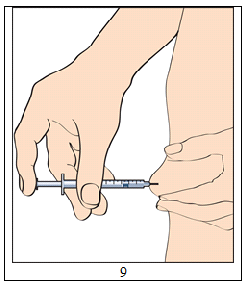
9. För att injicera; greppa ett hudveck och stick in nålen med en snabb rörelse i 90 graders vinkel mot kroppen. Pressa in kolven försiktigt för att injicera lösningen (bild 9) och ta sedan bort injektionssprutan.
Efter att injektionssprutan tagits bort, tryck på injektionsstället för att stoppa eventuell blödning. Massera försiktigt injektionsstället för att fördela lösningen under huden.
Kasta inte använt material i soporna, det ska kasseras på lämpligt sätt.
10. För ytterligare injektion från redan beredd Menopurlösning upprepa steg 6 till 9.
Om du använt för stor mängd av Menopur
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112 i Sverige, 0800 147 111 i Finland) för bedömning av risken samt rådgivning.
Om du har glömt att använda Menopur
Ta inte dubbel dos för att kompensera för glömd dos. Tala om det för läkare eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Hormoner, såsom Menopur, som används för behandling av infertilitet kan orsaka förhöjd aktivitet i äggstockarna och kan leda till ett sjukdomstillstånd som kallas ovariellt hyperstimuleringssyndrom (OHSS), speciellt hos kvinnor med polycystiskt ovariesyndrom. Symtomen omfattar magsmärtor, buksvullnad, illamående, kräkning, diarré, viktökning. I fall av svår OHSS har vätskeansamling i buk, bäcken och/eller brösthåla, andningsbesvär, minskad urinproduktion, blodproppsbildning i blodkärl (tromboembolism) och vridning av äggstockarna (ovarietorsion) rapporterats som sällsynta komplikationer. Om du upplever något av dessa symtom ska du omedelbart kontakta läkare även om symtomet kommer några dagar efter den sista injektionen har givits.
Allergiska reaktioner (överkänslighet) kan förekomma vid användning av detta läkemedel. Symtomen på dessa reaktioner kan vara hudutslag, klåda, svullnad i halsen och andningsproblem. Om du upplever något av dessa symtom ska du omedelbart kontakta läkare.
Följande vanliga biverkningar förekommer hos mellan 1 och 10 av 100 behandlade patienter:
- Magsmärtor
- Huvudvärk
- Illamående
- Svullnad i buken
- Bäckensmärta
- Överstimulering av äggstockarna som leder till förhöjd aktivitet (ovariellt hyperstimuleringssyndrom)
- Lokala reaktioner vid injektionsstället (såsom smärta, rodnad, blåmärken, svullnad och/eller klåda)
Följande mindre vanliga biverkningar förekommer hos mellan 1 och 10 av 1000 behandlade patienter:
- Kräkning
- Obehagskänsla i buken
- Diarré
- Trötthet
- Yrsel
- Vätskefyllda cystor (ovariesystor)
- Bröstbesvär (inkluderande bröstsmärta, bröstkänslighet, obehagskänsla i bröstet, smärta i bröstvårtor och bröstsvullnad)
- Värmevallning
Följande sällsynta biverkningar förekommer hos mellan 1 och 10 av 10 000 behandlade patienter
- Akne
- Utslag
I tillägg till ovanstående så har nedanstående biverkningar observerats efter det att produkten börjat marknadsföras, frekvensen av dessa biverkningar är inte känd:
- Synrubbningar
- Feber
- Illamående
- Allergiska reaktioner
- Viktökning
- Smärta i muskler och leder (t ex ryggsmärta, smärta i nacke och hals samt smärta i armar och ben)
- Vridning av äggstock (ovarietorsion)som en följdkomplikation av att aktiviteten i äggstockarna blir förhöjd på grund av överstimulering
- Klåda
- Nässelutslag
- Blodproppar som en komplikation av förhöjd aktivitet i äggstockar på grund av överstimulering
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
I Sverige:
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
I Finland:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Före beredning:Förvaras i kylskåp (2°C-8°C). Får ej frysas.
Efter beredning kan lösningen förvaras i högst 28 dagar vid högst 25°C.
Den färdigberedda lösningen ska inte användas om den innehåller partiklar eller om den är grumlig.
Används före utgångsdatum som anges på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är högrenat menotropin (humant menopausalt gonadotropin, hMG) motsvarande 600 IE follikelstimulerande hormon (FSH)-bioaktivitet och 600 IE luteiniserande hormon (LH)-bioaktivitet.
Efter beredning innehåller 1 ml av den färdigberedda lösningen 600 IE högrenat menotropin.
Efter beredning innehåller 1 ml av den färdigberedda lösningen 600 IE högrenat menotropin.
Övriga innehållsämnen i pulvret är:
Laktosmonohydrat
Polysorbat 20
Dinatriumfosfatheptahydrat (används som buffert och för pH-justering)
Fosforsyra (för pH-justering)
Innehållsämnena i spädningsvätskan är:
Vatten för injektionsvätskor
Metakresol
Läkemedlets utseende och förpackningsstorlekar
Menopur är ett pulver och vätska till injektionsvätska, lösning
Produkten tillhandahålls i en förpackning med 1 injektionsflaska med pulver, 1 förfylld spruta med spädningsvätska för beredning, 1 nål för beredning, och 9 engångssprutor för administrering graderade i FSH/LH-enheter med fasta nålar.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning:
I Sverige:
Ferring Läkemedel AB
Box 4041
203 11 Malmö
I Finland:
Ferring Lääkkeet Oy
PB 23
02241 Esbo
Tillverkare:
Ferring GmbH
Wittland 11
D-24109 Kiel
Tyskland
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
Danmark, Finland, Grekland, Norge, Portugal, Sverige: MENOPUR
Italien: MEROPUR
Denna bipacksedel ändrades senast 1.12.2025