Pakkausseloste
MELOXIDYL oraalisuspensio 1,5 mg/ml
ELÄINLÄÄKEVALMISTEEN NIMI
Meloxidyl 1,5 mg/ml oraalisuspensio koiralle
VAIKUTTAVAT JA MUUT AINEET
Yksi ml sisältää:
Vaikuttava aine:
Meloksikaami 1,5 mg
Apuaine:
Natriumbentsoaatti (E211) 2 mg
Vaaleankeltainen suspensio.
KÄYTTÖAIHEET
Tulehduksen ja kivun lievittäminen koirien akuuteissa ja kroonisissa luusto- ja lihassairauksissa.
VASTA-AIHEET
Älä käytä eläimille, joilla on maha-suolikanavan sairauksia, kuten mahaärsytys ja verenvuoto, maksan, sydämen tai munuaisten vajaatoiminta ja verenvuotoa aiheuttavia sairauksia. Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
Älä käytä alle 6 viikon ikäisille koirille.
HAITTAVAIKUTUKSET
Koira:
Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): | Oksentelu1, ripuli1, verta ulosteessa1,2, mahahaava1, ohutsuolen haavauma1 Ruokahaluttomuus1, apaattisuus1 |
1Nämä haittatapahtumat ilmenevät yleensä ensimmäisellä hoitoviikolla ja ovat useimmissa tapauksissa lyhytaikaisia ja menevät ohi, kun hoito lopetetaan, mutta joissain hyvin harvinaisissa tapauksissa ne saattavat olla vakavia tai kuolemaan johtavia.
2Piilevä
Jos haittavaikutuksia ilmenee, hoito tulee keskeyttää ja ottaa yhteyttä eläinlääkäriin.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta: Lääkealan turvallisuus- ja kehittämiskeskus Fimea, www-sivusto: https://www.fimea.fi/elainlaakkeet/
KOHDE-ELÄINLAJI
Koira.

ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Annetaan suun kautta.
Annetaan ruokaan sekoitettuna.
Ensimmäisenä päivänä annetaan aloitusannos 0,2 mg meloksikaamia painokiloa kohti kerta-annoksena. Hoitoa jatketaan kerran päivässä suun kautta ylläpitoannoksella 0,1 mg meloksikaamia/paino-kg (24 tunnin välein).
Oraalisuspension voi antaa pakkauksessa olevalla mittaruiskulla. Ruisku sopii pulloon ja siinä on asteikko elopainokiloa kohti, joka vastaa ylläpitoannosta (0,1 mg meloksaamia/painokilo). Näin ollen ensimmäisenä päivänä tarvitaan kaksinkertainen ylläpitoannos.
Annostusmenetelmä mittaruiskeella:
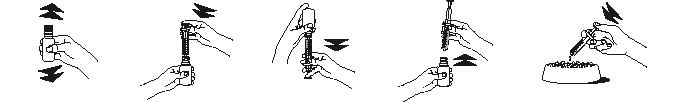
Ravista pulloa hyvin. Paina pullon tulppa alas ja ruuvaa se auki. | Kiinnitä mittaruisku pulloon työntämällä sen pää kevyesti pullon suuhun. | Käännä pullo ruiskuineen ylösalaisin Vedä männästä niin, että männän musta viiva vastaa koiran painoa kiloina. | Käännä pullo ja ruisku pystyyn ja irrota ruisku. | Tyhjennä ruiskun sisältö ruokaan painamalla männästä. |
Kliininen vaste nähdään tavallisesti 3–4 päivässä. Hoito on lopetettava viimeistään 10 päivän kuluttua, ellei mitään kliinistä paranemista havaita.
Jotta valmiste ei pilaantuisi käytön aikana, säilytä se alkuperäisessä pullossa ja käytä pakkauksen mukana toimitettua ruiskua vain valmisteen antamiseen.
ANNOSTUSOHJEET
Ravisteltava hyvin ennen käyttöä. Erityistä huomiota tulee kiinnittää tarkkaan annosteluun, ohjeannosta ei tule ylittää. Oikean annostuksen varmistamiseksi eläimen paino on määritettävä mahdollisimman tarkasti. Soveltuvalla tavalla kalibroidun mittausvälineen käyttöä suositellaan.
Oraalisuspension voi antaa alle 7 kg painoisille koirille käyttämällä pienintä ruiskua (asteikon jako vastaa 0,5 kg elopainoa) ja suurinta ruiskua yli 7 kg painoisille (asteikon jako vastaa 2,5 kg elopainoa).
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Ei erityisiä säilytysohjeita.
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu ulkopakkauksessa ja pullossa merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
Sisäpakkauksen ensimmäisen avaamisen jälkeinen kestoaika: 6 kuukautta.
ERITYISVAROITUKSET
Erityisvaroitukset: Ei ole.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Lisääntyneen munuaisvaurioriskin vuoksi valmisteen käyttöä tulee välttää kuivuneilla ja pienestä veritilavuudesta kärsivillä (hypovoleemisilla) eläimillä.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Henkilöiden, jotka ovat yliherkkiä steroideihin kuulumattomille tulehduskipulääkkeille, tulee välttää kosketusta eläinlääkkeen kanssa.
Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Tiineys ja laktaatio:
Eläinlääkkeen turvallisuutta tiineyden ja laktaation aikana ei ole selvitetty. Älä käytä tiineille tai imettäville eläimille.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Muut steroideihin kuulumattomat tulehduskipulääkkeet, diureetit, antikoagulantit, aminoglykosidiantibiootit ja voimakkaasti proteiineihin sitoutuvat aineet voivat kilpailla proteiineihin sitoutumisesta ja siten aikaansaada toksisia vaikutuksia. Valmistetta ei saa annostella yhdessä muiden steroideihin kuulumattomien tulehduskipulääkkeiden tai glukokortikosteroidien kanssa.
Aikaisempi hoito anti-inflammatorisilla aineilla saattaa lisätä haittavaikutuksia, siksi näiden lääkkeiden antamisen jälkeen tulisi odottaa ainakin 24 tuntia ennen lääkityksen aloittamista. Odotusaika riippuu kuitenkin aiemmin käytettyjen lääkeaineiden farmakokineettisistä ominaisuuksista.
Yliannostus:
Yliannostustapauksessa on käännyttävä lääkärin puoleen.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
07/2025
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary).
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Ceva Santé Animale, 10 avenue de la Ballastière, 33500 Libourne, Ranska
Puh: +800 35 22 11 51
Sähköposti: pharmacovigilance@ceva.com
Erän vapauttamisesta vastaava valmistaja:
Ceva Santé Animale, Z.I. Très le Bois, 22600 Loudéac, Ranska
Vetem SpA, Lungomare Pirandello, 8, 92014 Porto Empedocle (AG), Italia