Pakkausseloste
LUTINUS vaginaltablett 100 mg
Tilläggsinformation
progesteron
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Lutinus är och vad det används för
2. Vad du behöver veta innan du använder Lutinus
3. Hur du använder Lutinus
4. Eventuella biverkningar
5. Hur Lutinus ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Detta läkemedel finns som en vaginaltablett, som innehåller det naturliga, kvinnliga könshormonet progesteron.
Lutinus är avsett för kvinnor som behöver extra progesteron under tiden de genomgår behandling i ett program för assisterad befruktning (ART).
Progesteron verkar på livmoderslemhinnan och hjälper dig att bli gravid och behålla graviditeten när du behandlas för infertilitet (ofrivillig barnlöshet).
Vad du behöver veta innan produkten används
Lutinus ska endast användas av kvinnor som genomgår behandling i ett program för assisterad befruktning (ART). Behandlingen påbörjas den dag äggen tas ut. Läkaren kommer att informera dig om när behandlingen startar.
Använd inte Lutinus
- om du är allergisk mot progesteron eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har onormala blödningar från slidan, som inte har bedömts av läkare.
- om du får ett missfall och din läkare misstänker att en del vävnad fortfarande finns kvar i livmodern eller misstänker graviditet utanför livmodern (utomkvedshavandeskap).
- om du för närvarande har eller har haft allvarliga leverproblem.
- om du har känd eller misstänkt cancer i bröst eller könsorgan.
- om du har eller har haft blodproppar i benen, lungorna, ögonen eller någon annanstans i kroppen.
- Om du har porfyrisjukdom (en grupp av medfödda eller förvärvade störningar av vissa enzymer).
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder Lutinus.
Var särskilt försiktig och tala omedelbart om för läkaren om du drabbas av något av dessa symtom under behandling eller några dagar efter sista dosen:
- smärtor i vaderna eller bröstkorgen, plötslig andfåddhet eller upphostning av blod, vilket kan tyda på proppar i benen, hjärtat eller lungorna
- svår huvudvärk eller kräkningar, yrsel, matthet eller förändringar av syn eller tal, svaghet eller domning i en arm eller ett ben, vilket kan tyda på proppar i hjärnan eller ögonen
- förvärrade depressionssymtom
Tala med din läkare före behandling med Lutinus om du har eller har haft något av följande hälsoproblem:
- Epilepsi
- Migrän
- Astma
- Nedsatt hjärt- eller njurfunktion
- Diabetes
Barn
Det finns ingen relevant användning av Lutinus hos barn.
Andra läkemedel och Lutinus
Tala om för läkaren om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Vissa läkemedel kan påverka effekten av vaginaltabletter som innehåller progesteron. T ex karbamazepin, rifampicin och naturläkemedel som innehåller Johannesört kan minska effekten medan produkter som innehåller ketokonazol och vaginalprodukter mot svampinfektioner kan förändra verkan av progesteron.
Graviditet och amning
Lutinus kan användas under graviditetens första trimester hos kvinnor som behöver extra progesteron under tiden de genomgår behandling i ett program för assisterad befruktning (ART).
Riskerna för medfödda avvikelser, däribland missbildningar i könsorganen hos pojkar eller flickor på grund av exponering för utifrån tillfört progesteron under graviditet, har inte fullständigt fastställts.
Detta läkemedel ska inte användas under amning.
Körförmåga och användning av maskiner
Lutinus har mindre eller måttlig effekt på förmågan att framföra fordon och använda maskiner. Det kan orsaka dåsighet och/eller yrsel. Därför bör fordonsförare och användare av maskiner vara försiktiga.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Vanlig dos är 100 mg som placeras direkt i slidan tre gånger dagligen, med början den dag äggen tas ut. Behandlingen med Lutinus ska fortsätta i 30 dagar om graviditet har bekräftats.
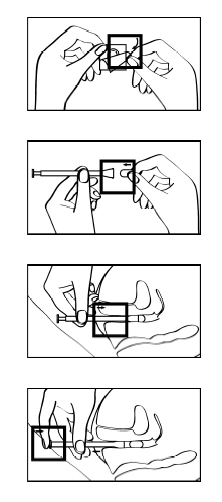
Bruksanvisning
Lutinus ska placeras direkt i slidan med hjälp av medföljande applikator (införare).
-
Lossa ett blister från blisterkartan genom att riva längs perforeringen.
-
För att ta bort folien på baksidan av blistret, börja i hörnet som har en tryckt pil.
-
Packa upp applikatorn.
-
Placera en tablett i den avsedda platsen i änden av applikatorn. Tabletten ska sitta stadigt och inte falla ut.
-
Applikatorn med tabletten kan föras in i slidan när du står, sitter eller ligger på rygg med böjda knän. För försiktigt in applikatorns smala ände högt upp i slidan.
-
Tryck på kolven så att tabletten frigörs.
Ta ut applikatorn och skölj den ordentligt i varmt, rinnande vatten, torka den torr med ett mjukt papper och spara applikatorn för senare användning.
Om du använt för stor mängd av Lutinus
Om du fått i dig för stor mängd läkemedel eller om t ex ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (i Sverige tel. 112, i Finland tel. 09-471 977) för bedömning av risken samt rådgivning.
Om du har glömt att använda Lutinus
Ta dosen så snart du kommer ihåg det och fortsätt därefter som tidigare. Ta inte dubbel dos för att kompensera för glömd dos.
Om du slutar att använda Lutinus
Rådfråga läkare eller apotekspersonal om du tänker sluta eller har slutat att använda Lutinus. Tvärt avslutad progesteronbehandling kan orsaka ökad ångest, humörförändringar och ökad mottaglighet för kramper.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
De vanligaste biverkningarna är huvudvärk, rubbningar i slidan och kramper i livmodern.
Följande vanliga biverkningar drabbar mellan 1 och 10 av 100 användare:
- Huvudvärk
- Spänd buk (svullen buk)
- Buksmärta
- Illamående
- Livmoderkramper
Följande mindre vanliga biverkningar drabbar mellan 1 och 100 av 1 000 användare:
- Yrsel
- Sömnlöshet
- Diarré
- Förstoppning
- Urtikaria (allergiska hudutslag)
- Hudutslag
- Vaginala rubbningar (t ex obehag, brännande känsla, flytning, torrhet och blödning i slidan)
- Svampinfektion i slidan
- Bröstrubbningar (t ex smärtor i brösten, svullna och ömma bröst)
- Klåda i underlivet
- Perifert ödem (svullnad på grund av vätskeansamling)
Följande biverkningar har rapporterats efter att läkemedlet marknadsförts. Ingen känd frekvens (kan inte beräknas från tillgängliga data):
- Utmattning
- Kräkning
- Allergiska reaktioner
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Du kan också rapportera biverkningar direkt.
I Sverige:
Läkemedelsverket, Box 26, 751 03 Uppsala, webbplats: www.lakemedelsverket.se .
I Finland:
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 Fimea
webbplats: www.fimea.fi
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen efter "EXP". Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i originalförpackningen. Ljuskänsligt.
Inga särskilda förvaringsanvisningar.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är progesteron.
- Varje vaginaltablett innehåller 100 mg progesteron.
- Övriga innehållsämnen är kolloidal vattenfri kiseldioxid, laktosmonohydrat, pregelatiniserad majsstärkelse, povidon, adipinsyra, natriumvätekarbonat, natriumlaurilsulfat och magnesiumstearat.
Läkemedlets utseende och förpackningsstorlekar
Detta läkemedel är en vaginaltablett. Det är en vit till benvit konvex och avlång tablett präglag med ”FPI” på ena sidan och ”100” på den andra sidan.
Förpackningsstorlek: 21 eller 90 vaginaltabletter, som levereras med en vaginalapplikator av polyetylen.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
I Sverige:
Ferring Läkemedel AB
Box 4041, 203 11 Malmö
I Finland:
Ferring Lääkkeet Oy
PB 23, 02241 Esbo Finland
Tillverkare
Ferring GmbH
Wittland 11, D-24109 Kiel, Tyskland
Detta läkemedel är godkänt inom europeiska ekonomiska samarbetsområdet under namnen
Bulgarien, Danmark, Finland, Grekland, Island, Irland, Nederländerna, Norge, Polen, Slovakien, Spanien, Sverige, Tjeckien, Tyskland, Ungern: Lutinus
Portugal: Luferti
Rumänien: Lutinus 100 mg, comprimate vaginale
Slovenien: Lutinus 100 mg vaginalne tablete
Storbritannien: Lutigest
Denna bipacksedel ändrades senast
I Finland 11.9.2018