Pakkausseloste
PAMORELIN pulver och vätska till injektionsvätska, depotsuspension 22,5 mg
Tilläggsinformation
Pamorelin 22,5 mg pulver och vätska till injektionsvätska, depotsuspension
triptorelin
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Pamorelin är och vad det används för
2. Vad du behöver veta innan du använder Pamorelin
3. Hur du använder Pamorelin
4. Eventuella biverkningar
5. Hur Pamorelin ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Pamorelin 22,5 mg innehåller triptorelin som liknar ett hormon som kallas gonadotropinfrisättande hormon (GnRH-liknande ämne). Det är en långverkande formulering som är konstruerad så att den långsamt frisätter 22,5 mg triptorelin under en 6-månadersperiod (24 veckor). Hos män sänker triptorelin nivåerna av könshormonet testosteron. Hos kvinnor sänker det nivåerna av östrogen.
Till vuxna män används Pamorelin för att behandla lokal avancerad hormonberoende prostatacancer och hormonberoende prostatacancer som har spridit sig till andra delar av kroppen (metastaserande cancer). Pamorelin används även för behandling av lokaliserad högrisk och lokalt avancerad hormonberoende prostatacancer i kombination med strålbehandling.
Till barn från 2 års ålder används Pamorelin för att behandla pubertet som uppträder i mycket låg ålder, d.v.s. före 8 års ålder hos flickor och före 10 års ålder hos pojkar så kallad för tidig könsmognad (pubertas praecox). Detta kallas ”tidig pubertet” i resten av denna information.
Vad du behöver veta innan produkten används
Använd inte Pamorelin
- Om du är allergisk mot triptorelinembonat, gonadotropinfrisättande hormon (GnRH), andra GnRH-liknande ämnen eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- Om du är gravid eller ammar.
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder Pamorelin.
- Om du känner dig nedstämd. Depression, som kan vara allvarlig, har rapporterats hos patienter som tar Pamorelin. Din läkare kan komma att vilja övervaka din depression under behandlingen.
- Om du använder läkemedel som hämmar blodets förmåga att levra sig, eftersom det kan uppstå blåmärken på injektionsstället.
- Om du får krampanfall, informera omedelbart din läkare. Det har förekommit rapporter om krampanfall hos patienter som får triptorelin eller liknande läkemedel. Dessa inträffade hos patienter med eller utan tidigare epilepsi.
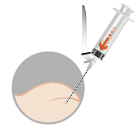
Läkemedlet ska endast ges som en injektion i en muskel (intramuskulärt).
Män
- Hos vuxna kan Pamorelin 22,5 orsaka benskörhet (osteoporos), med ökad risk för benfrakturer. Du bör därför berätta för din läkare om du har några av nedanstående riskfaktorer eftersom han/hon kan ge dig bisfosfonat (ett läkemedel som används för att behandla benskörhet). Riskfaktorer kan inkludera:
- Om du eller någon i din nära familj har benskörhet.
- Om du dricker stora mängder alkohol och/eller röker mycket och/eller har en bristfällig kosthållning.
- Om du tar läkemedel under lång tid som kan orsaka benskörhet, till exempel läkemedel mot epilepsi eller kortikosteroider (som hydrokortison eller prednisolon).
- Om du har hjärtkärlsjukdom inklusive hjärtrytmrubbningar (arytmi), eller om du tar medicin mot detta. Risken för att drabbas av hjärtrytmrubbningar kan vara förhöjd när man använder Pamorelin.
- Om du har diabetes eller har hjärt- eller kärlbesvär.
- I början av behandlingen kan en övergående ökning av testosteronhalten i din kropp uppstå. Det kan förvärra symtom av cancersjukdomen. Kontakta din läkare om du tror att detta inträffat. Läkaren kan ge dig ett läkemedel (antiandrogen) för att förhindra att symtomen förvärras.
- Under de första behandlingsveckorna kan Pamorelin, i likhet med andra GnRH-analoger, i enstaka fall orsaka smärta, domningar eller svaghet i benen (till följd av benmärgshoptryckning) eller blockering av urinvägarna. Om något av detta inträffar, kontakta omedelbart din läkare som kommer att bedöma och behandla dina symtom på bästa sätt.
- Efter kirurgisk kastration ger triptorelin ingen ytterligare minskning av testosteronkoncentrationen och Pamorelin bör därför inte användas efter bortoperation av testiklarna.
- Diagnostiska test av hypofys- eller könskörtelfunktion, utförda under behandlingen eller efter avslutad behandling med Pamorelin kan vara missvisande.
- Om du har förstorad hypofys (godartad tumör) som du inte var medveten om, kan detta upptäckas under behandlingen med Pamorelin. Symtomen är plötslig huvudvärk, kräkningar, problem med synen och ögonförlamning.
- Testosteronsänkande preparat kan orsaka förändringar i EKG associerade med hjärtrytmavvikelser (QT-förlängning).
- Behandling med GnRH-analoger, inklusive Pamorelin, kan öka risken för anemi (definierat som en minskning av antalet röda blodkroppar).
Barn
- Informera behandlande läkare om du har en progressiv hjärntumör. Detta kan påverka på vilket sätt läkaren beslutar att behandla dig.
- Flickor med tidig pubertet kan få menstruationsliknande blödningar under den första behandlingsmånaden.
- Om ditt barn lider av en svår eller återkommande huvudvärk, får problem med synen och ringningar eller surrande i öronen, kontakta omedelbart läkare (se avsnitt Eventuella biverkningar).
- När behandlingen avslutas uppstår tecken på pubertet.
Hos flickor börjar menstruationsblödningar i genomsnitt ett år efter avslutad behandling. Tidig pubertet orsakad av andra sjukdomar bör uteslutas av din läkare. Mängden mineraler i benen minskar under behandlingen men återgår till det normala efter att behandlingen avslutats. - Ett tillstånd i höften kan uppstå efter att behandlingen avslutats (s.k. glidning av femurepifysenlårbenshuvudet s.k. höftfyseolys). Det kan orsaka stelhet i höften, haltande och/eller svår smärta i ljumsken som strålar ut till låret. Om detta inträffar bör du rådfråga din läkare.
Tala med din läkare om du känner oro kring något av det som nämns ovan.
Andra läkemedel och Pamorelin
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Pamorelin kan påverka vissa andra läkemedel som används för att behandla hjärtrytmrubbningar (t.ex. kinidin, prokainamid, amiodaron och sotalol) eller kan öka risken för hjärtrytmrubbningar när det används tillsammans med andra läkemedel (t.ex. metadon (används mot smärta och vid behandling av drogberoende), moxifloxacin (ett antibiotikum), antipsykotika (används mot allvarlig psykisk sjukdom).
Graviditet, amning och fertilitet
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel.
Använd inte Pamorelin om du är gravid.
Använd inte Pamorelin om du ammar.
Körförmåga och användning av maskiner
Även om Pamorelin används enligt ordination kan biverkningar uppkomma i sådan omfattning att förmågan att framföra fordon eller använda maskiner försämras, särskilt i kombination med alkohol. Du kan känna dig yr, trött eller få problem med synen t.ex. dimsyn. Dessa är möjliga biverkningar av behandlingen eller av den underliggande sjukdomen. Om du upplever någon av dessa biverkningar, bör du inte framföra fordon eller använda maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med läkare eller apotekspersonal om du är osäker.
Pamorelin innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per injektionsflaska dvs. är näst intill ”natriumfritt” och kan tas av personer som ordinerats saltfattig kost.
Hur produkten används
Injektionerna med Pamorelin ges av sjukvårdspersonal.
Män
Behandling av prostatacancer med Pamorelin kräver behandling under lång tid.
För lokaliserad högrisk och lokalt avancerad hormonberoende prostatacancer i kombination med strålbehandling, är den rekommenderade behandlingstiden 2-3 år.
Vanlig dos av Pamorelin 22,5 mg är 1 injektionsflaska, injicerat i en muskel var sjätte månad (24 vecka). Pamorelin 22,5 mg ska endast ges som en injektion i en muskel (intramuskulärt).
Läkaren kan komma att ta blodprov för att kontrollera effekten av behandlingen.
Barn
Du kommer vanligtvis få en injektion var sjätte månad (24 vecka). Pamorelin 22,5 mg ska endast ges som en injektion i en muskel (intramuskulärt). Läkaren bestämmer när behandlingen ska avslutas (vanligtvis är det i 12-13 års åldern om du är flicka och i 13-14 års åldern om du är pojke).
Om du upplever att effekten av Pamorelin är för stark eller för svag, vänd dig till läkare eller apotekspersonal.
Om du använt för stor mängd av Pamorelin
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112 i Sverige eller tel. 0800 147 111 i Finland) för bedömning av risken samt rådgivning.
Om du har ytterligare frågor om detta läkemedel kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Sök omedelbart vård om du upplever något av följande symtom:
Svårighet att svälja eller andas, svullnad av läppar, ansikte, hals eller tunga, eller nässelutslag. Det kan vara en signal på en allvarlig allergisk reaktion eller angioödem som har rapporterats som sällsynta (kan förekomma hos upp till 1 av 1000 användare).
Andra biverkningar som kan förekomma:
Män
Som observerats vid behandling med andra GnRH-agonister eller efter kirurgisk kastration, hade de vanligast förekommande biverkningarna vid triptorelinbehandling att göra med förväntade farmakologiska effekter. Dessa effekter innefattar värmevallningar och minskad sexuell lust.
Ökat antal lymfocyter har rapporterats hos patienter under pågående behandling med GnRH-liknande ämnen. Med undantag för allergiska reaktioner och reaktioner på injektionsstället är alla biverkningar relaterade till förändrade testosteronnivåer.
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare):
- Värmevallningar
- Kraftlöshet
- Ökad svettning
- Ryggsmärta
- Myrkrypningar i benen
- Minskad sexuell lust
- Impotens
Vanliga (kan förekomma hos upp till 1 av 10 användare):
- Illamående, muntorrhet
- Smärta, blåmärke, rodnad och svullnad vid injektionsstället, muskel- och skelettsmärta, smärta i armar och ben, ödem (vätskeansamling i kroppens vävnader), smärta i nedre delen av magen, högt blodtryck
- Allergisk reaktion
- Viktökning
- Yrsel, huvudvärk
- Förlorad sexuell lust, depression, humörförändringar
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare):
- Ökat antal blodplättar
- Hjärtklappning
- Öronringningar (tinnitus), känsla av att omgivningen rör sig, dimsyn
- Magsmärtor, förstoppning, diarré, kräkningar
- Dåsighet, frossa, förknippad med svettningar och feber, sömnighet, smärta
- Påverkan på blodbilden (inklusive förhöjda leverfunktionsvärden), förhöjt blodtryck
- Viktminskning
- Aptitlöshet, ökad aptit, gikt (svår smärta och svullnad i leder, vanligtvis i stortån), diabetes, höga blodfetter
- Ledsmärta, muskelkramper, muskelsvaghet, muskelsmärta, svullnad och ömhet, skelettsmärta
- Myrkrypningar, stickningar eller domningar
- Sömnlöshet, irritabilitet
- Bröstförstoring hos män, smärta i brösten, minskad storlek på testiklarna, smärta i testiklarna
- Andningssvårigheter
- Akne, håravfall, klåda, hudutslag, hudrodnad, nässelfeber
- Att vakna på natten för att tömma urinblåsan, svårighet att tömma urinblåsan
- Näsblod
Sällsynta (kan förekomma hos upp till 1 av 1000 användare):
- Röda eller lila missfärgningar på huden
- Onormal känselförnimmelse i ögat, dimsyn eller synrubbningar
- Utspänd buk, gasbesvär, smakförändringar
- Bröstsmärta
- Svårighet att stå
- Influensaliknande symtom, feber
- Inflammation i näsan/halsen
- Förhöjd kroppstemperatur
- Stela leder, ledsvullnad, stelhet i muskler och skelett, ben- och ledinflammation (osteoartrit)
- Försämrat minne
- Förvirring, minskad aktivitet, upprymdhet
- Andnöd i liggande ställning/vila
- Blåsor
- Lågt blodtryck
Har rapporterats (förekommer hos ett okänt antal användare):
- Förändringar (QT-förlängning) i EKG (elektrokardiogram),
- Allmän obehagskänsla
- Ångest
- Urinläckage
- En ökad risk för blödning i området, om en befintlig hypofystumör
- Anemi (minskning av antalet röda blodkroppar).
Barn
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare):
- Vaginal blödning, som kan förekomma hos flickor under första månadens behandling
Vanliga (kan förekomma hos upp till 1 av 10 användare):
- Magsmärta
- Smärta, rodnad och svullnad vid injektionsstället
- Huvudvärk
- Värmevallningar
- Viktuppgång
- Akne
- Allergisk reaktion
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare):
- Dimsyn
- Kräkningar
- Förstoppning
- Illamående
- Allmän obehagskänsla
- Övervikt
- Nacksmärta
- Humörförändringar
- Smärta i brösten
- Näsblod
- Klåda
- Hudutslag eller nässelutslag
Har rapporterats (förekommer hos ett okänt antal användare):
- Högt blodtryck
- Synrubbningar
- Svår allergisk reaktion som orsakar svårighet att svälja eller andas, svullnad av läppar, ansikte, hals eller tunga, eller nässelutslag
- Krampanfall
- Förändrade blodvärden inklusive hormonnivåer
- Snabb utveckling av nässelutslag på grund av svullnad av hud eller slemhinnor
- Muskelsmärta
- Känslosvängningar
- Depression
- Nervositet
- Idiopatisk intrakraniell hypertoni (ökat intrakraniellt tryck runt hjärnan kännetecknat av huvudvärk, dubbelseende och andra visuella symtom, och ringningar eller surrande i öronen)
Din läkare kommer att avgöra vilka åtgärder som ska vidtas.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Sverige
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
Finland
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och på etiketterna efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Färdigblandad suspension ska användas omgående.
Förvaras vid högst 25 °C.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är triptorelin.
En injektionsflaska innehåller triptorelinembonat motsvarande 22,5 mg triptorelin.
Efter utspädning i 2 ml spädningsvätska innehåller 1 ml färdigblandad suspension 11,25 mg triptorelin. - Övriga innehållsämnen är:
Pulver: poly (d,l-laktid-koglykolid), mannitol, karmellosnatrium, polysorbat 80.
Spädningsvätska: vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Detta läkemedel är ett pulver och vätska till injektionsvätska, depotsuspension. Pulvret är ett vitt till benvitt pulver och spädningsvätskan är en klar lösning.
Förpackningen innehåller 1 injektionsflaska, 1 ampull och 1 blister innehållande 1 injektionsspruta och 2 injektionsnålar.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Institut Produits Synthèse (IPSEN) AB
Kista Science Tower
Färögatan 33
SE-164 51 Kista
Sverige
Tillverkare
Ipsen Pharma Biotech
Parc d’Activités du Plateau de Signes
Chemin départemental N° 402
83870 Signes
Frankrike
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
AT, DE: Pamorelin LA 22.5 mg
BE, LU: Decapeptyl Sustained Release 22.5 mg
CZ, PL, SK: Diphereline SR 22,5 mg
DK, FI, NL, NO, SE: Pamorelin 22,5 mg
EL: Arvekap 22,5 mg
ES: Decapeptyl Semestral 22.5 mg
FR: Decapeptyl LP 22.5 mg
HU: Diphereline SR 22,5 mg por és oldószer retard szuszpenziós injekcióhoz
LV: Diphereline 22,5 mg
SI: Pamorelin 22,5 mg prašek in vehikel za suspenzijo za injiciranje s podaljšanim sproščanjem
Denna bipacksedel ändrades senast: 15.01.2025
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal, se avsnitt Hur produkten används:
| 1. Förberedelse av patient före beredning | |
| |
| 2. Beredning av injektionsvätskan | |
Två nålar medföljer i förpackningen:
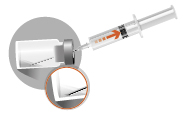
Förekomst av bubblor ovanpå det frystorkade pulvret är normalt. Följande steg måste utföras i en kontinuerlig följd. | |
2a
|
|
2b
| 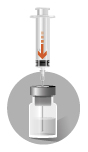 |
2c
|  |
2d
|
|
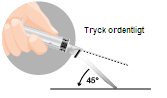
| 3. Intramuskulär injektion | |
|  |
| 4. Efter användningen | |
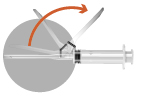
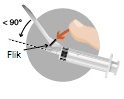
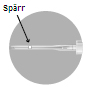
Det finns två alternativ att aktivera stickskyddet.
eller
Använda nålar, oanvänd suspension eller annat avfall ska kasseras enligt gällande anvisningar. |
Metod A
Metod B
|