Pakkausseloste
PAMORELIN injektiokuiva-aine ja liuotin, depotsuspensiota varten 22,5 mg
Pamorelin 22,5 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten
triptoreliini
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Pamorelin on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät Pamorelin-valmistetta
3. Miten Pamorelin-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. Pamorelin‑valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Pamorelin 22,5 mg sisältää triptoreliinia, mikä on samankaltainen kuin gonadotropiinia vapauttava hormoni (GnRH-analogi). Sen pitkävaikutteinen lääkemuoto on tehty vapauttamaan 22,5 mg triptoreliinia hitaasti kuuden kuukauden (24 viikon) aikana. Miehillä se alentaa testosteronihormonin tasoja. Naisilla se alentaa estrogeenitasoja.
Aikuisilla miehillä Pamorelin on tarkoitettu paikallisesti edenneen, hormoniriippuvaisen eturauhassyövän ja hormoniriippuvaisen, muualle elimistöön levinneen eturauhassyövän (metastasoituneen syövän) hoitoon. Sitä käytetään myös suuren riskin paikallisen ja paikallisesti edenneen, hormoniriippuvaisen eturauhassyövän hoitoon yhdistelmänä sädehoidon kanssa.
Vähintään 2‑vuotiailla lapsilla Pamorelin on tarkoitettu hoitamaan hyvin nuorella iällä, eli tytöillä ennen 8 vuoden ja pojilla ennen 10 vuoden ikää, ilmenevää murrosikää (ennenaikaista murrosikää). Tästä eteenpäin sitä kutsutaan tässä pakkausselosteessa ennenaikaiseksi murrosiäksi.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Pamorelin ‑valmistetta
- jos olet allerginen triptoreliiniembonaatille, gonadotropiinia vapauttavalle hormonille (GnRH), muille GnRH-analogeille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos olet raskaana tai imetät.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin otat Pamorelin‑valmistetta.
- Jos sinulle ilmaantuu masentuneisuutta. Pamorelin-valmistetta käyttävillä potilailla on raportoitu masennusta, joka saattaa olla vaikea-asteista. Lääkäri saattaa seurata masennustasi hoidon aikana.
- Jos käytät veren hyytymistä estäviä lääkkeitä, koska tällöin injektio voi aiheuttaa mustelmia injektiokohdassa.
- Jos sinulle ilmaantuu kouristuksia, kerro heti lääkärille. Triptoreliinia tai sen kaltaisia lääkkeitä saavilla potilailla on raportoitu kouristuksia, myös potilailla, joilla ei ole aiemmin todettu epilepsiaa.
Tämän valmisteen saa pistää vain lihakseen.
Miehet
- Pamorelin voi aiheuttaa aikuisille luiden haurastumista (osteoporoosia eli luukatoa), johon liittyy lisääntynyt luunmurtumien riski. Sinun pitää siksi kertoa lääkärille, jos sinulla on jokin jäljempänä mainituista riskitekijöistä, sillä lääkäri saattaa määrätä sinulle bisfosfonaattia (luiden haurastumisen hoitoon käytettäviä lääkkeitä) luukadon hoitoon. Riskitekijöitä voivat olla
- jos sinulla tai lähisukulaisellasi on luiden haurastumista.
- jos käytät runsaasti alkoholia ja/tai tupakoit paljon ja/tai ruokavaliosi on puutteellinen.
- jos käytät pitkään lääkkeitä, joista voi aiheutua luiden haurastumista, esimerkiksi epilepsialääkkeitä tai steroideja (kuten hydrokortisonia tai prednisolonia).
- Jos sinulla on sydän- tai verisuonisairaus, kuten sydämen rytmihäiriö (arytmia), tai sinua hoidetaan lääkkeillä sen takia. Sydämen rytmihäiriön riski voi kasvaa, kun käytetään Pamorelin ‑valmistetta.
- Jos sinulla on diabetes tai sydämeen tai verisuonistoon kohdistuva sairaus.
- Hoidon alussa testosteronin määrä elimistössäsi suurenee tilapäisesti. Tämä voi aiheuttaa syövän oireiden pahenemista. Ota yhteyttä lääkäriin, jos näin tapahtuu. Lääkäri voi antaa sinulle lääkettä (antiandrogeenia) ennaltaehkäisemään oireiden pahenemista.
- Ensimmäisten hoitoviikkojen aikana sinulle voi (kuten muitakin GnRH-johdoksia käytettäessä) ilmaantua oireita, joiden syynä on selkäytimen puristustila (esimerkiksi jalkojen kipu, tunnottomuus tai heikkous) tai virtsaputken tukkeutuminen. Jos näitä oireita ilmaantuu, ota heti yhteys lääkäriin. Lääkäri arvioi tilasi ja hoitaa sinua asianmukaisesti.
- Jos sinulle on tehty kirurginen kastraatio, triptoreliini ei alenna seerumin testosteronipitoisuuksia edelleen, eikä sitä siksi pidä käyttää.
- Jos sinulle on tarkoitus tehdä aivolisäkkeen ja sukurauhasten toimintaa mittaava diagnostinen testi, tulokset voivat olla harhaanjohtavia, jos käytät Pamorelin ‑valmistetta tai olet äskettäin lopettanut sen käytön.
- Jos sinulla on suurentunut aivolisäke (hyvänlaatuinen kasvain), josta et ole tietoinen, se saatetaan havaita Pamorelin ‑hoidon aikana. Oireita ovat äkillinen päänsärky, oksentelu, näköhäiriöt ja silmälihasten halvaantuminen.
- Testosteronia elimistössä vähentävät lääkeaineet voivat aiheuttaa sydämen rytmihäiriöihin liittyviä EKG:n (sydänsähkökäyrän) muutoksia (QT-ajan piteneminen).
- GnRH-analogihoito, myös Pamorelin-hoito, saattaa suurentaa anemian (veren punasolujen määrän pienenemisen) riskiä.
Lapset
- Jos sinulla on etenevä aivokasvain, kerro siitä lääkärille. Se voi vaikuttaa siihen, miten lääkäri päättää hoitaa sinua.
- Tytöillä, joilla on varhainen murrosikä, voi esiintyä verenvuotoa emättimestä ensimmäisen hoitokuukauden aikana.
- Jos lapsellesi ilmaantuu kovaa tai toistuvaa päänsärkyä, näköhäiriöitä tai korvien soimista tai suhinaa, ota välittömästi yhteyttä lääkäriin (ks. kohta Mahdolliset haittavaikutukset).
- Kun hoito lopetetaan, murrosiän merkit ilmenevät. Tytöillä kuukautiset alkavat keskimäärin vuoden kuluttua hoidon lopettamisen jälkeen. Lääkärin pitää sulkea pois muista sairauksista aiheutuva varhainen murrosikä. Luiden mineraalipitoisuus vähenee hoidon aikana, mutta se normalisoituu hoidon lopettamisen jälkeen.
- Hoidon lopettamisen jälkeen lonkassa voi ilmetä poikkeava muutos (reisiluun pään liukuma eli lonkan epifyseolyysi). Siitä aiheutuu lonkan jäykkyyttä, ontumista ja/tai voimakasta nivuskipua, joka säteilee reiteen. Näiden ilmetessä on keskusteltava lääkärin kanssa.
Keskustele lääkärisi kanssa jos jokin yllä olevista seikoista huolettaa sinua.
Muut lääkevalmisteet ja Pamorelin
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Pamorelin‑valmisteella voi olla yhteisvaikutuksia joidenkin sydämen rytmihäiriön hoitoon käytettyjen lääkkeiden kanssa (esim. kinidiini, prokaiiniamidi, amiodaroni ja sotaloli) tai se voi lisätä riskiä sydämen rytmihäiriöön kun sitä käytetään joidenkin muiden lääkkeiden kanssa (esim. metadoni (käytetään kivun lievitykseen ja huumeriippuvuuden katkaisuhoitoon), moksifloksasiini (antibiootti), psyykkisten sairauksien hoitoon käytettävät psykoosilääkkeet).
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.
Älä käytä Pamorelin‑valmistetta, jos olet raskaana.
Älä käytä Pamorelin‑valmistetta, jos imetät.
Ajaminen ja koneiden käyttö
Myös ohjeiden mukaisesti käytettynä Pamorelin-valmiste voi muuttaa reaktiokykyä siinä määrin, että ajokyky tai kyky käyttää koneita voi heikentyä. Näin voi käydä erityisesti samanaikaisen alkoholin käytön yhteydessä. Sinulla voi esiintyä huimausta, väsymystä tai näköhäiriöitä, kuten näön hämärtymistä. Nämä oireet voivat olla hoidosta aiheutuvia haittavaikutuksia tai ne voivat aiheutua taustasairaudesta. Älä aja äläkä käytä koneita, jos sinulla esiintyy kyseisiä haittavaikutuksia.
Lääke voi heikentää kykyä kuljettaa moottoriajoneuvoa tai tehdä tarkkaa keskittymistä vaativia tehtäviä. On omalla vastuullasi arvioida, pystytkö näihin tehtäviin lääkehoidon aikana. Lääkkeen vaikutuksia ja haittavaikutuksia on kuvattu muissa kappaleissa. Lue koko pakkausseloste opastukseksesi. Keskustele lääkärin tai apteekkihenkilökunnan kanssa, jos olet epävarma.
Pamorelin sisältää natriumia, mutta alle 1 mmol natriumia (23 mg) per injektiopullo eli se on olennaisesti natriumiton ja sitä voidaan käyttää natriumrajoitteisen ruokavalion yhteydessä.
Miten valmistetta käytetään
Tervedenhuollon ammattilainen antaa Pamorelin-injektiot.
Miehet
Eturauhassyövän hoito Pamorelin-valmisteella vaatii pitkäkestoista hoitoa.
Kun valmistetta käytetään suuren riskin paikallisen ja paikallisesti edenneen, hormoniriippuvaisen eturauhassyövän hoitoon yhdistelmänä sädehoidon kanssa, suositeltava hoidon kesto on 2–3 vuotta.
Tavanomainen annos on 1 injektiopullo Pamorelin 22,5 mg -valmistetta annettuna lihakseen kuuden kuukauden (24 viikon) välein. Pamorelin 22,5 mg on tarkoitettu pistettäväksi vain lihakseen.
Lääkärisi saattaa ottaa verikokeita tarkistaakseen, kuinka hoito tehoaa.
Lapset
Saat tavallisesti pistoksen 6 kuukauden (24 viikon) välein. Pamorelin 22,5 mg on tarkoitettu pistettäväksi vain lihakseen. Lääkäri päättää, milloin hoito lopetetaan (yleensä 12–13-vuoden iässä, jos olet tyttö, ja 13–14-vuoden iässä, jos olet poika).
Jos sinusta tuntuu, että Pamorelin-valmisteen vaikutus on liian voimakas tai liian heikko, ota yhteyttä lääkäriin tai apteekkiin.
Jos saat enemmän Pamorelin -valmistetta kuin sinun pitäisi saada
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Hakeudu heti lääkäriin, jos sinulle ilmaantuu seuraavia oireita:
Nielemis- tai hengitysvaikeuksia, huulten, kasvojen, kurkun tai kielen turpoamista tai nokkosihottumaa. Nämä voivat olla vaikean allergisen reaktion tai angioedeeman oireita. Angioedeemaa on ilmoitettu harvoin (voi esiintyä enintään 1 käyttäjällä 1 000:sta).
Muut mahdolliset haittavaikutukset:
Miehillä
Samoin kuin muiden GnRH-agonistihoitojen tai kirurgisen kastraation jälkeen, yleisimmät triptoreliinihoitoon liittyvät haittavaikutukset johtuvat sen odotetuista farmakologisista vaikutuksista. Näitä haittoja ovat kuumat aallot ja libidon heikkeneminen.
Veren valkosolujen määrän lisääntymistä on raportoitu potilailla, joita hoidetaan GnRH–analogeilla.
Allergisia reaktioita ja injektiokohdan reaktioita lukuun ottamatta kaikki haittavaikutukset iittyvät testosteronipitoisuuksien muutoksiin.
Hyvin yleiset: voi esiintyä yli 1 käyttäjällä 10:stä
- kuumat aallot
- heikkoudentunne
- lisääntynyt hikoilu
- selkäkipu
- kihelmöivä tunne jaloissa
- libidon heikkeneminen
- impotenssi.
Yleiset: voi esiintyä enintään 1 käyttäjällä 10:stä
- pahoinvointi, suun kuivuminen
- kipu, mustelmat, punoitus ja turvotus pistoskohdassa, lihas- ja luukipu, kipu käsivarsissa ja jaloissa, turvotus (nesteen kertyminen elimistön kudoksiin), alavatsakipu, kohonnut verenpaine
- allerginen reaktio
- painonnousu
- huimaus, päänsärky
- libidon menetys, masennus, mielialan vaihtelut.
Melko harvinaiset: voi esiintyä enintään 1 käyttäjällä 100:sta
- verihiutaleiden määrän suureneminen
- sydämen lyöntien tunteminen
- korvien soiminen, kiertohuimaus, näön hämärtyminen
- mahakipu, ummetus, ripuli, oksentelu
- uneliaisuus, voimakas tärinä, johon liittyy hikoilua ja kuumetta, kipu
- muutokset joidenkin verikokeiden tuloksissa (myös kohonneet maksa-arvot), verenpaineen nousu
- painonlasku
- ruokahaluttomuus, lisääntynyt ruokahalu, kihti (voimakasta kipua ja turvotusta nivelissä, yleensä isovarpaassa), diabetes, veren rasvapitoisuuden suureneminen
- nivelkipu, lihaskouristukset, lihasheikkous, lihaskipu, turvotus ja arkuus, luukipu
- kihelmöinti tai tunnottomuus
- unettomuus, ärtyneisyys
- rintojen suureneminen miehillä, rintojen kipu, kivesten pieneneminen, kivesten kipu
- hengitysvaikeudet
- akne, hiustenlähtö, kutina, ihottuma, ihon punoitus, nokkosrokko
- virtsaamistarpeeseen herääminen yöllä, virtsaamisvaikeudet
- nenäverenvuoto.
Harvinaiset: voi esiintyä enintään 1 käyttäjällä 1 000:sta
- punaiset tai violetit täplät ihossa
- outo tunne silmässä, näön sumeneminen tai näköhäiriö
- täysinäisyyden tunne vatsassa, ilmavaivat, makuhäiriöt
- rintakipu
- vaikeudet seistä
- vilustumista muistuttavat oireet, kuume
- nenän/nielun tulehdus
- kohonnut ruumiinlämpö
- nivelten jäykkyys, nivelten turpoaminen, tuki- ja liikuntaelinten jäykkyys, nivelrikko
- muistinmenetys
- sekavuus, aktiivisuuden väheneminen, kohonnut mieliala
- hengästyneisyys makuuasennossa
- rakkulat
- matala verenpaine.
Tuntematon: koska saatavissa oleva tieto ei riitä arviointiin
- muutokset EKG:ssä (QT-ajan pidentyminen)
- yleinen epämukavuuden tunne
- ahdistuneisuus
- virtsanpidätyskyvyttömyys
- potilailla, joilla on aivolisäkkeen kasvain, suurentunut aivolisäkkeen alueen verenvuodon riski
- anemia (veren punasolujen määrän pieneneminen).
Lapsilla
Hyvin yleiset: voi esiintyä yli 1 käyttäjällä 10:stä
- emätinverenvuoto, jota voi esiintyä tytöillä ensimmäisen hoitokuukauden aikana
Yleiset: voi esiintyä enintään 1 käyttäjällä 10:stä
- vatsakipu
- kipu, pistoskohdan punoitus ja turvotus
- päänsärky
- kuumat aallot
- painonnousu
- akne
- yliherkkyysreaktiot
Melko harvinaiset: voi esiintyä enintään 1 käyttäjällä 100:sta
- näön hämärtyminen
- oksentelu
- ummetus
- pahoinvointi
- yleinen huonovointisuus
- ylipaino
- niskakipu
- mielialan muutokset
- rintojen kipu
- nenäverenvuoto
- kutina
- ihottuma tai nokkosihottuma
Tuntematon: koska saatavissa oleva tieto ei riitä arviointiin
- korkea verenpaine
- näköhäiriöt
- vaikea allerginen reaktio, joka aiheuttaa nielemisvaikeuksia, hengitysvaikeuksia, huulten, kasvojen, kurkun tai kielen turpoamista, tai nokkosihottumaa
- kouristukset
- muutoksia joissain verikokeissa, mukaan lukien hormonitasoissa
- nopea paukamien muodostuminen ihon tai limakalvojen turpoamisen vuoksi
- lihaskipu
- mielialahäiriöt
- masennus
- hermostuneisuus
- Idiopaattinen kallonsisäisen paineen (aivopaineen) kohoaminen (jonka oireita ovat päänsärky, kaksoiskuvat ja muut näköhäiriöt sekä korvien soiminen tai suhina)
Lääkäri päättää mihin toimenpiteisiin ryhdytään.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa ja etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa
Valmiiksi sekoitettu suspensio on käytettävä välittömästi.
Säilytä alle 25 °C.
Pakkauksen sisältö ja muuta tietoa
Mitä Pamorelin 22,5 mg sisältää
- Vaikuttava aine on triptoreliini
Yksi injektiopullo sisältää triptoreliiniembonaattia vastaten 22,5 mg triptoreliinia.
Kun on lisätty 2 ml liuotinta, 1 ml valmista suspensiota sisältää 11,25 mg triptoreliinia. - Muut aineet ovat:
Injektiokuiva-aine: poly (d,1-laktidi-ko-glykolidi), mannitoli, karmelloosinatrium, polysorbaatti 80.
Liuotin: injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoot
Valmiste sisältää injektiokuiva-aineen ja liuottimen depotsuspensiota varten. Injektiokuiva-aine on valkoista tai lähes valkoista jauhetta, liuotin on kirkas neste.
Pakkauksessa on 1 injektiopullo, 1 ampulli ja 1 läpipainopakkaus, jossa on 1 injektioruisku ja 2 injektioneulaa.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija
Institut Produits Synthèse (IPSEN) AB
Kista Science Tower
Färögatan 33
SE-164 51 Kista
Ruotsi
Valmistaja
Ipsen Pharma Biotech
Parc d'Activités du Plateau de Signes
Chemin départemental N° 402
83870 Signes
Ranska
Tällä lääkevalmisteella on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä:
AT, DE: Pamorelin LA 22.5 mg
BE, LU: Decapeptyl Sustained Release 22.5 mg
CZ, PL, SK: Diphereline SR 22.5 mg
DK, FI, NL, NO, SE: Pamorelin 22,5 mg
EL: Arvekap 22.5 mg
ES: Decapeptyl Semestral 22.5 mg
FR: Decapeptyl LP 22.5 mg
HU: Diphereline SR 22,5 mg por és oldószer retard szuszpenziós injekcióhoz
LV: Diphereline 22.5 mg
SI: Pamorelin 22.5 mg prašek in vehikel za suspenzijo za injiciranje s podaljšanim sproščanjem
Tämä pakkausseloste on hyväksytty viimeksi 15.01.2025
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille (ks. kohta Miten valmistetta käytetään):
| 1 – POTILAAN VALMISTELU ENNEN INJEKTION VALMISTAMISTA | |
| Valmistele potilas desinfioimalla pakaralihaksen injektiokohta. Tämä tulee tehdä ensimmäiseksi, sillä lääke on injisoitava välittömästi valmistamisen jälkeen. | |
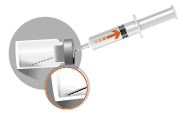
| 2 – INJEKTION VALMISTAMINEN | |
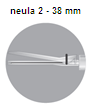
Pakkauksessa on kaksi neulaa:
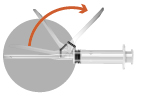
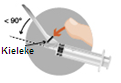
Kuplien esiintyminen kylmäkuivatun jauheen pinnalla kuuluu tuotteen normaalin ulkonäköön. Seuraavat vaiheet on tehtävä peräkkäin ilman keskeytyksiä. | |
2a
| 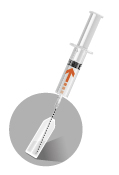 |
2b
| 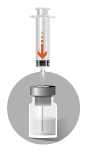 |
2c
|  |
2d
|
|
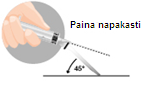
| 3 – INJEKTIO LIHAKSEEN | |
| 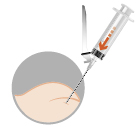 |
| 4 – KÄYTÖN JÄLKEEN | |
Suojalaitetta voi käyttää kahdella tavalla.
tai
Käytetyt neulat, mahdollisesti käyttämättä jäänyt suspensio tai muu jäte on hävitettävä paikallisten vaatimusten mukaisesti. |
Tapa A tai
Tapa B
|