Pakkausseloste
BENEFIX injektiokuiva-aine ja liuotin, liuosta varten 500 IU, 1000 IU, 2000 IU, 3000 IU
BeneFIX 250 IU injektiokuiva-aine ja liuotin, liuosta varten
BeneFIX 500 IU injektiokuiva-aine ja liuotin, liuosta varten
BeneFIX 1000 IU injektiokuiva-aine ja liuotin, liuosta varten
BeneFIX 1500 IU injektiokuiva-aine ja liuotin, liuosta varten
BeneFIX 2000 IU injektiokuiva-aine ja liuotin, liuosta varten
BeneFIX 3000 IU injektiokuiva-aine ja liuotin, liuosta varten
nonakogi alfa (rekombinantti hyytymistekijä IX)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä BeneFIX on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät BeneFIX-valmistetta
- Miten BeneFIX-valmistetta käytetään
- Mahdolliset haittavaikutukset
- BeneFIX-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
BeneFIX on hyytymistekijä IX -valmiste, joka valmistetaan yhdistelmä-DNA-tekniikalla. BeneFIX-valmisteen vaikuttava aine on nonakogi alfa ja sitä annetaan injektiona laskimoon. Synnynnäistä hemofilia B ‑tautia (Christmas disease) sairastavilla potilailla ei ole riittävästi hyytymistekijä IX:ää verenvuodon hallintaan. BeneFIX korvaa puuttuvan hyytymistekijä IX:n ja mahdollistaa siten veren hyytymisen hemofilia B -potilailla.
BeneFIX-valmistetta käytetään hemofilia B -potilaiden (synnynnäinen hyytymistekijä IX:n puutos) verenvuodon ehkäisyyn ja hoitoon kaikissa ikäryhmissä.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä BeneFIX-valmistetta
- jos olet allerginen nonakogi alfalle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos olet allerginen hamsterin proteiinille.
Varoitukset ja varotoimet
- Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät BeneFIX-valmistetta.
- Hakeudu välittömästi lääkärin hoitoon, jos vuoto ei lopu odotusten mukaisesti.
- Allergiset reaktiot ovat mahdollisia. Valmisteessa voi olla jäämiä hamsterin proteiinista (ks. Älä käytä BeneFIX-valmistetta). Mahdollisia henkeä uhkaavia anafylaktisia reaktioita (vakavia allergisia reaktioita) on esiintynyt tekijä IX -valmisteilla, BeneFIX mukaan lukien. Allergisten reaktioiden ensimmäiset merkit ovat hengitysvaikeudet, hengenahdistus, turvotus, nokkosrokko, kutina, yleistynyt nokkosrokko, puristava tunne rinnassa, hengityksen vinkuminen, matala verenpaine, näön sumeneminen ja anafylaksia (vakava allerginen reaktio, joka voi aiheuttaa nielemis- ja/tai hengitysvaikeuksia, punaiset ja turvonneet kasvot ja/tai kädet).
- Allergia- tai anafylaktistyyppisten reaktioiden ilmetessä lopeta heti infuusio ja ota välittömästi yhteyttä lääkäriin tai hakeudu ensiapupoliklinikalle. Vakavien allergisten reaktioiden ollessa kyseessä on harkittava vaihtoehtoista hoitoa.
- Aktiivisuutta neutraloivat vasta-aineet (inhibiittorit) ovat melko harvinaisia potilailla, jotka ovat saaneet aiempaa hoitoa tekijä IX:ää sisältävillä valmisteilla. Kuten kaikkien tekijä IX ‑valmisteiden kanssa sinua pitää seurata huolellisesti tekijä IX -vasta-aineiden muodostumisen varalta BeneFIX-hoidon aikana.
- Tutkimukset ovat osoittaneet yhteyden tekijä IX:n inhibiittorien ja allergisten reaktioiden esiintyvyyden välillä. Jos siis saat esim. edellä kuvatun kaltaisia allergisia reaktioita, sinulta pitää tutkia inhibiittorien ilmaantuminen. On huomattava, että potilailla, joilla esiintyy tekijä IX:n vasta-aineita, voi olla lisääntynyt anafylaksiavaara myöhemmin BeneFIX-hoidon aikana.
- Tekijä IX:n tuotantoa kehossa kontrolloi tekijä IX:n geeni. Potilaat, joiden tekijä IX:n geenissä on erityinen muutos, kuten suuri deleetio, voivat todennäköisemmin kehittää vasta-aineita tekijä IX:lle ja/tai kokea allergisia reaktioita. Sen takia, jos sinulla tiedetään olevan tällainen mutaatio, lääkäri saattaa seurata sinua tavallista tarkemmin allergisen reaktion varalta erityisesti aloittaessasi BeneFIX-valmisteen käytön.
- Tekijä IX:n aiheuttamien allergisten reaktioiden vaaran takia ensimmäiset BeneFIX-annoksesi pitää antaa hoitohenkilökunnan valvonnassa paikassa, jossa allergisia reaktioita voidaan hoitaa lääketieteellisesti asianmukaisesti.
- Myös tekijä IX:n vasta-aineen puuttuessa voidaan tarvita suurempia BeneFIX-annoksia kuin käytettäessä muita plasmaperäisiä tekijä IX -valmisteita, joita olet mahdollisesti käyttänyt aikaisemmin. Tekijä IX:n plasma-aktiivisuutta (mittaa veresi hyytymiskykyä) on seurattava tiheästi, jotta annoksia voidaan muuttaa sopivasti. Jos vuotoa ei hallita suositellulla annoksella, ota yhteys lääkäriin.
- Jos sinulla on maksa- tai sydänsairaus tai jos sinut on äskettäin leikattu, hyytymiskomplikaatioiden vaara lisääntyy.
- Tekijä IX -vasta-aineita muodostaneilla ja aiemmin allergisia reaktioita saaneilla hemofilia B ‑potilailla on raportoitu munuaisoireita (nefroottinen oireyhtymä) suurten plasmaperäisten tekijä IX -annosten jälkeen.
- BeneFIX-valmisteen käytöstä aiemmin hoitamattomilla potilailla ei ole kliinisten tutkimusten perusteella riittäviä tietoja.
- On suositeltavaa, että merkitset BeneFIX-valmisteen nimen ja eränumeron muistiin joka kerta käyttäessäsi valmistetta. Voit käyttää yhtä injektiopullossa olevaa tarraa eränumeron kirjaamiseen päiväkirjaasi tai haittavaikutusten ilmoittamiseen.
Muut lääkevalmisteet ja BeneFIX
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, voit käyttää BeneFIX-valmistetta vain lääkärin näin erityisesti ohjeistaessa. Ei tiedetä, voiko BeneFIX aiheuttaa haittaa syntymättömälle lapselle, jos sitä annetaan raskaana olevalle naiselle. Lääkäri saattaa kehottaa lopettamaan BeneFIX-hoidon, jos tulet raskaaksi tai imetät.
Kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Ajaminen ja koneiden käyttö
BeneFIX-valmisteella ei ole haitallisia vaikutuksia ajokykyyn tai koneidenkäyttökykyyn.
BeneFIX sisältää natriumia
Käyttökuntoon saatettu BeneFIX sisältää 0,2 mmol natriumia (4,6 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”. Voit kuitenkin painosi ja BeneFIX-annostuksen perusteella saada useita injektiopulloja. Tämä on otettava huomioon, jos noudatat vähäsuolaista ruokavaliota.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Lääkäri määrää BeneFIX-annoksen. Annos ja hoidon kesto riippuvat yksilöllisestä tekijä IX:n korvaushoidon tarpeestasi ja siitä miten nopeasti kehosi käyttää tekijä IX:ää; tätä tutkitaan säännöllisesti. Saatat huomata eron saamassasi annoksessa, kun sinut siirretään plasmaperäisestä tekijä IX ‑valmisteesta BeneFIX-valmisteeseen.
Lääkäri saattaa muuttaa BeneFIX-annostustasi hoidon kuluessa.
Liuottaminen ja anto
Alla kuvatut menettelyt on tarkoitettu BeneFIX-valmisteen käyttökuntoon valmistamiseen ja antoon. Potilaiden pitää noudattaa lääkärin antamia erityisiä ohjeita laskimopunktiota koskien.
BeneFIX annetaan infuusiona laskimoon (i.v.) sen jälkeen kun se on saatettu käyttövalmiiksi lisäämällä injektiokuiva-aineeseen liuotin (natriumkloridi(suola)liuos) pakkauksessa mukana olevasta esitäytetystä ruiskusta.
Pese aina kädet ennen seuraavien toimenpiteiden suorittamista.
Liuotuksessa tulee noudattaa aseptista tekniikkaa (puhdas ja bakteeriton anto).
Liuottaminen:
BeneFIX annetaan infuusiona laskimoon (i.v.) sen jälkeen kun se on liuotettu steriilillä injektioliuottimella.
- Anna BeneFIX-injektiopullon ja esitäytetyn liuotinruiskun lämmetä huoneenlämpöisiksi.
- Poista injektiopullon muovinen korkinsuojus siten, että kumitulpan keskiosa tulee esiin.
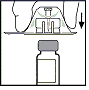
- Pyyhi tulppa mukana olevalla alkoholipyyhkeellä tai muulla antiseptisella liuoksella ja anna kuivua. Puhdistamisen jälkeen älä kosketa kumitulppaa käsillä, älä myöskään anna sen koskettaa muita pintoja.
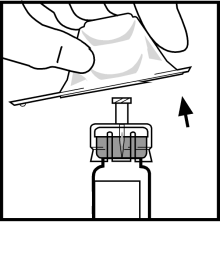
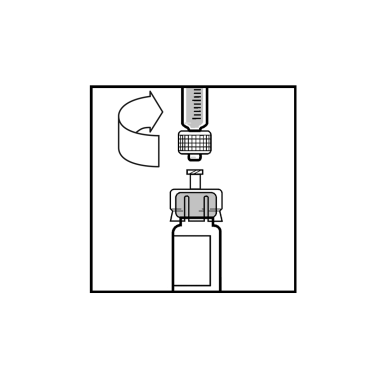
- Irrota adapteripakkauksen kirkas, muovinen kansi. Älä poista adapteria pakkauksesta.
- Aseta pullo tasaiselle alustalle. Pidä kiinni adapteripakkauksesta, aseta adapteri injektiopullon päälle ja paina tiukasti pakkauksen päältä kunnes adapteri asettuu paikoilleen ja adapteripiikki läpäisee kumitulpan.
- Poista adapterin muovikotelo ja heitä se pois.
- Liitä mäntä liuosruiskuun painamalla männän kärki liuotinruiskun aukkoon. Paina ja pyöritä mäntää kunnes se on tiukasti kiinnittynyt.
- Katkaise ruiskun kärjen suoja katkaisemalla se lävistyksen kohdalta. Tämä tehdään taivuttamalla sitä alas ja ylös kunnes se katkeaa lävistyksen kohdalta. Älä koske korkin sisäosaa tai ruiskun päätä. Korkki voidaan joutua laittamaan takaisin (jos käyttövalmista BeneFIX-valmistetta ei anneta heti), joten siirrä korkki sivuun kärki alaspäin.
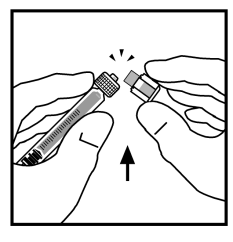
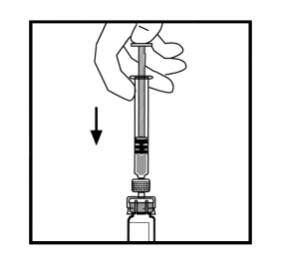
- Aseta pullo tasaiselle alustalle. Yhdistä liuotinruisku adapteriin. Aseta kärki adapteriaukkoon painamalla ja kääntämällä tiukasti ruiskua myötäpäivään kunnes se on kiinnittynyt.
- Paina mäntää hitaasti kunnes kaikki liuotin on BeneFIX-injektiopullossa.
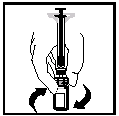
- Ruisku edelleen kiinnitettynä, liikuttele injektiopulloa varovasti pyörivin liikkein kunnes jauhe on liuennut.
- Lopullinen liuos tulee tarkastaa silmämääräisesti ennen antoa, ettei se sisällä hiukkasia. Liuoksen tulee olla kirkas ja väritön.
Huom: Jos infuusioon on tarkoitus käyttää useampi kuin yksi BeneFIX-pullo, jokainen pullo tulee valmistaa käyttövalmiiksi yllämainitun ohjeen mukaisesti. Poista liuotinruisku ja jätä adapteri paikoilleen, jonka jälkeen käyttövalmiit liuokset voidaan vetää injektiopulloista käyttämällä erillistä isoa luer-lukollista (laite, joka yhdistää ruiskun injektiopulloon) ruiskua.
- Paina mäntä kokonaan ruiskun sisään. Käännä injektiopullo ylösalaisin ja vedä liuos takaisin ruiskuun.
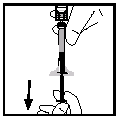
- Irrota ruisku adapterista vetämällä varovasti ja kiertämällä sitä vastapäivään. Hävitä injektiopullo ja siihen kiinnitetty adapteri.
Huom: Jos liuosta ei oteta heti käyttöön, ruiskun korkki tulee laittaa varovasti takaisin. Älä koske ruiskunpäätä tai korkin sisäosaa.
BeneFIX tulee antaa heti tai 3 tunnin kuluessa liuotuksesta. Valmiiksi liuotettua valmistetta voidaan säilyttää huoneenlämmössä ennen antamista.
Antotapa (injektio laskimoon)
BeneFIX annetaan esitäytetyllä liuotinruiskulla tai yhdellä steriilillä kertakäyttöisellä luer-muoviruiskulla. Lisäksi liuos vedetään injektiopullosta ruiskuun adapterin avulla.
BeneFIX injisoidaan laskimoon usean minuutin aikana. Lääkäri saattaa muuttaa suositeltua infuusionopeutta, jotta infuusio olisi sinulle miellyttävämpi.
BeneFIX-valmistetta annettaessa on havaittu punasolujen sakkautuvan letkustossa/ruiskussa. Haittavaikutuksista, jotka liittyisivät tähän havaintoon, ei ole kuitenkaan ilmoitettu. Sakkautumisen minimoimiseksi on tärkeä rajoittaa letkustoon pääsevän veren määrää. Verta ei saa päästä ruiskuun. Jos punasolujen huomataan sakkautuvan letkustossa/ruiskussa, kaikki välineistö ja valmiste (letkusto, ruisku ja BeneFIX-liuos) on poistettava käytöstä ja infuusio on annettava uutta pakkausta käyttäen.
Koska BeneFIX-valmisteen käyttöä jatkuvassa infuusiossa ei ole arvioitu, BeneFIX-valmistetta ei tule sekoittaa infuusionesteisiin eikä antaa tippainfuusiona.
Kaikki käyttämättä jäänyt liuos, tyhjät injektiopullot, käytetyt neulat ja ruiskut, jotka saattavat vahingoittaa muita epäasianmukaisesti käsiteltyinä, tulisi hävittää sopivassa tällaisten esineiden hävittämiseen tarkoitetussa säiliössä.
Jos käytät enemmän BeneFIX-valmistetta kuin sinun pitäisi
Ota välittömästi yhteys lääkäriin, jos olet injisoinut enemmän BeneFIX-valmistetta kuin lääkäri on suositellut.
Jos lopetat BeneFIX-valmisteen käytön
Älä lopeta BeneFIX-valmisteen käyttöä keskustelematta lääkärin kanssa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Yliherkkyysreaktiot/allergiset reaktiot
Allergistyyppiset yliherkkyysreaktiot ovat mahdollisia BeneFIX-valmistetta käytettäessä. Tällaisia reaktioita voivat olla kasvojen tai kurkun turvotus, infuusiokohdan poltto ja pistely, vilunväreet, punastelu, kutina, päänsärky, nokkosihottuma, matala verenpaine, uneliaisuus, pahoinvointi, levottomuus, nopea sydämensyke, ahdistava tunne rinnassa, kihelmöinti, oksentelu ja hengityksen vinkuminen. Joissakin tapauksissa nämä reaktiot ovat edenneet vakavaksi anafylaksiaksi. Allergisia reaktioita saattaa esiintyä tekijä IX:n inhibiittorien kehittymisen yhteydessä (ks. myös ”Varoitukset ja varotoimet”).
Nämä reaktiot saattavat olla henkeä uhkaavia. Allergisten/anafylaktisten reaktioiden ilmetessä lopeta infuusio heti ja ota välittömästi yhteyttä lääkäriin tai hakeudu ensiapupoliklinikalle. Tarvittava hoito riippuu haittavaikutusten luonteesta ja vakavuudesta (ks. myös ”Varoitukset ja varotoimet”).
Inhibiittoreiden kehittyminen
Hemofilia B -potilaille voi kehittyä neutraloivia vasta-aineita (inhibiittoreita) tekijä IX:lle. Vasta-aineiden ilmaantuessa tästä merkkinä voi olla tavallisen BeneFIX-annoksen riittämättömyys verenvuodon hoidossa ja/tai verenvuodon jatkuminen hoidon jälkeen. Tällöin suositellaan ottamaan yhteys hemofiliaan erikoistuneeseen hoitokeskukseen. Lääkäri saattaa haluta seurata sinua vasta-aineiden kehittymisen varalta (ks. myös ”Varoitukset ja varotoimet”).
Suurten plasmaperäisten tekijä IX -annosten on raportoitu aiheuttaneen munuaisten vajaatoimintaa, kun valmisteella on annettu siedätyshoitoa sellaisille hemofilia B -potilaille, joilla on tekijä IX ‑inhibiittoreita tai joilla on ollut allergisia reaktioita (ks. myös ”Varoitukset ja varotoimet”).
Veritulpat
Jos sinulla on riskitekijöitä veritulpan kehittymiselle, BeneFIX saattaa lisätä tätä riskiä, kun BeneFIX-valmistetta annetaan jatkuvana infuusiona keskuslaskimokatetrin kautta. Vakavia veritulppatapauksia on raportoitu, mukaan lukien hengenvaarallisia veritulppia kriittisesti sairailla vastasyntyneillä, kun BeneFIX-valmistetta on annettu jatkuvana infuusiona keskuslaskimokatetriin. Perifeeristä laskimontukkotulehdusta ja syvää laskimotukosta (raajojen veritulpat) on myös raportoitu. Useimmissa näistä tapauksista BeneFIX-valmistetta oli annettu jatkuvana infuusiona, joka ei ole hyväksytty antotapa.
Hyvin yleiset haittavaikutukset (voi esiintyä yli 1 potilaalla kymmenestä)
- päänsärky
- yskä
- kuume.
Yleiset haittavaikutukset (voi esiintyä enintään 1 potilaalla kymmenestä)
- yliherkkyysreaktiot / allergiset reaktiot
- huimaus, makuaistin muutokset
- laskimotulehdus (kipu ja suonen punoitus), punastelu
- oksentelu, pahoinvointi
- ihottuma, nokkosihottuma
- epämukava tunne rinnassa (mukaan lukien rintakipu)
- infuusiokohdan reaktio (mukaan lukien infuusiokohdan kutina ja punoitus), infuusiokohdan kipu ja epämukava tunne.
Melko harvinaiset haittavaikutukset (voi esiintyä enintään 1 potilaalla sadasta)
- neutraloivien vasta-aineiden eli inhibiittoreiden kehittyminen
- infuusiokohdan selluliitti (kipu ja ihon punoitus)
- uneliaisuus, vapina
- näön heikkeneminen (mukaan lukien näön sumeneminen, täplien/valojen näkeminen)
- nopea sydämensyke, matala verenpaine
- munuaisinfarkti (munuaisen verenvirtauksen estyminen).
Haittavaikutukset, joiden yleisyys on tuntematon (koska saatavissa oleva tieto ei riitä yleisyyden arviointiin)
- anafylaktinen reaktio
- veritulpat (epänormaalit verihyytymät)
- puutteellinen hoitovaste (verenvuoto ei lopu, tai ennalta ehkäisevä hoito ei onnistu).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä BeneFIX alle 30 °C. Valmiste on käytettävä ennen pakkauksessa ilmoitettua viimeistä käyttöpäivämäärää.
Ei saa jäätyä, jotta esitäytetty ruisku ei vahingoitu.
Käytä liuotettu valmiste heti tai viimeistään 3 tunnin kuluessa.
Älä käytä tätä valmistetta, ellei liuos ole kirkasta ja väritöntä.
Käytä vain pakkauksessa mukana tulevia esitäytettyjä ruiskuja liuotukseen. Muita steriilejä kertakäyttöruiskuja voi käyttää annosteluun.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä BeneFIX sisältää
- Vaikuttava aine on nonakogi alfa (rekombinantti hyytymistekijä IX). Jokainen BeneFIX-injektiopullo sisältää nimellisesti 250, 500, 1000, 1500, 2000 tai 3000 IU nonakogi alfaa.
- Muut aineet ovat sakkaroosi, glysiini, L-histidiini ja polysorbaatti 80. Pakkauksessa on myös liuotin (0,234 % natriumkloridiliuos) injektion valmistamiseen.
- Liuottimen (0,234 % natriumkloridiliuos) lisäyksen jälkeen jokainen injektiopullo sisältää 50, 100, 200, 300, 400 tai 600 IU nonakogi alfaa 1 millilitrassa valmista injektionestettä (ks. taulukko 1).
Taulukko 1. BeneFIX:in vahvuus / ml
|
BeneFIX-määrä / injektiopullo |
BeneFIX-valmisteen määrä 1 ml:ssa valmista injektioliuosta |
|
250 IU |
50 IU |
|
500 IU |
100 IU |
|
1000 IU |
200 IU |
|
1500 IU |
300 IU |
|
2000 IU |
400 IU |
|
3000 IU |
600 IU |
Lääkevalmisteen kuvaus ja pakkauskoot
BeneFIX-injektiokuiva-aine toimitetaan lasisessa injektiopullossa ja liuotin esitäytetyssä ruiskussa.
BeneFIX-pakkaus sisältää:
- 1 injektiopullo BeneFIX 250, 500, 1000, 1500, 2000 tai 3000 IU kuiva-ainetta
- 1 esitäytetty ruisku liuotinta (5 ml:aa steriiliä 0,234 %:sta natriumkloridi-injektionestettä), ja ruiskun mäntä
- 1 steriili liitinosa (adapteri)
- 1 steriili infuusiosetti
- 2 alkoholipyyhettä
- 1 laastari
- 1 sideharso
Myyntiluvan haltija:
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Bruxelles
Belgia
Valmistaja:
Wyeth Farma S.A.
Autovia del Norte. A-1, Km. 23. Desvio Algete, Km. 1, 28700 San Sebastian de los Reyes, Madrid,
Espanja
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Pfizer Oy
Puh: +358 (0)9 43 00 40
Tämä pakkausseloste on tarkistettu viimeksi 11/2020
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu . Siellä on myös linkkejä muille harvinaisia sairauksia ja niiden hoitoja käsitteleville verkkosivuille.