Pakkausseloste
PERGOQUIN tabletti 1 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Pergoquin 1 mg tabletit hevoselle
VAIKUTTAVAT JA MUUT AINEET
Yksi tabletti sisältää:
Vaikuttava aine:
Pergolidi 1,0 mg
(vastaa 1,31 mg pergolidimesilaattia)
Apuaine:
Rautaoksidi, punainen (E172) 0,9 mg
Vaaleanpunainen, pyöreä ja kupera tabletti, jonka toisella puolella on ristinmuotoinen jakouurre. Tabletin voi jakaa kahteen tai neljään yhtä suureen osaan.
KÄYTTÖAIHEET
Aivolisäkkeen toimintahäiriöön (Pituitary Pars Intermedia Dysfunction, PPID) liittyvien kliinisten oireiden oireenmukainen hoito (Hevosen Cushingin tauti).
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle, muille torajyväjohdannaisille tai apuaineille.
Ei saa käyttää alle 2-vuotiaille hevosille.
HAITTAVAIKUTUKSET
Harvinainen (1-10 eläintä 10 000 hoidetusta eläimestä): Ruokahaluttomuus, syömättömyys1, letargia1, keskushermosto-oireet2 (esim. apeus, ataksia), ripuli, ähky.
Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): Hikoilu
1ohimenevä 2lievä
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle tai myyntiluvan haltijan paikalliselle edustajalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta:
Lääkealan turvallisuus- ja kehittämiskeskus Fimea www-sivusto: https://www.fimea.fi/elainlaakkeet/
KOHDE-ELÄINLAJI
Hevonen (elintarviketuotannosta poissuljettu)
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Suun kautta, kerran vuorokaudessa.
Aloitusannos
Aloitusannos on 2 mikrog pergolidia elopainokiloa kohden (annosalueella 1,7–2,5 mikrog/kg). Julkaistussa kirjallisuudessa olevissa tutkimuksissa yleisin keskimääräinen annos on 2 mikrog pergolidia/kg vaihteluvälillä 0,6–10 mikrog pergolidia/kg. Aloitusannos (2 mikrog pergolidia/kg, esim. yksi tabletti 500 elopainokiloa kohden) tulee säätää seurannan osoittaman yksilöllisen vasteen mukaan (ks. alla).
Suositellut aloitusannokset ovat:
| Hevosen paino | Tablettien lukumäärä | Aloitusannos | Annostusalue |
| 200–300 kg | ½ | 0,50 mg | 1,7–2,5 mikrog/kg |
| ar301–400 kg | ¾ | 0,75 mg | 1,9–2,5 mikrog/kg |
| 401–600 kg | 1 | 1,00 mg | 1,7–2,5 mikrog/kg |
| 601–850 kg | 1 ½ | 1,50 mg | 1,8–2,5 mikrog/kg |
| 851–1 000 kg | 2 | 2,00 mg | 2,0–2,4 mikrog/kg |
Ylläpitoannos
Tälle sairaudelle on oletettavissa elinikäinen hoito.
Useimmat hevoset saavat vasteen hoitoon ja niiden tila vakautuu keskimääräisellä annoksella 2 mikrog/kg. Kliinisen tilan paraneminen on odotettavissa 6–12 viikon sisällä. Hevoset voivat saada vasteen hoitoon pienemmällä tai vaihtelevalla annoksella. Sen vuoksi annos suositellaan säädettäväksi hoitovasteen perusteella pienimpään vaikuttavaan annokseen yksilöllisesti tehon tai siedettävyyden mukaan. Jotkin hevoset saattavat tarvita jopa 10 mikrog pergolidia painokiloa kohti päivässä. Näissä harvinaisissa tapauksissa suositellaan asianmukaista lisäseurantaa.
Diagnoosin asettamisen jälkeen endokrinologiset testit on syytä toistaa annoksen säätämiseksi ja lääkityksen vaikutusten tarkkailemiseksi 4–6 viikon välein, kunnes hevosen tila on stabiloitunut tai sen kliiniset oireet ja/tai diagnostisten testien tulokset ovat parantuneet.
Jolleivät kliiniset oireet tai diagnostisten testien tulokset ole kohentuneet ensimmäisten 4–6 viikon kuluessa, päivittäistä kokonaisannosta voidaan nostaa 0,25–0,50 mg. Jos kliiniset oireet ovat kohentuneet jossain määrin mutta eivät ole vielä täysin normalisoituneet, annoksen nostaminen on eläinlääkärin päätettävissä ottaen huomioon yksilöllisen hoitovasteen/sietokyvyn kyseiseen annostasoon nähden.
Jos kliinisiä oireita ei saada riittävästi hallintaan (kliininen arvio ja/tai diagnostiset testit), on suositeltavaa nostaa päivittäistä kokonaisannosta 0,25–0,50 mg 4–6 viikon välein kunnes hevosen tila stabiloituu olettaen, että hevonen sietää kyseisen annoksen. Haittavaikutusoireiden esiintyessä hoito keskeytetään 2–3 päivän ajaksi ja aloitetaan sen jälkeen puolella aikaisemmasta annoksesta.
Päivittäinen kokonaisannos voidaan sen jälkeen nostaa vähitellen toivotun kliinisen hoitovasteen tuottaneelle tasolle lisäämällä 2–4 viikon välein 0,25–0,50 mg. Jos jokin annos unohtuu antaa, seuraava annos annetaan eläinlääkärin annosteluohjeen mukaan.
Kun hevosen tila on stabiloitunut, säännöllinen kliininen arviointi ja diagnostinen testaus suoritetaan 6 kk välein hoidon ja annoksen tarkkailemiseksi. Jollei toivottua hoitovastetta saavuteta, on diagnoosi arvioitava uudelleen.
Tabletit ovat jaettavissa kahteen tai neljään yhtä suureen osaan tarkan annostuksen varmistamiseksi. Aseta tabletti tasaiselle pinnalle uurrettu pinta ylöspäin ja kupera puoli alaspäin pintaa vasten.
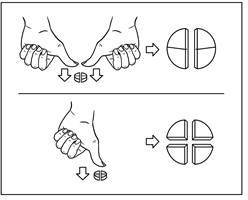
Kaksi yhtä suurta osaa: paina tabletin molempia reunoja alaspäin peukaloilla. Neljä yhtä suurta osaa: paina peukalolla tabletin keskikohtaa.
ANNOSTUSOHJEET
Annostelua voidaan helpottaa liuottamalla päivittäinen annos pieneen vesimäärään ja/tai sekoittamalla se melassiin tai muuhun makeuttavaan aineeseen kunnes annos on liuennut. Liuotetut tabletit tulee annostella ruiskulla. Koko lääkemäärä on annosteltava välittömästi. Tabletteja ei saa murskata.
VAROAIKA
Ei saa käyttää hevosille, jotka on tarkoitettu elintarvikkeeksi. Hoidettuja hevosia ei saa koskaan teurastaa ihmisravinnoksi.
Kansallisen hevospassia koskevan lainsäädännön mukaisesti tulee vahvistaa, että hevonen ei ole tarkoitettu teurastettavaksi ihmisravinnoksi käyttöä varten. Ei saa käyttää lypsäville eläimille, joiden maitoa käytetään elintarvikkeeksi.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville. Ei erityisiä säilytysohjeita
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu läpipainopakkauksessa ja pahvipakkauksessa merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
Jaettujen tablettien kestoaika sisäpakkauksen ensimmäisen avaamisen jälkeen: 3 vuorokautta.
ERITYISVAROITUKSET
Erityisvaroitukset:
PPID-diagnoosin varmistamiseksi tulee tehdä asiaankuuluvat endokrinologiset laboratoriokokeet sekä kliinisten oireiden arviointi.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:Koska hevosen PPID diagnosoidaan tavallisesti vanhoilla hevosilla, esiintyy näillä potilailla useasti myös muita patologisia tiloja. Hoidon seuranta ja testauksen toistaminen, ks. kohta "Annostus, antoreitit ja antotavat kohde- eläinlajeittain”.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Tämä eläinlääke voi aiheuttaa tablettien jakamisen jälkeen silmä-ärsytystä, ärsyttävää hajua tai päänsärkyä. Vältä silmäaltistusta ja valmisteen sisäänhengittämistä tabletteja käsitellessä. Minimoi altistumisriski tabletteja jakaessa. Tabletteja ei esimerkiksi saa murskata.
Ihokosketuksen tapahtuessa pese altistunut iho vedellä. Jos pergolidia joutuu silmään, huuhtele altistunut silmä välittömästi vedellä ja käänny lääkärin puoleen. Nenä-ärsytyksessä on siirryttävä raikkaaseen ilmaan ja käännyttävä lääkärin puoleen, jos hengitysvaikeuksia ilmenee.
Tämä eläinlääkevalmiste voi aiheuttaa yliherkkyysreaktioita (allergisia reaktioita). Henkilöiden, joilla on tunnettu yliherkkyys pergolidille tai muille torajyväjohdannaisille, tulee välttää kosketusta eläinlääkevalmisteen kanssa.
Tämä eläinlääkevalmiste voi aiheuttaa alentuneesta prolaktiinipitoisuudesta johtuvia haittavaikutuksia, mikä on erityinen riski raskaana oleville ja imettäville naisille. Raskaana olevien tai imettävien naisten tulee välttää eläinlääkevalmisteen joutumista iholle tai kädestä suuhun käyttämällä suojakäsineitä eläinlääkevalmistetta annosteltaessa.
Eläinlääkevalmisteen nieleminen vahingossa voi aiheuttaa haittavaikutuksia erityisesti lapsille. Vahingossa tapahtuvan nielemisen välttämiseksi pidä eläinlääkevalmiste poissa lasten näkyviltä ja ulottuvilta. Tabletin osat tulee asettaa takaisin avattuun läpipainopakkauksen kuoppaan.
Läpipainopakkaukset tulee laittaa takaisin ulkopakkauksen sisälle ja säilyttää turvallisessa paikassa. Jos valmistetta on vahingossa nielty, on käännyttävä välittömästi lääkärin puoleen ja näytettävä tälle pakkausselostetta tai myyntipäällystä.
Älä syö, juo tai tupakoi tämän eläinlääkevalmisteen käytön aikana. Pese kädet käytön jälkeen.
Tiineys:
Voidaan käyttää ainoastaan hoidosta vastaavan eläinlääkärin tekemän hyöty-riskiarvion perusteella. Eläinlääkevalmisteen turvallisuutta tammojen tiineyden aikana ei ole osoitettu.
Laboratoriotutkimuksissa hiirillä ja kaneilla ei ole löydetty näyttöä epämuodostumia aiheuttavista vaikutuksista. Annoksella 5,6 mg/kg hiirillä havaittiin heikentynyttä hedelmällisyyttä.
Laktaatio:
Käyttöä ei suositella hevosilla imetyksen aikana, sillä valmisteen turvallisuutta ei ole sen osalta osoitettu. Hiirillä havaittiin jälkeläisten elopainon laskua ja alentuneita eloonjäämislukuja prolaktiinin erityksen estymisen aiheuttaman maidontuotannon epäonnistumisen vuoksi.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Varovaisuutta on noudatettava, jos valmistetta annetaan samanaikaisesti muiden proteiinien sitoutumiseen vaikuttavien lääkeaineiden kanssa.
Ei saa antaa samanaikaisesti dopamiiniantagonistien, kuten neuroleptien (fentiatsiinit, esimerkiksi asepromatsiini), domperidonin tai metoklopramidin kanssa, sillä nämä lääkeaineet voivat heikentää pergolidin vaikutusta.
Yliannostus:
Tietoja ei ole saatavilla.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
29.09.2023
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa ( https://medicines.health.europa.eu/veterinary ).
MUUT TIEDOT
Lisätietoja tästä eläinlääkkeestä saa myyntiluvan haltijan paikalliselta edustajalta.
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija:
VetViva Richter GmbH Durisolstrasse 14
4600 Wels Itävalta
Erän vapauttamisesta vastaava valmistaja:
Lelypharma BV Zuiveringsweg 42
8243 PZ Lelystad
Alankomaat
Paikalliset edustajat ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
FaunaPharma Oy c/o Oriola Oy PL8
02101 Espoo
p. +358505027788