Pakkausseloste
WILFACTIN pulver och vätska till injektionsvätska, lösning 100 IU/ml
Tilläggsinformation
WILFACTIN 500 IE pulver och vätska till injektionsvätska, lösning
WILFACTIN 1 000 IE pulver och vätska till injektionsvätska, lösning
WILFACTIN 2 000 IE pulver och vätska till injektionsvätska, lösning
human von Willebrand-faktor
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad WILFACTIN är och vad det används för
2. Vad du behöver veta innan du använder WILFACTIN
3. Hur du använder WILFACTIN
4. Eventuella biverkningar
5. Hur WILFACTIN ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
WILFACTIN framställs av plasma från människa (vätskan som finns i blodet utöver blodkropparna) och innehåller den aktiva substansen human von Willebrand-faktor (VWF).
Detta protein har betydelse för blodets förmåga att levra sig (koagulationsförmåga) och det hindrar en att blöda för länge.
VWF är inblandat i koaguleringen (levring) av blodet. Om VWF saknas, såsom vid von Willebrands sjukdom, innebär det att blodet inte koagulerar så snabbt som det ska och därmed ökar blödningsbenägenheten. När WILFACTIN ersätter VWF återställs mekanismen för blodkoagulation tillfälligt.
WILFACTIN används för att förebygga och behandla operationsblödningar eller andra blödningar vid von Willebrands sjukdom när behandling med enbart desmopressin (DDAVP) inte är effektiv eller inte kan användas.
WILFACTIN kan användas hos alla åldersgrupper.
WILFACTIN används inte vid behandling av hemofili A.
Vad du behöver veta innan produkten används
Använd inte WILFACTIN
- om du är allergisk mot human von Willebrand-faktor eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du lider av hemofili A.
Varningar och försiktighet
Din behandling med WILFACTIN bör alltid övervakas av en läkare med erfarenhet av att behandla blödningssjukdomar.
Om du får en kraftig blödning och en blodundersökning visar att du har en minskad nivå av faktor VIII i blodet, får du både VWF-produkten och en faktor VIII-produkt inom de första tolv timmarna.
Allergiska reaktioner
Precis som för alla proteinläkemedel för intravenös användning som utvinns från blod eller plasma från människa, kan överkänslighetsreaktioner i form av en allergi uppkomma.
Medan du får injektionen övervakas du noga för att upptäcka om du fär något tidig tecken på överkänslighet, såsom utslag (nässelfeber eller allmänt utbredda nässelutslag), tryck över bröstet, pipande andning, blotrycksfall (hypotoni) och svåra allergiska reaktioner (anafylaxi).
Din läkare kommer informera dig om varningstecknen på en allergisk reaktion.
Vid tecken eller symtom på överkänslighet ska du avbryta behandlingen och söka medicinsk vård omedelbart.
Virussäkerhet
När läkemedel tillverkas av blod eller plasma från människa vidtas särskilda åtgärder för att förhindra att infektioner sprids till patienterna. Dessa innefattar:
- noggrant urval av blod- och plasmagivare för att säkerställa att risken för smittbärare utesluts,
- test av varje givare och plasmapool för tecken på virus/infektioner,
- införandet av steg i hanteringen av blod och plasma som kan inaktivera eller ta bort virus.
Trots dessa åtgärder kan inte risken för att överföra en infektion helt uteslutas vid administrering av läkemedel som tillverkats av blod eller plasma från människa. Detta gäller även okända virus eller virus under utveckling eller andra typer av infektioner.
Åtgärderna som vidtas anses vara effektiva när det gäller höljeförsedda virus som t.ex. humant immunbristvirus (hiv, aids), hepatit B-virus och hepatit C-virus.
De vidtagna åtgärderna kan vara av begränsat värde mot icke höljebärande virus som t.ex. hepatit A-virus och parvovirus B19. En infektion med parvovirus B19 kan vara allvarlig för gravida kvinnor (eftersom det finns en risk för infektion hos det ofödda barnet) och för personer med immunbrist eller vissa former av blodbrist (t.ex. sicklecellsjukdom eller hemolytisk anemi).
Vaccinationer
Din läkare kan rekommendera att du överväger vaccinering mot hepatit A och B om du regelbundet/upprepade gånger får von Willebrand-faktor som utvinns ur blod från människa.
Registrering av tillverkningssatsnummer
Det rekommenderas starkt att registrera läkemedlets namn och tillverkningssatsnummer varje gång du får en dos WILFACTIN i syfte att upprätthålla en förteckning över de tillverkningssatser som används.
Risk för trombos
Blodkärl kan också blockeras av blodproppar (tromboser).
Den här risken är extra stor om du tidigare har haft eller ditt laboratorieresultat visar att du har vissa riskfaktorer.
I så fall övervakas du mycket noga avseende tidiga tecken på trombos, och en förebyggande behandling (profylax) mot att vener täpps till av blodproppar bör inledas.
Vid användningen av en von Willebrand-faktor produkt som innehåller faktor VIII ska läkaren tänka på att den fortsatta behandlingen kan orsaka en kraftig höjning av FVIII. Om du får en VWF-produkt som innehåller FVIII bör läkaren kontrollera din plasmanivå av FVIII regelbundet. På det sättet garanteras att plasmanivån av FVIII inte ständigt är för hög, vilket annars kan öka risken för tromboser.
Begränsad effektivitet
Hos patienter med von Willebrands sjukdom, särskilt typ 3-patienter, är det möjligt att proteiner kan bildas som neutraliserar effekten av VWF. Dessa proteiner kallas neutraliserande antikroppar eller inhibitorer. Om laboratorieresultaten visar att dina VWF-nivåer inte ökar, eller om blödningen inte upphör trots en tillräcklig dos av WILFACTIN, kontrollerar din läkare om det bildas VWF-inhibitorer i din kropp. Om det finns en hög koncentration av sådana inhibitorer har behandlingen med VWF eventuellt ingen effekt, utan andra behandlingsalternativ bör övervägas. Den nya behandlingen ges av en läkare med erfarenhet av att behandla blödningssjukdomar.
Andra läkemedel och WILFACTIN
Tala om för läkare eller apotekspersonal om du använder, nyligen haranvänt eller kan tänkas använda andra läkemedel.
Graviditet och amning
WILFACTIN ska användas under graviditet och amning endast om det är absolut nödvändigt.
Säkerheten för WILFACTIN under graviditet och amning har inte utvärderats i kliniska studier. Djurstudier är otillräckliga för att fastställa dess säkerhet när det gäller fertilitet, graviditet och barnets utveckling under graviditeten och efter födseln.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Inga effekter på förmågan att framföra fordon och använda maskiner har observerats.
WILFACTIN innehåller natrium
En 5 ml injektionsflaska (500 IE) WILFACTIN innehåller 0,15 mmol (3,4 mg) natrium.
Detta motsvarar 0,17 % av högsta rekommenderat dagligt intag av natrium för vuxna.
En 10 ml injektionsflaska (1 000 IE) WILFACTIN innehåller 0,3 mmol (6,9 mg) natrium.
Detta motsvarar 0,35 % av högsta rekommenderat dagligt intag av natrium för vuxna.
En 20 ml injektionsflaska (2 000 IE) WILFACTIN innehåller 0,6 mmol (13,8 mg natrium).
Detta motsvarar 0,69 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Hur produkten används
Din behandling bör inledas och övervakasav en läkare mederfarenhet av att behandla blödningssjukdomar.
Om din läkare anser att du kan använda läkemedlet hemma, kommer läkaren att ge dig lämpliga instruktioner för detta.
Dosering
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
WILFACTIN ska helst ges av en läkare eller sjuksköterska men om läkaren har ordinerat WILFACTIN för användning hemma kommer din läkare säkerställa att du instrueras hur du ska injicera WILFACTIN samt hur mycket du ska använda. Följ de instruktioner läkaren gett dig och be läkaren om hjälp om du har svårt att hantera sprutan. Sprutan ska alltid hanteras av någon som har utbildats i dess användning.
Läkare beräknar din dos av WILFACTIN (i form av internationella enheter eller IE).
Dosen beror på:
- kroppsvikt,
- blödningsstället,
- blödningens intensitet,
- ditt hälsotillstånd,
- den nödvändiga operationen,
- aktivitetsnivån av VWF i blodet efter operation,
- hur svår din sjukdom är.
Denna dos varierar mellan 40 och 80 IE/kg.
Din läkare kommer rekommendera att du lämnar blodprover under behandlingen, detta för att kontrollera:
- faktor VIII nivå (FVIII:C),
- nivå av von Willebrand-faktor (VWF:RCo),
- förekomsten av inhibitorer (hämmare),
- första tecken på bildning av blodproppar om du löper risk för denna typ av komplikation.
Beroende på resultaten av proverna kan din läkare besluta om att anpassa dosen samt hur ofta du ska få dina injektioner.
I vissa fall kan användning av en faktor VIII-produkt (ett annat koagulationsprotein) vara nödvändig i tillägg till WILFACTIN för att snabbare kunna behandla eller motverka blödning (i nödsituationer eller akuta blödningar).
WILFACTIN kan även ges som långtidsprofylax. I dessa fall bestäms dosnivån också individuellt. WILFACTIN-doser på mellan 40 och 60 IE/kg, som getts två till tre gånger per vecka, reducerar antalet blödningsepisoder.
Användning för barn och ungdomar
Dosering för barn och ungdomar baseras på kroppsvikt. I vissa fall, särskilt hos yngre patienter (yngre än 6 år), kan högre doser (upp till 100 IE/kg) krävas.
Vänd dig till din läkare om du tycker att effekten av WILFACTIN är för stark eller för svag.
Hur WILFACTIN ges
Detaljerade instruktioner för beredning av läkemedlet och hur det ges finns i slutet av denna bipacksedel.
Om du har använt för stor mängd av WILFACTIN
Inga symtom på överdosering med WILFACTIN har rapporterats.
Det går dock inte att utesluta risken för trombos i fall av en stor överdos.
Om du glömt att använda WILFACTIN
Tala med läkare om du glömmer att använda WILFACTIN.
Ta inte dubbel dos för att kompensera för glömd dos.
Om du har ytterligare frågor om detta läkemedel kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan WILFACTIN orsaka biverkningar men alla användare behöver inte få dem.
Kontakta läkare omedelbart om:
- Du upplever symtom på överkänslighet eller allergisk reaktion (mindre vanliga, kan förekomma hos upp till 1 av 100 användare).
I vissa fall kan dessa förvärras till en svår allergisk reaktion (anafylaxi) inklusive anafylaktisk chock (har rapporterats, förekommer hos ett okänt antal användare).
Varningstecken på allergisk reaktion är:
- Svårigheter att andas och att svälja
- Pipande andning
- Tryck överbröstet
- Snabbare hjärtslag
- Sänkt blodtryck eller blodtrycksfall
- Svimning
- Extrem trötthet
- Rastlöshet, nervositet
- Huvudvärk
- Frossa, frusenhet
- Rodnad, värmevallningar
- Svullnad i olika delar av kroppen
- Hudutslag, allmänt utbredda nässelutslag
- Svidande och stickande känsla vid infusionsstället
- Stickande känsla
- Kräkning
- Illamående.
| Om något av dessa uppträder ska du omedelbart avbryta behandlingen och be en läkare påbörja lämplig behandling beroende på reaktionens typ och svårighetsgrad. |
- Om du upplever att läkemedlet slutar fungera som det ska (om blödning inte minskas). Detta kan bero på inhibition (hämning) av von Willebrand-faktor (har rapporterats, förekommer hos ett okänt antal användare).
Patienter med von Willebrands sjukdom, i synnerhet typ 3-patienter, kan utveckla proteiner som kan neutralisera effekten av VWF. Dessa proteiner kallas neutraliserande antikroppar eller inhibitorer. Patienter som behandlas med VWF bör övervakas noga av sina läkare för att upptäcka bildning av inhibitorer. Övervakningen sker med hjälp av lämpliga undersökningar och laboratorietester. Bildandet av sådana inhibitorer kan visa sig som otillräckligt behandlingssvar eller förekomma samtidigt som allvarliga allergiska reaktioner.
- Om du får symtom på nedsatt blodgenomströmning i armar och ben (t.ex. om de blir kalla och bleka) eller inre organ (kan yttra sig som svåra bröstsmärtor). Detta kan bero på bildning av blodproppar i blodkärlen (har rapporterats, förekommer hos ett okänt antal användare).
Det finns en risk för bildning av blodproppar (trombos), särskilt för patienter med kända riskfaktorer för blodpropp. Efter korrigeringen av bristen på von Willbrand-faktor måste du övervakas avseende tidiga tecken på trombos eller koagulerat blod som sprids i kärlen och få behandling för att förebygga trombos i situationer som innebär en ökad risk för detta (efter operationer, under sängbundenhet, i fall av brist på koagulationsinhibitor eller fibrinolytiskt enzym).
Om du får VWF-produkter som innehåller FVIII kan risken för blodpropp också vara högre på grund av ihållande förhöjning av plasmanivåerna av FVIII.
Följande biverkning har observerats som vanliga (kan förekomma hos upp till 1 av 10 användare)
- Reaktioner på injektionsstället.
Följande biverkningar har observerats som mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
- Yrsel
- Myrkrypningar, stickningar eller liknande i huden (parestesi), minskad känslighet för beröring (hypoestesi)
- Värmevallningar
- Klåda
- Känsla av förstämdhet
- Frossa, frusenhet.
Övriga biverkningar som har rapporterats (förekommer hos ett okänt antal användare):
- Feber.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på injektionsflaskans etikett och kartongen.
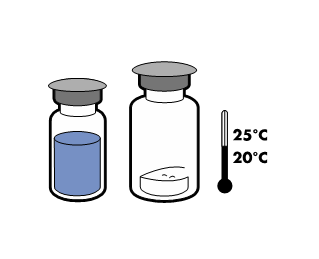
Förvaras vid högst 25 °C. Förvaras i originalförpackningen. Ljuskänsligt.
Får ej frysas.
Av sterilitetsskäl bör beredd produkt användas omedelbart. Produktens kemiska och fysikaliska stabilitet under användning har dock påvisats i 24 timmar vid 25 °C.
Använd inte detta läkemedel om du märker att lösningen är grumlig eller innehåller en bottensats.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är: human von Willebrand-faktor (500 IE, 1 000 IE eller 2 000 IE), uttryckt i internationella enheter (IE) av ristocetin-kofaktoraktivitet (VWF:RCo).
Efter beredning med 5 ml (500 IE), 10 ml (1 000 IE) eller 20 ml (2 000 IE) vatten för injektionsvätskor innehåller en injektionsflaska ca 100 IE/ml human von Willebrand-faktor.
Före tillsättning av albumin är den specifika aktiviteten större eller lika med 60 IE VWF:RCo/mg totalt protein.
Övriga ämnen är:
Pulver: humant albumin, argininhydroklorid, glycin, natriumcitrat och kalciumkloriddihydrat.
Vätska: vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
WILFACTIN leveraras i form av ett vitt eller ljustgult pulver eller sprött fast ämne och en klar eller färglös vätska till injektionsvätska, lösning. Efter beredningadministeras läkemedlet via en överföringsanordning.
WILFACTIN finns i förpackningar med 500 IE/5 ml, 1 000 IE/10 ml och 2 000 IE/20 ml.
Den beredda lösningen ska vara klar eller svagt opalskimrande, färglös eller svagt gulfärgad.
Innehavare av godkännande för försäljning och tillverkare
LFB BIOMEDICAMENTS
3 Avenue des Tropiques,
ZA de Courtaboeuf,
91940 Les Ulis,
FRANKRIKE
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen :
Finland: WILFACTIN
France: WILFACTIN
Greece: WILFACTIN
Italy: WILFACTIN
Luxembourg: WILFACTIN
The Netherlands: WILFACTIN
Denna bipacksedel ändrades senast 19.01.2024
Direktiv för användaren
Dosering
Generellt sett ökar administreringen av1 IE/kg av von Willebrand-faktor den cirkulerande nivån av VWF:RCo med nivåer på ungefär 0,02 IU/ml (2 %).
Nivåer av VWF:Rco på > 0,6 IE/ml (60 %) och FVIII:C på > 0,4 IE/ml (40 %) bör uppnås.
Hemostas kan ej garanteras förrän faktor VIII-koagulationsaktivitet (FVIII:C) har uppnått 0,4 IE/ml (40 %). Den ensamt injicerade Willebrandfaktorn inducerar en maximal ökning av FVIII:C först efter 6–12 timmar. Den kan inte korrigera nivån av FVIII:C omedelbart. Om därför patientens ursprungliga plasmanivå av FVIII:C ligger under den kritiska nivån, är det nödvändigt att administrera faktor VIII vid första injektionen av von Willebrandfaktor, för att uppnå en hemostatisk plasmanivå av FVIII:C. Detta gäller i alla situationer då en snabb korrigering av hemostasen bör ske, såsom vid behandling av blödning, allvarlig trauma eller akutkirurgi.
Om det emellertid inte är nödvändigt med en omedelbar ökning av FVIII:C, såsom om ursprungsnivån av FVIII:C är tillräcklig för att garantera hemostas eller vid en planerad operation, kan läkaren besluta att inte göra samtidig administrering av FVIII vid första injektionen.
- Behandlingsstart
Vid behandling av blödning eller trauma är den första dosen 40-80 IE/kg av WILFACTIN tillsammans med erforderlig mängd av faktor VIII produkt som bestäms på basis av patientens baseline nivåer av FVIII:C i plasma, för att uppnå adekvata FVIII:C nivåer i plasma omedelbart före ingreppet eller så snart som möjligt efter blödningens början eller efter en allvarlig trauma. Vid kirurgiska ingrepp ska den första injektionen ges 1 timme före åtgärden.
En första dos på 80 IE/kg av WILFACTIN kan krävas, särskilt hos patienter med VWD typ 3 då det kan krävas högre doser för att upprätthålla tillräckliga nivåer än för andra typer av VWD.
Vid elektiv kirurgi skall den första injektionen av WILFACTIN ges 12–24 timmar före kirurgi och den andra före åtgärden. I detta fall krävs ingen samtidig administrering av en faktor VIII-produkt, eftersom endogent FVIII:C vanligen har uppnått den kritiska nivån 0,4 IE/ml (40 %) före operation. Detta ska emellertid bekräftas i varje enskilt fall.
- Följande injektioner
Vid behov skall behandling med lämplig dos av den ensamt injicerade WILFACTIN, 40–80 IE/kg dagligen, som en eller två injektioner, fortsätta under en eller flera dagar. Vilken dos och hur ofta injektioner ges beror på operationen, patientens kliniska och biologiska tillstånd (VWF:RCo och FVIII:C) samt typ och svårighetsgrad av blödning.
- Långtidsprofylax
WILFACTIN kan ges som långtidsprofylax, i doser som anpassas för varje patient. WILFACTIN-doser på 40–60 IE/kg, vilka administreras 2–3 gånger per vecka, minskar antalet blödningsepisoder.
- Öppenvård
Behandling i hemmet kan initieras med behandlande läkares godkännande, särskilt vid fall av lätt till måttlig blödning eller under långtidsprofylax för att förebygga blödning.
Pediatrisk population
För varje indikation ska doseringen baseras på kroppsvikten. Dosen och behandlingens varaktighet ska anpassas till patientens kliniska status och plasmanivåerna av VWF:RCo och FVIII:C.
- Behandlingsstart:
- För barn yngre än 6 år kan den inledande dosen bestämmas med vägledning av inkrementellt utbyte (incremental recovery, IR) hos patienten, eller om IR-data inte finns tillgängliga, kan en inledande dos mellan 60 och 100 IE/kg krävas för att höja patientens nivåer av VWF:RCo till 100 IE/ dl.
- Doseringen till barn äldre än 6 år och ungdomar är densamma som för vuxna.
- Påföljande injektioner:
Påföljande doser till barn och ungdomar ska individanpassas utifrån klinisk status och nivåer av VWF:RCo och justeras enligt det kliniska svaret.
- Elektiv kirurgi:
- För elektiv kirurgi kan, efter en första dos administrerad 12 till 24 timmar före ingreppet, den upprepade dosen administreras 30 minuter före ingreppet för barn yngre än 6 år.
- Doseringen till barn äldre än 6 år och ungdomar är densamma som för vuxna.
- Profylax:
Dosen och frekvensen för återadministrering hos barn och ungdomar ska individanpassas utifrån inkrementellt utbyte och nivåer av VWF:RCo hos patienten och justeras enligt det kliniska svaret.
Administreringssätt och administreringsväg
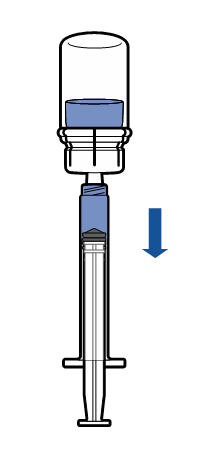
Intravenös administrering.
Beredning
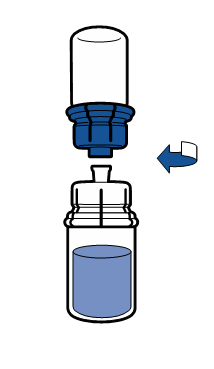
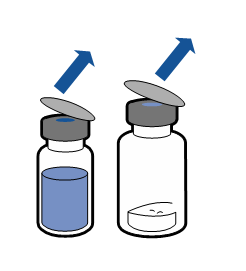
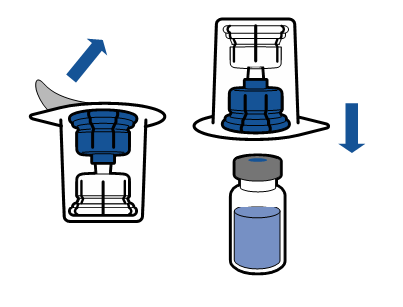
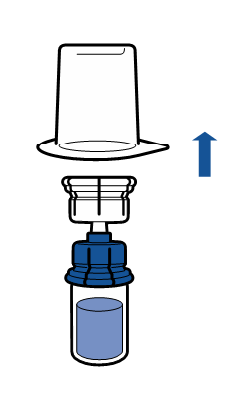
De gällande riktlinjerna för aseptiska procedurer måste följas. Överföringsanordningen (Mix2Vial) används endast för att bereda läkemedlet enligt nedanstående beskrivning. Den är inte avsedd för att administrera läkemedlet till patienten.
 |
|
 |
|
 |
|
 |
|
 |
|
|
|
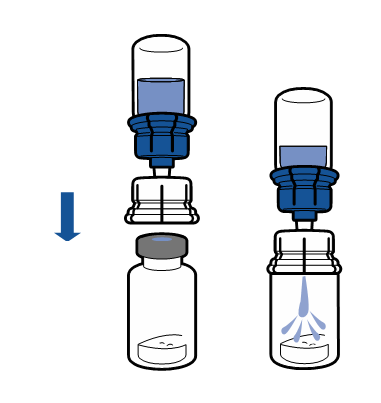
Vanligtvis löses pulvret upp omedelbart och det bör vara upplöst inom mindre än 5 minuter.
Lösningen ska vara klar eller svagt opalskimrande, färglös eller svagt gulfärgad. Den färdigberedda produkten ska inspekteras visuellt med avseende på partiklar och missfärgning före administrering.
Oklara lösningar eller lösningar med utfällning får inte användas.
Blanda inte med andra läkemedel.
Späd inte den beredda produkten.
Administrering
 |
|
Förvaring efter spädning
Av sterilitetsskäl bör beredd produkt användas omedelbart. Produktens kemiska och fysikaliska stabilitet under användning har dock påvisats i 24 timmar vid 25 °C.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.