Pakkausseloste
TYSABRI injektionsvätska, lösning i förfylld spruta 150 mg
Tilläggsinformation
Tysabri 150 mg injektionsvätska, lösning i förfylld spruta
natalizumab
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
Utöver bipacksedeln har du fått ett patientinformationskort och, om du eller en anhörig/vårdgivare ska ge injektionen, en checklista före administrering. Dessa innehåller viktig säkerhetsinformation som du behöver känna till innan och under behandlingen med Tysabri.
- Spara denna information och patientinformationskortet, du kan behöva läsa dem igen. Spara bipacksedeln och patientinformationskortet under behandlingen och sex månader efter sista dosen av detta läkemedel, eftersom biverkningar kan inträffa även efter avslutad behandling. Om du eller din anhörig/vårdgivare ger injektionen ska ni gå igenom checklistan före administrering före varje dos.
- Om du har ytterligare frågor vänd dig till läkare.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Tysabri är och vad det används för
- Vad du behöver veta innan du får Tysabri
- Hur Tysabri ges
- Eventuella biverkningar
- Hur Tysabri ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Tysabri används för att behandla multipel skleros (MS) hos vuxna. Det innehåller den aktiva substansen natalizumab. Det är en så kallad monoklonal antikropp.
MS orsakar inflammation i hjärnan som skadar nervcellerna. Denna inflammation uppstår då vita blodkroppar kommer in i hjärnan och ryggmärgen. Detta läkemedel hindrar de vita blodkropparna att komma in i hjärnan. Därigenom minskas de nervskador som MS orsakar.
Symtom på multipel skleros
Symtomen på MS kan variera från patient till patient, och det kan hända att du märker av en del av dem eller inga alls.
De kan omfatta: svårigheter att gå, domningar i ansikte, armar eller ben, problem med synen, trötthet, en känsla av dåligt balanssinne eller yrsel, problem med tarm och blåsa, svårighet att tänka och koncentrera sig, depression, akuta eller kroniska smärtor, sexuella problem, stelhet och muskelkramper.
När symtomen blossar upp kallas det ett skov (kan även kallas exacerbation eller attack). När du får ett skov kan det hända att symtomen kommer plötsligt, inom några timmar, eller att de utvecklas långsamt under flera dagar. Därefter brukar symtomen successivt bli bättre (detta kallas remission).
Hur Tysabri kan hjälpa
I kliniska prövningar har detta läkemedel ungefär halverat utvecklingstakten för de funktionsnedsättande effekterna av MS och även minskat antalet MS-skov med ungefär två tredjedelar. Medan du behandlas med detta läkemedel kanske du inte märker någon förbättring, men det kan ändå fungera så att det hindrar din MS att bli sämre.
Vad du behöver veta innan produkten används
Innan du börjar använda detta läkemedel är det viktigt att du och läkaren har diskuterat vilken nytta du kan förvänta dig av läkemedlet och vilka risker som är förenade med det.
Du får inte ges Tysabri
- Om du är allergisk mot natalizumab eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- Om du har diagnostiserats med PML (progressiv multifokal leukoencefalopati). PML är en mindre vanlig infektion i hjärnan.
- Om du har ett allvarligt problem med immunsystemet. Detta kan bero på sjukdom såsom hiv eller vara en följd av något läkemedel som du tar eller har tagit tidigare (se nedan).
- Om du tar läkemedel som påverkar immunsystemet inklusive vissa andra läkemedel som används för att behandla MS. Dessa läkemedel får inte användas samtidigt med Tysabri.
- Om du har cancer (såvida det inte är en typ av hudcancer som kallas basalcellscancer).
Varningar och försiktighet
Du bör tala med läkare om Tysabri är den lämpligaste behandlingen för dig. Gör detta innan du börjar ta detta läkemedel, och när du har fått det i mer än två år.
Föra anteckningar
För att underlätta spårbarhet av detta läkemedel ska läkaren eller apotekspersonalen dokumentera namnet och tillverkningssatsnumret på läkemedlet du har fått i din patientjournal. Du kanske också vill anteckna dessa uppgifter om någon skulle be dig om denna information senare.
Möjlig infektion i hjärnan (PML)
Några personer som får detta läkemedel (färre än 1 av 100) har fått en mindre vanlig hjärninfektion som kallas PML (progressiv multifokal leukoencefalopati). PML kan leda till allvarlig funktionsnedsättning eller till döden.
- Innan behandlingen inleds tas blodprov från alla patienter för att klarlägga JC-virusinfektion. JC-viruset är ett vanligt virus som normalt inte gör dig sjuk. PML är dock förknippat med en ökning av JC-virus i hjärnan. Anledningen till denna ökning hos vissa patienter som behandlas med Tysabri är okänd. Läkaren kommer att ta ett blodprov innan du påbörjar behandlingen och under behandlingen för att kontrollera om du har antikroppar mot JC-virus vilket är ett tecken på att du smittats av JC-viruset.
- Läkaren gör en magnetisk resonanstomografi (MRT) -undersökning som kommer att upprepas under behandlingen för att utesluta PML.
- Symtomen på PML kan likna ett MS-skov (se avsnitt Eventuella biverkningar, Eventuella biverkningar). Du kan också få PML i upp till 6 månader efter avslutad Tysabri-behandling.
- Berätta så snart som möjligt för läkaren om du tycker att din MS försämras eller om du upptäcker nya symtom medan du behandlas med Tysabri eller i upp till 6 månader efter avslutad behandling.
- Tala med din partner eller vårdgivare om vilka tecken de ska vara uppmärksamma på (se också avsnitt Eventuella biverkningar, Eventuella biverkningar). Några symtom kan vara svåra att själv märka, såsom humör- eller beteendeförändringar, förvirring, tal- och kommunikationssvårigheter. Om du får något av dessa kan du behöva ytterligare tester. Du ska vara uppmärksam på symtom som kan uppstå i upp till 6 månader efter avslutad Tysabri-behandling.
- Spara patientinformationskortet som du har fått av läkaren. Det inkluderar denna information. Visa det för din partner eller vårdgivare.
- Om du eller din anhörig/vårdgivare ger injektionen ska ni gå igenom checklistan före administrering före varje dos.
Tre saker kan öka din risk för PML i samband med Tysabri-behandling. Om du har två eller flera av dessa riskfaktorer, ökar risken ytterligare:
- Om du har antikroppar mot JC-viruset i blodet. Dessa är ett tecken på att du har viruset i din kropp. Du kommer att testas före och under Tysabri-behandlingen
- Om du behandlas under en lång tid med Tysabri, speciellt om du har behandlats längre än två år.
- Om du tidigare har tagit ett läkemedel som kallas immunsuppressivt läkemedel, vilket kan minska aktiviteten av ditt immunsystem.
Ett annat tillstånd som kallas JCV GCN (JC-virus granularcellsneuronopati) är också orsakat av JC-virus och har förekommit hos vissa patienter som fått detta läkemedel. Symtomen på JCV GCN liknar PML.
För de som har en lägre risk för att drabbas av PML kan läkaren upprepa testet regelbundet för att kontrollera att:
- du fortfarande inte har antikroppar mot JC-viruset i blodet
- du fortfarande har en lägre nivå av JC-virus-antikroppar i blodet om du har fått behandling i mer än 2 år.
Om du får PML
PML kan behandlas och Tysabri-behandlingen ska sättas ut. En del patienter får dock en reaktion då Tysabri avlägsnas från kroppen. Denna reaktion (kallad IRIS eller Immune Reconstitution Inflammatory Syndrome) kan leda till att ditt tillstånd försämras, inklusive att hjärnfunktionen försämras.
Var uppmärksam på andra infektioner
Andra infektioner förutom PML kan också vara allvarliga och kan orsakas av virus, bakterier och andra orsaker.
Tala omedelbart om för läkaren eller sjuksköterskan om du tror att du har en infektion (se också avsnitt Eventuella biverkningar. Eventuella biverkningar).
Förändringar i blodplättar
Natalizumab kan minska antalet blodplättar, som ansvarar för blodets koagulering. Detta kan leda till ett tillstånd som kallas trombocytopeni (se avsnitt Eventuella biverkningar) där blodet kanske inte levrar sig tillräckligt snabbt för att stoppa en blödning. Detta kan leda till blåmärken samt andra allvarliga problem, såsom omfattande blödningar. Du bör omedelbart tala med läkare om du har oförklarliga blåmärken, röda eller lila fläckar på huden (kallas petekier), blödning från skärsår som inte upphör eller om det sipprar blod från såret, ihållande blödning från tandkött eller näsa, blod i urin eller avföring eller blödning i ögonvitorna.
Barn och ungdomar
Ge inte detta läkemedel till barn och ungdomar under 18 års ålder.
Andra läkemedel och Tysabri
Tala om för läkaren om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
- Du får inte ges detta läkemedel om du för närvarande behandlas med läkemedel som påverkar ditt immunsystem, inklusive vissa andra läkemedel för att behandla MS.
- Du kanske inte kan använda detta läkemedel om du tidigare har fått läkemedel som påverkat ditt immunsystem.
Graviditet och amning
- Använd inte detta läkemedel om du är gravid, såvida du inte först har diskuterat detta med läkaren. Kom ihåg att genast tala om för läkaren om du är gravid, tror att du kan vara gravid, eller om du planerar att bli gravid.
- Amma inte medan du behandlas med Tysabri. Du bör diskutera med läkaren om du ska välja att sluta amma eller sluta att använda detta läkemedel.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel. Risken för barnet och nyttan för modern kommer att beaktas av läkaren.
Körförmåga och användning av maskiner
Om du får yrsel, som är en mycket vanlig biverkning, bör du inte köra bil eller använda maskiner.
Tysabri innehåller polysorbat 80 (E 433)
Detta läkemedel innehåller 0,4 mg polysorbat 80 per förfylld spruta, motsvarande 0,8 mg per dos. Polysorbater kan orsaka allergiska reaktioner. Tala om för din läkare om du har några kända allergier.
Tysabri innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per 300 mg dos, d.v.s. är näst intill ”natriumfritt”.
Hur produkten används
En läkare med erfarenhet av behandling av MS förskriver Tysabri-injektioner till dig. Det kan hända att läkaren byter direkt från ett annat läkemedel för MS till Tysabri om det inte finns några tecken på problem orsakade av din tidigare behandling.
- Läkaren tar blodprover för att testa för antikroppar mot JC-virus och andra möjliga problem.
- Läkaren kommer att göra en magnetisk resonanstomografi (MRT) -undersökning som kommer att upprepas under behandlingen.
- För att byta från vissa läkemedel som används för behandling av MS kan det hända att läkaren ger dig rådet att vänta en viss tid för att säkerställa att det mesta av det tidigare läkemedlet har försvunnit ur kroppen.
- Om ditt tillstånd medger det kan läkaren diskutera med dig om alternativet att få injektionerna utanför specialistsjukvård (t.ex. i hemmet). Dessa injektioner kan ges av hälso- och sjukvårdspersonal, dig själv eller en anhörig/vårdgivare under förutsättning att du uppfyller vissa kriterier. Du kommer fortfarande att behöva gå på klinik- eller sjukhusbesök, inklusive besök för regelbundna blodprover och MRT-undersökningar.
- Om läkaren anser att du är lämplig för att själv ge injektionerna (eller att din anhörig/vårdgivare ger injektionerna), kommer hälso- och sjukvårdspersonal att vara med dig när du tar de första två doserna (2 injektioner vardera).
- Hälso- och sjukvårdspersonalen kommer att ge dig och din anhörig/vårdgivare detaljerade instruktioner och visa hur man förbereder och injicerar läkemedlet innan du använder sprutorna första gången.
- Om läkaren anser att det är lämpligt att du själv eller en anhörig/vårdgivare ger dig injektionerna ska du läsa patientinformationskortet för att gå igenom listan över PML-symtom samt checklistan före administrering före varje dos. Om symtom uppträder eller förvärras ska du inte ta dosen utan omedelbart kontakta läkare.
- Rekommenderad dos för vuxna är 300 mg en gång var fjärde vecka.
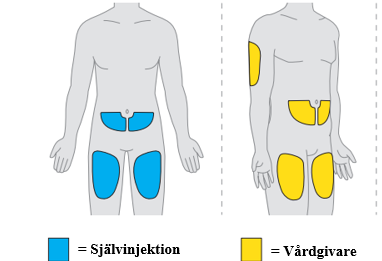
- Varje dos ges som två injektioner under huden, i låret, buken (minst 6 centimeter från naveln) eller baksidan av armen (det senare bara då injektion ges av hälso- och sjukvårdspersonal eller en anhörig/vårdgivare). Detta tar upp till 30 minuter.
- Information om hur man förbereder och injicerar läkemedlet finns i slutet av denna bipacksedel.
Om du slutar använda Tysabri
Regelbunden dosering med detta läkemedel är viktig, särskilt under de första månaderna av behandlingen. Det är viktigt att fortsätta med ditt läkemedel så länge som du och läkaren anser att det hjälper dig. Sluta inte att använda ditt läkemedel om inte läkaren har sagt att du ska göra det. Patienter som fått en eller två doser Tysabri och sedan haft en paus i behandlingen på 3 månader eller mer har varit mer benägna att få en allergisk reaktion när behandlingen återupptagits.
Allergiska reaktioner
Några patienter har fått allergiska reaktioner mot detta läkemedel. Läkaren kan komma att under injektionen och 1 timme därefter kontrollera om du får någon allergisk reaktion. Om du eller en anhörig/vårdgivare injicerar läkemedlet och du får en allergisk reaktion, ska du avbryta injektionen och omedelbart söka medicinsk vård. Se också avsnitt Eventuella biverkningar, Eventuella biverkningar.
Om du missar din Tysabri-dos
Om du skulle missa din ordinarie Tysabri-dos ska du komma överens med läkaren om att få den så fort som möjligt. Därefter kan du fortsätta att få Tysabri var fjärde vecka.
Två sprutor behöver ges för en fullständig dos. Det är viktigt att båda sprutorna ges och att du får dem enligt det ordinerade doseringsschemat. Om du eller din anhörig/vårdgivare ger injektionerna och du har missat en dos, eller om du bara har fått en spruta, ska du kontakta läkare så snart som möjligt för att få råd.
Fungerar Tysabri alltid?
Hos vissa patienter som får Tysabri kan kroppens naturliga försvar så småningom hindra läkemedlet att fungera som det ska då kroppen utvecklar antikroppar mot läkemedlet. Läkaren kan ta reda på om detta läkemedel inte fungerar på rätt sätt för dig genom att ta blodprov och kommer att, om så krävs, avbryta din behandling.
Fråga läkaren om du har ytterligare frågor om Tysabri. Använd alltid detta läkemedel exakt enligt beskrivning i denna bipacksedel eller enligt anvisningar från läkaren. Rådfråga läkare om du är osäker.
Subkutant förkortas som s.c. på sprutans etikett.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Berätta genast för läkaren eller sjuksköterskan om du märker något av följande.
Tecken på en infektion i hjärnan
- Förändringar av personlighet och beteende, till exempel förvirring, delirium eller förlust av medvetandet
- Kramper (anfall)
- Huvudvärk
- Illamående/kräkning
- Nackstelhet
- Extrem känslighet för starkt ljus
- Feber
- Utslag (var som helst på kroppen)
Dessa symtom kan orsakas av en infektion i hjärnan (encefalit eller PML) eller i hinnorna runt hjärnan (meningit).
Tecken på andra allvarliga infektioner
- Oförklarlig feber
- Svår diarré
- Andfåddhet
- Långvarig yrsel
- Huvudvärk
- Viktminskning
- Slöhet
- Försämrad syn
- Smärta i ögat/ögonen eller röda ögon
Tecken på en allergisk reaktion
- Kliande utslag (nässelutslag)
- Svullnad i ansikte, läppar eller tunga
- Andningssvårigheter
- Smärta eller obehag i bröstkorgen
- Ökat eller minskat blodtryck (läkaren eller sjuksköterskan märker detta om de kontrollerar ditt blodtryck)
Dessa tecken är troligast under eller strax efter injektionen.
Tecken på eventuellt leverproblem
- Gulnande hud eller ögonvitor
- Ovanlig mörkfärgning av urinen.
- Onormala leverfunktionstester
Tala genast med en läkare eller sjuksköterska om du får någon av biverkningarna som listas ovan eller om du tror att du fått en infektion. Visa patientinformationskortet och denna bipacksedel för alla behandlande läkare eller sjuksköterskor, inte endast för neurologen,
Andra biverkningar
Mycket vanliga (kan förekomma hos fler än 1 av 10 patienter)
- Urinvägsinfektion
- Halsont och rinnande eller täppt näsa
- Huvudvärk
- Yrsel
- Illamående
- Ledvärk
- Trötthet
Vanliga (kan förekomma hos upp till 1 av 10 patienter)
- Anemi (sänkta nivåer av röda blodkroppar som kan leda till blekhet och kan orsaka känsla av andfåddhet eller brist på energi)
- Allergi (överkänslighet)
- Darrningar
- Kliande utslag (nässelutslag)
- Kräkningar
- Feber
- Svårighet att andas (dyspné)
- Rodnad i ansikte eller på kroppen (vallningar)
- Herpesinfektioner
- Obehag vid injektionsstället. Du kan uppleva smärta, blåmärken, rodnad, klåda eller svullnad
Mindre vanliga (kan förekomma hos upp till 1 av 100 patienter)
- Svår allergi (anafylaktisk reaktion)
- Progressiv multifokal leukoencefalopati (PML)
- Inflammatorisk störning efter utsättning av läkemedlet
- Svullnad i ansikte
- Ett ökat antal vita blodkroppar (eosinofili)
- Minskat antal blodplättar
- Lätt att få blåmärken (purpura)
Sällsynta (kan förekomma hos upp till 1 av 1 000 patienter)
- Herpesinfektion i ögat
- Svår anemi (sänkta nivåer av röda blodkroppar som kan leda till blekhet och kan orsaka känsla av andfåddhet eller brist på energi)
- Svår svullnad under huden
- Höga halter av bilirubin i blodet (hyperbilirubinemi) som kan orsaka symtom som gula ögon eller hud, feber eller trötthet
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
- Ovanliga infektioner i hjärna och ögon
- Leverskada
Tala med läkaren så fort som möjligt om du tror att du fått en infektion.
Den här informationen hittar du också på det patientinformationskort som du fått av läkaren.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via:
Finland
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Sverige
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på etiketten och kartongen. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2–8 °C).
Får ej frysas.
Förvara sprutorna i ytterkartongen. Ljuskänsligt.
De förfyllda sprutorna kan förvaras vid rumstemperatur (högst 30 °C) sammanlagt högst 24 timmar, inklusive den tid det tar för sprutorna att nå rumstemperatur för administrering. Sprutorna kan sättas tillbaka i kylskåpet och användas före utgångsdatumet som anges på etiketten och kartongen. Datum och tidpunkt när förpackningen tas ut ur kylskåpet ska antecknas på kartongen. Kassera sprutorna om de lämnats utanför kylskåpet mer än 24 timmar. Använd inte externa värmekällor, såsom varmt vatten, för att värma upp de förfyllda sprutorna.
Använd inte detta läkemedel om du ser partiklar i vätskan och/eller vätskan i sprutan är missfärgad.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är natalizumab.
Varje 1 ml förfylld spruta innehåller 150 mg natalizumab.
Övriga innehållsämnen är:
Natriumdivätefosfatmonohydrat
Dinatriumvätefosfatheptahydrat
Natriumklorid (se avsnitt Vad du behöver veta innan produkten används ”Tysabri innehåller natrium”)
Polysorbat 80 (E 433)
Vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
Tysabri är en färglös till svagt gul, lätt opalskimrande till opalskimrande vätska.
Varje kartong innehåller två sprutor.
Tysabri finns tillgänglig i förpackningar med två eller sex förfyllda sprutor.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Biogen Netherlands B.V.
Prins Mauritslaan 13
1171 LP Badhoevedorp
Nederländerna
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Biogen Finland Oy
Puh/Tel: +358 207 401 200
Denna bipacksedel ändrades senast 01/2026.
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu/.
Direktiv för användaren
Tysabri 150 mg
injektionsvätska, lösning
natalizumab
injektion för subkutan användning
Fullständig dos = två förfyllda sprutor
Denna bruksanvisning innehåller information om hur Tysabri förfylld spruta ska injiceras.
Läs bruksanvisningen innan du börjar använda Tysabri förfylld spruta (kallas ”spruta” i dessa instruktioner) och varje gång du hämtar ut läkemedlet igen. Det kan ha tillkommit ny information.
Denna information ersätter inte samtal med hälso- och sjukvårdspersonal om din sjukdom eller behandling.
Tysabri-sprutans delar
Ta inte bort fingergreppet. Fingergreppet gör att du kan hålla sprutan mer stadigt under injektionsprocessen.
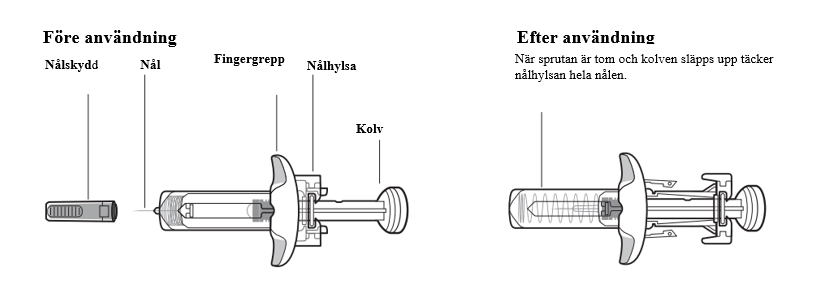
Viktig information som du behöver känna till innan du börjar injicera Tysabri
Tysabri tillhandahålls i en förfylld spruta (kallas ”spruta” i dessa instruktioner). Varje Tysabri-kartong innehåller två sprutor. För att få fullständig dos behöver du använda båda sprutorna inom 30 minuter efter varandra.
- Om du eller en anhörig/vårdgivare ska ge injektionerna ska hälso- och sjukvårdspersonalen visa hur man förbereder och injicerar läkemedlet innan sprutorna används första gången. Om du eller din anhörig/vårdgivare ger injektionerna och har missat en dos, eller bara har injicerat dosen från en spruta, ska du kontakta apotekspersonal eller behandlande läkare.
- Sprutorna är endast avsedda för subkutan injektion (injicera direkt i fettvävnaden under huden).
- En spruta kan bara användas en gång (engångsbruk). Sprutorna kan inte återanvändas.
- Dela inte sprutor med andra, även om de har samma sjukdom som du. Du kan ge dem en infektion eller få en infektion av dem.
Anmärkning för hälso- och sjukvårdspersonal:
Patienter ska observeras under de subkutana injektionerna och i 1 timme efteråt för att se om de uppvisar tecken och symtom på injektionsreaktioner, inklusive överkänslighet. Efter de första sex Tysabri-doserna, oavsett administreringsväg, ska patienter observeras efter subkutan injektion enligt klinisk bedömning.
Förvaring av Tysabri
- Förvara sprutan och allt läkemedel utom syn- och räckhåll för barn.
- Förvara sprutorna i kylskåp (2 °C till 8 °C).
- Vid behov kan sprutorna förvaras vid rumstemperatur (upp till 30 °C) i upp till totalt 24 timmar. Om sprutorna har förvarats utanför kylskåp i mer än 24 timmar ska de inte användas.
- Förvara sprutorna i originalkartongen för att skydda dem mot solljus.
- Sprutorna får inte frysas eller utsättas för temperaturer över 30 °C.
- Sprutorna kan sättas tillbaka i kylskåpet och användas före utgångsdatumet som anges på etiketten och kartongen.
Förberedelser för att injicera Tysabri:
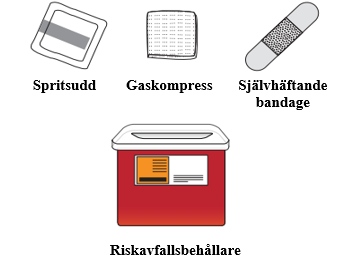
1. Samla ihop materialet.
|
|
2. Ta ut 2 sprutor ur kylskåpet och vänta i 30 minuter.
|  |
| Använd inte externa värmekällor, till exempel varmt vatten, för att värma sprutorna. | |
3. Tvätta och torka händerna.
|  |
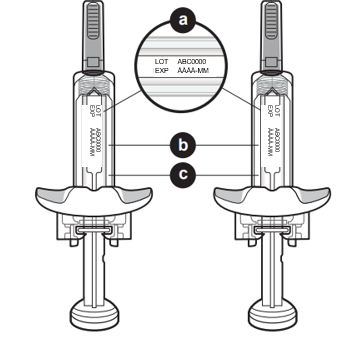
4. Kontrollera sprutorna. a. Kontrollera utgångsdatumet på båda sprutorna (se punkt a på bilden). |
|
| Använd inte sprutan om utgångsdatumet har passerat. | |
| b. Kontrollera om sprutorna är skadade eller spruckna (se punkt b på bilden). | |
| Använd inte sprutan om den är skadad eller sprucken. | |
| c. Kontrollera att läkemedlet i båda sprutorna är färglöst till svagt gult, klart till lätt opalskimrande (pärlemorskimrande) och fritt från synliga partiklar (se punkt c på bilden). | |
Använd inte sprutan om vätskan har synliga partiklar. Använd inte sprutan om den har tappats före användning. Meddela hälso- och sjukvårdspersonalen om du har något av dessa problem med sprutorna. | |
Du kan se bubblor i läkemedlet. Detta är normalt. Observera: Läkemedlets utseende kan förändras efter att det tagits ut ur kylskåpet. Detta är normalt. | |
5. Välj det första injektionsstället. a. Använd ett av följande injektionsställen:
b. Injicera inte i ett område på kroppen där huden är öm, röd, infekterad eller har blåmärken eller ärr. c. Byt injektionsställe mellan injektionerna. | 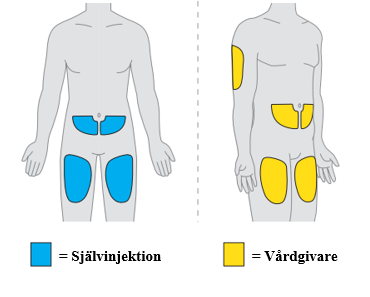 |
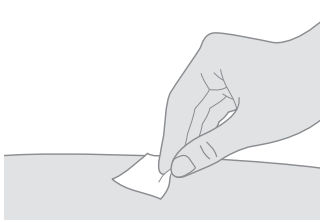
6. Rengör det första injektionsstället. a. Torka av huden med en spritsudd. b. Låt injektionsstället lufttorka innan du injicerar dosen. | 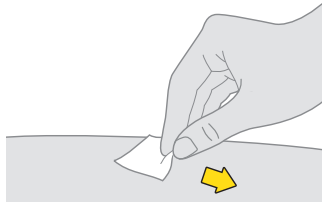 |
| Rör inte och fläkta eller blås inte på det rengjorda området. |
Injicera dosen från den första sprutan
7. Ta av nålskyddet. a. Håll sprutkroppen i ena handen med nålen riktad uppåt. b. Håll fast nålskyddet med den andra handen och dra det rakt av nålen. c. Kasta nålskyddet genast efter att du har tagit bort det. Observera: Du kan se en droppe vätska på nålspetsen. Detta är normalt. | 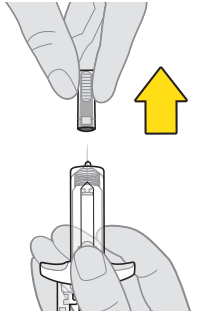 |
| |
8. För in nålen i första injektionsstället. a. Nyp ihop huden runt det rengjorda injektionsstället. b. Håll sprutan som en penna med den andra handen och för in nålen med en snabb, pilkastliknande rörelse i en vinkel på 45 till 90 grader tills nålen är helt under huden. | 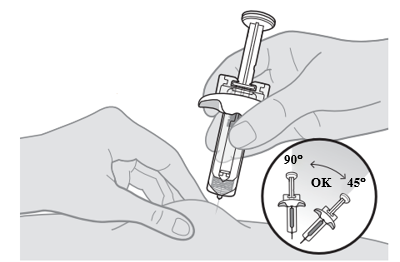 |
9. Ge den första injektionen. a. När nålen är under huden släpper du taget om hudvecket. b. Tryck långsamt in kolven hela vägen ned, så långt det går, för att injicera allt läkemedel. | 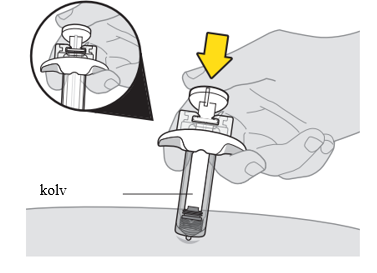 |
| Se till att trycka in kolven hela vägen ned så att du får allt läkemedel och nålhylsan aktiveras. | |
10. Ta ut nålen från injektionsstället.
| 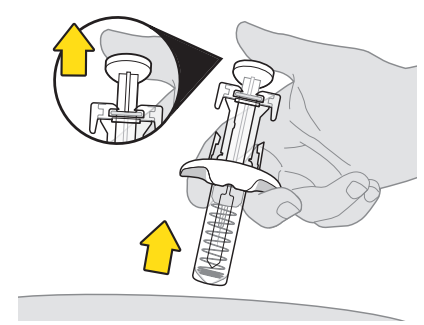 |
| Om nålhylsan inte aktiveras så att den täcker nålen ska du inte sätta tillbaka nålskyddet. Lägg den i riskavfallsbehållaren och kontakta hälso- och sjukvårdspersonal för att få hjälp. | |
11. Kontrollera och ta hand om injektionsstället.
|  |
Injicera dosen från den andra sprutan
12. Välj det andra injektionsstället. a. Välj ett annat område att injicera i. Du kan använda ett av följande injektionsställen:
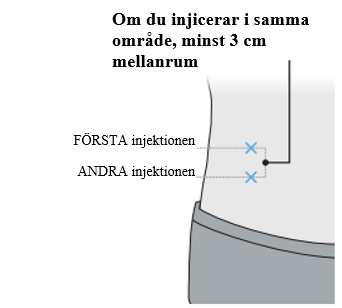
b. Injicera inte i ett område på kroppen där huden är öm, röd, infekterad eller har blåmärken eller ärr. c. Byt injektionsställe mellan injektionerna. d. Om du använder samma område på kroppen, se till att det andra injektionsstället är minst 3 centimeter från det första injektionsstället. |
|
13. Rengör det andra injektionsstället. a. Torka av huden med en spritsudd. b. Låt injektionsstället lufttorka innan du injicerar dosen. | 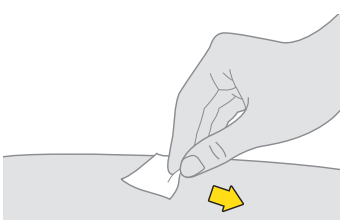 |
| Rör inte och fläkta eller blås inte på det rengjorda området. | |
14. Ge den andra injektionen. a. Upprepa steg 7–11 för att injicera dosen från den ANDRA sprutan för att få fullständig dos. Ge injektionerna efter varandra utan större fördröjning. Den andra injektionen ska ges senast 30 minuter efter den första injektionen. | 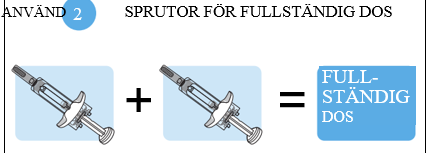 |
Kassera Tysabri
15. Kassera båda sprutorna. Lägg båda sprutorna i en riskavfallsbehållare genast efter användning. | 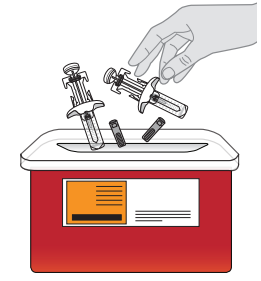 |
| Kasta inte den använda riskavfallsbehållaren eller använda sprutor bland hushållsavfall. | |
Om du inte har någon riskavfallsbehållare kan du be hälso- och sjukvårdspersonalen om en sådan eller använda en hushållsbehållare som
När riskavfallsbehållaren nästan är full ska du följa lokala anvisningar för hur den ska kasseras. Det kan finnas lokala eller regionala bestämmelser om hur du ska kassera använda sprutor. Kasta inte den använda riskavfallsbehållaren bland hushållsavfall om inte anvisningarna i din kommun tillåter detta. Lämna inte den använda riskavfallsbehållaren till återvinning. | |