Pakkausseloste
TYSABRI injektioneste, liuos, esitäytetty ruisku 150 mg
Tysabri 150 mg injektioneste, liuos, esitäytetty ruisku
natalitsumabi (natalizumab)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
Saat tämän pakkausselosteen lisäksi myös potilaan seurantakortin, ja jos pistät lääkkeen itse tai hoitaja antaa pistokset sinulle, saat myös lääkkeen antoa edeltävän tarkistuslistan. Ne sisältävät tärkeitä turvallisuustietoja. Sinun on oltava niistä tietoinen ennen Tysabri-hoidon aloittamista ja hoidon aikana.
- Säilytä tämä pakkausseloste ja potilaan seurantakortti. Voit tarvita niitä myöhemmin. Pidä pakkausseloste ja potilaan seurantakortti mukanasi hoidon aikana ja kuuden kuukauden ajan viimeisen lääkeannoksen jälkeen, sillä haittavaikutuksia voi esiintyä vielä hoidon lopettamisen jälkeenkin. Jos pistät lääkkeen itse tai hoitajasi antaa pistokset sinulle, käy läpi lääkkeen antoa edeltävä tarkistuslista ennen jokaista annosta.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Tysabri on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat Tysabri-valmistetta
3. Miten Tysabri-valmistetta annetaan
4. Mahdolliset haittavaikutukset
5. Tysabri-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Tysabri-valmistetta käytetään aikuisille multippeliskleroosin (MS-taudin) hoitoon. Sen vaikuttava aine on natalitsumabi, joka on ns. monoklonaalinen vasta-aine.
MS-tauti aiheuttaa aivojen tulehdustilan, joka vahingoittaa hermosoluja. Tulehdus syntyy, kun veren valkosolut pääsevät aivoihin ja selkäytimeen. Tämä lääke estää valkosolujen pääsyn aivoihin ja siten vähentää MS-taudin aiheuttamia hermovaurioita.
Multippeliskleroosin oireet
MS-taudin oireet ovat potilaskohtaisia, ja sinulla voi esiintyä joitakin tai ei mitään niistä.
Niitä voivat olla seuraavat oireet: kävelyvaikeudet, kasvojen, käsivarsien tai jalkojen tunnottomuus, näköhäiriöt, väsymys, horjuvuuden tai huimauksen tunne, virtsaamis- ja ulostushäiriöt, ajattelu- ja keskittymisvaikeudet, masennus, akuutti tai krooninen kipu, sukupuolielämän vaikeudet, jäykkyys ja lihaskouristukset.
Oireiden äkillistä pahenemista kutsutaan relapsiksi (taudin pahenemisvaiheeksi). Kun sinulle kehittyy relapsi, saatat havaita oireiden ilmenevän yhtäkkiä, muutaman tunnin kuluessa, tai hitaammin useiden päivien kuluessa. Oireet lievittyvät yleensä vähitellen (tätä kutsutaan remissioksi).
Mitä apua Tysabri-valmisteesta voi olla
Tutkimuksissa tämä lääke hidasti MS-taudin aiheuttamaa toimintakyvyn heikkenemistä noin puolella ja vähensi MS-relapsien lukumäärää noin kahdella kolmasosalla. Et välttämättä huomaa tämän lääkehoidon vaikutuksia MS-tautiisi, mutta se saattaa kuitenkin estää MS‑tautiasi pahenemasta.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Ennen kuin tämän lääkkeen käyttö aloitetaan, on tärkeää, että olet keskustellut lääkärin kanssa hoidon mahdollisista hyödyistä ja hoitoon liittyvistä riskeistä.
Sinulle ei saa antaa Tysabri-valmistetta
- jos olet allerginen natalitsumabille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on todettu progressiivinen multifokaalinen leukoenkefalopatia (PML). Progressiivinen multifokaalinen leukoenkefalopatia on melko harvinainen aivoinfektio.
- jos sinulla on vakava immuunijärjestelmän ongelma (se voi johtua sairaudesta, kuten HIV-infektiosta, tai jostakin parhaillaan tai aiemmin käyttämästäsi lääkkeestä, ks. jäljempänä).
- jos käytät lääkkeitä, jotka vaikuttavat immuunijärjestelmääsi, mukaan lukien tiettyjä muita MS-taudin hoitoon käytettäviä lääkkeitä. Nämä lääkkeet ovat kiellettyjä Tysabri-hoidon aikana.
- jos sinulla on syöpä (ihon tyvisolusyöpää lukuun ottamatta).
Varoitukset ja varotoimet
Sinun on keskusteltava lääkärin kanssa siitä, onko Tysabri sinulle sopivin hoito. Tee niin ennen kuin aloitat tämän lääkkeen käytön ja kun olet saanut hoitoa yli kahden vuoden ajan.
Tietojen kirjaaminen
Tämän lääkkeen jäljitettävyyden parantamiseksi lääkärin tai apteekkihenkilökunnan tulee kirjata saamasi valmisteen nimi ja eränumero potilastietoihisi. Sinunkin kannattaa ehkä merkitä nämä tiedot muistiin siltä varalta, että niitä kysytään myöhemmin.
Mahdollinen aivoinfektio (progressiivinen multifokaalinen leukoenkefalopatia)
Joillekin tätä lääkettä saaneille henkilöille (alle 1 henkilölle 100:sta) on kehittynyt melko harvinainen aivoinfektio, joka tunnetaan nimellä progressiivinen multifokaalinen leukoenkefalopatia (PML). Progressiivinen multifokaalinen leukoenkefalopatia voi johtaa toimintakyvyn vaikeaan heikkenemiseen tai jopa kuolemaan.
- Ennen hoidon aloittamista lääkäri määrää kaikille potilaille verikokeita mahdollisen JC-virusinfektion selvittämiseksi. JC-virus on yleinen virus, joka ei yleensä aiheuta sairautta. Progressiiviseen multifokaaliseen leukoenkefalopatiaan liittyy kuitenkin JC-viruksen lisääntymistä aivoissa. Ei tiedetä, miksi tätä tapahtuu joillakin Tysabri-hoitoa saavilla potilailla. Lääkäri tarkistaa verikokeella ennen hoidon aloittamista ja sen aikana, onko elimistössäsi JC‑viruksen vasta-aineita. Vasta-aineet ovat merkki siitä, että olet saanut JC-virusinfektion.
- Lääkäri lähettää sinut magneettikuvaukseen, joka toistetaan hoidon aikana progressiivisen multifokaalisen leukoenkefalopatian poissulkemiseksi.
- Progressiivisen multifokaalisen leukoenkefalopatian oireet saattavat muistuttaa MS-taudin relapsin oireita (ks. kohta Mahdolliset haittavaikutukset, Mahdolliset haittavaikutukset). Progressiivinen multifokaalinen leukoenkefalopatia voi kehittyä jopa 6 kuukautta Tysabri-hoidon lopettamisen jälkeen.
Kerro lääkärille mahdollisimman pian, jos huomaat MS-tautisi pahenevan tai jos havaitset uusia oireita Tysabri-hoidon aikana tai vielä 6 kuukautta Tysabri-hoidon lopettamisen jälkeen.
- Kerro kumppanillesi tai hoitajillesi, millaisia oireita pitää tarkkailla (ks. myös kohta Mahdolliset haittavaikutukset, Mahdolliset haittavaikutukset). Joitakin oireita voi olla vaikea huomata itse, kuten mielialan tai käyttäytymisen muutoksia, sekavuutta tai puhe- ja kommunikaatiovaikeuksia. Jos sinulle ilmaantuu tällaisia oireita, lisätutkimukset voivat olla tarpeen. Tarkkaile oireita 6 kuukauden ajan Tysabri-hoidon lopettamisen jälkeen.
- Säilytä potilaan seurantakortti, jonka olet saanut lääkäriltäsi. Kortti sisältää nämä tiedot. Näytä se kumppanillesi tai hoitajillesi.
- Jos pistät lääkkeen itse tai hoitajasi antaa pistokset sinulle, käy läpi lääkkeen antoa edeltävä tarkistuslista ennen jokaista annosta.
Kolme seikkaa voi suurentaa progressiivisen multifokaalisen leukoenkefalopatian riskiä Tysabri-hoidon aikana. Jos sinulla on vähintään kaksi näistä riskitekijöistä, riski suurenee entisestään:
- jos veressäsi on JC-virusvasta-aineita. Tämä tarkoittaa, että elimistössäsi on kyseistä virusta. Sinut testataan ennen Tysabri-hoidon aloittamista ja sen aikana.
- jos Tysabri-hoitosi jatkuu kauan, erityisesti jos se on jatkunut yli kaksi vuotta.
- jos olet aiemmin käyttänyt lääkkeitä, joita kutsutaan immunosuppressanteiksi . Ne ovat elimistön immuunijärjestelmän toimintaa vähentäviä lääkkeitä.
Toinen sairaus nimeltä JC-viruksen aiheuttama jyväissoluneuronopatia on myös JC-viruksen aiheuttama, ja sitä on todettu joillakin tätä lääkettä saaneilla potilailla. JC-viruksen aiheuttaman jyväissoluneuronopatian oireet ovat samankaltaisia kuin progressiivisen multifokaalisen leukoenkefalopatian oireet.
Jos progressiivisen multifokaalisen leukoenkefalopatian riskisi on pienempi, lääkäri voi toistaa verikokeen säännöllisin välein tarkistaakseen, että
- Sinulla ei edelleenkään ole JC-viruksen vasta-aineita veressäsi
- Jos olet saanut hoitoa yli 2 vuotta, JC-viruksen vasta-aineiden määrä veressäsi on edelleen pieni.
Jos progressiivinen multifokaalinen leukoenkefalopatia kehittyy
Progressiivista multifokaalista leukoenkefalopatia voidaan hoitaa, ja Tysabri-hoito lopetetaan. Kun Tysabri poistuu elimistöstä, joillekin henkilöille kuitenkin kehittyy elpyvän immuniteetin tulehdusoireyhtymä (nk. IRIS-reaktio). Se saattaa pahentaa sairauttasi ja myös heikentää aivojen toimintaa.
Tarkkaile muita infektioita
Progressiivisen multifokaalisen leukoenkefalopatian lisäksi myös jotkin muut virusten tai bakteerien aiheuttamat tai muista syistä johtuvat infektiot voivat olla vakavia.
Kerro välittömästi lääkärille tai sairaanhoitajalle, jos epäilet saaneesi infektion (ks. myös kohta Mahdolliset haittavaikutukset, Mahdolliset haittavaikutukset).
Verihiutaleiden muutokset
Natalitsumabi saattaa vähentää veren hyytymisestä vastaavien verihiutaleiden määrää veressä. Tämä voi johtaa tilaan, jonka nimi on verihiutaleniukkuus (ks. kohta Mahdolliset haittavaikutukset) ja jossa veri ei hyydy tarpeeksi nopeasti verenvuodon tyrehdyttämiseksi. Seurauksena voi olla mustelmia sekä muita vakavampia ongelmia, kuten runsas verenvuoto. Kerro heti lääkärille, jos havaitset selittämättömiä mustelmia, punaisia tai purppuranvärisiä pisteitä iholla (petekioita), haavoja, joissa verenvuoto ei tyrehdy tai joista tihkuu verta, pitkäkestoista verenvuotoa ikenistä tai nenästä, verta virtsassa tai ulosteessa tai silmän valkuaisten verenvuotoa.
Lapset ja nuoret
Älä anna tätä lääkettä alle 18-vuotiaille lapsille tai nuorille.
Muut lääkevalmisteet ja Tysabri
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
- Sinulle ei saa antaa tätä lääkettä, jos sinua hoidetaan parhaillaan immuunijärjestelmään vaikuttavilla lääkkeillä, mukaan lukien tietyt muut MS-taudin hoitoon käytettävät lääkkeet.
- Et ehkä voi käyttää tätä lääkettä, jos olet aiemmin saanut immuunijärjestelmään vaikuttavia lääkkeitä.
Raskaus ja imetys
- Älä käytä tätä lääkettä, jos olet raskaana, ellet ole keskustellut asiasta lääkärin kanssa. Ota välittömästi yhteys lääkäriisi, jos tulet raskaaksi tai epäilet olevasi raskaana tai jos suunnittelet raskautta.
- Älä imetä Tysabri-hoidon aikana. Lääkäri auttaa sinua päättämään, pitäisikö sinun lopettaa imetys vai tämän lääkkeen käyttö.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä. Lääkäri ottaa huomioon hoidosta aiheutuvan riskin lapselle ja hoidosta koituvan hyödyn äidille.
Ajaminen ja koneiden käyttö
Huimaus on hyvin yleinen haittavaikutus. Jos sinulla esiintyy huimausta, älä aja autoa äläkä käytä koneita.
Tysabri sisältää polysorbaattia 80 (E 433)
Tämä lääkevalmiste sisältää 0,4 mg polysorbaattia 80 per esitäytetty ruisku, joka vastaa 0,8 mg:aa/annos. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla on allergioita, kerro asiasta lääkärille.
Tysabri sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 300 mg:n annos eli sen voidaan sanoa olevan ”natriumiton”.
Miten valmistetta käytetään
Tysabri-injektiot määrää MS-taudin hoitoon perehtynyt lääkäri. Lääkäri saattaa vaihtaa lääkityksesi suoraan toisesta lääkkeestä Tysabri-valmisteeseen, jos sinulla ei havaita merkkejä aiemman lääkityksen aiheuttamista ongelmista.
- Lääkäri määrää verikokeita, joilla tarkistetaan, onko sinulla JC-viruksen vasta-aineita, ja selvitetään muut mahdolliset ongelmat.
- Lääkäri lähettää sinut magneettikuvaukseen, joka toistetaan hoidon aikana.
- Tietyistä MS-taudin hoitoon käytettävistä lääkkeistä vaihdettaessa lääkäri saattaa neuvoa sinua odottamaan tietyn ajan, jotta suurin osa aiemmasta lääkkeestä ehtii ensin poistua elimistöstäsi.
- Lääkäri voi keskustella kanssasi injektioiden antamisesta erikoissairaanhoidon ulkopuolella (esim. kotona), jos sairautesi sen sallii. Tällöin injektioiden antajana voi olla terveydenhuollon ammattilainen, sinä itse tai hoitajasi, jos täytät tietyt vaatimukset. Sinun on silti käytävä klinikalla tai sairaalassa vastaanottokäynneillä ja myös säännöllisesti verikokeissa ja magneettikuvauksissa.
- Jos lääkäri katsoo, että voit pistää lääkkeen itse (tai että hoitajasi voi antaa pistokset sinulle), ensimmäiset kaksi annosta (joista kumpikin käsittää kaksi pistosta) annetaan terveydenhuollon ammattilaisen valvonnassa.
- Terveydenhuollon ammattilainen antaa sinulle tai hoitajallesi yksityiskohtaiset ohjeet ja näyttää ennen kuin käytät ruiskuja ensimmäisen kerran, miten lääke valmistellaan ja pistetään.
- Jos lääkäri katsoo, että voit pistää lääkkeen itse tai että hoitajasi voi antaa pistokset sinulle, lue potilaan seurantakortista luettelo PML:n oireista ja käy läpi lääkkeen antoa edeltävä tarkistuslista ennen jokaista annosta. Jos mitä tahansa oireita ilmenee tai ne pahenevat, älä pistä annosta, vaan ota välittömästi yhteyttä lääkäriin.
- Aikuisille suositeltu annos on 300 mg neljän viikon välein.
- Jokaiseen annokseen kuuluu kaksi pistosta, jotka annetaan ihon alle reiteen, vatsan alueelle (vähintään 6 senttimetrin etäisyydelle navasta) tai olkavarren takaosaan (vain, jos pistoksen antaa terveydenhuollon ammattilainen tai hoitaja). Tämä kestää enintään 30 minuuttia.
- Tietoa lääkkeen valmistelusta ja pistämisestä löytyy selosteen lopusta.
Jos lopetat Tysabri-valmisteen käytön
Tämän lääkehoidon säännöllisyys on tärkeää erityisesti ensimmäisten hoitokuukausien aikana. On tärkeää, että jatkat lääkkeen käyttöä niin kauan kuin sinä ja lääkäri katsotte, että hoidosta on sinulle hyötyä. Älä lopeta lääkkeen käyttöä, ellei lääkäri ole niin kehottanut. Allergisten reaktioiden todennäköisyys oli suurempi potilailla, jotka saivat yhden tai kaksi annosta Tysabri-valmistetta ja joiden hoito tämän jälkeen keskeytyi vähintään 3 kuukaudeksi ennen sen aloittamista uudelleen.
Allergiset reaktiot
Tämä lääke on aiheuttanut joillekin potilaille allergisen reaktion. Lääkäri saattaa seurata sinua allergisten reaktioiden varalta pistosten aikana ja tunnin ajan niiden jälkeen. Jos pistät lääkkeen itse tai hoitajasi antaa pistokset sinulle, keskeytä pistoksen pistäminen allergisen reaktion ilmetessä ja hakeudu välittömästi lääkärinhoitoon. Ks. myös kohta Mahdolliset haittavaikutukset, Mahdolliset haittavaikutukset.
Jos sinulta jää Tysabri-annos väliin
Jos sinulta jää tavallinen Tysabri-annos väliin, sovi lääkärin kanssa sen antamisesta mahdollisimman pian. Tämän jälkeen Tysabri-hoitoa jatketaan normaalisti neljän viikon välein.
Täyden annoksen antamiseen tarvitaan kaksi ruiskua. On tärkeää, että molempien ruiskujen sisältö annetaan ja määrättyä antoaikataulua noudatetaan. Jos pistät lääkkeen itse tai hoitajasi antaa pistokset sinulle ja sinulta on jäänyt annos väliin tai olet pistänyt vain yhden ruiskun sisällön, ota mahdollisimman pian yhteyttä lääkäriin ohjeiden saamiseksi.
Tehoaako Tysabri aina?
Elimistön luontainen puolustusjärjestelmä saattaa ajan mittaan tehdä Tysabri-valmisteen tehottomaksi joillakin Tysabri-hoitoa saavilla potilailla, kun elimistö kehittää vasta-aineita lääkkeelle. Lääkäri voi määrittää verikokeiden avulla, tehoaako tämä lääke, ja tarvittaessa lopettaa hoidon.
Jos sinulla on kysymyksiä Tysabri-valmisteen käytöstä, käänny lääkärin puoleen. Käytä tätä lääkettä juuri siten kuin tässä pakkausselosteessa kuvataan tai kuten lääkäri on määrännyt. Tarkista ohjeet lääkäriltä, jos olet epävarma.
Ihon alle antamisesta käytetään ruiskun etiketissä lyhennettä ”s.c.”
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Kerro lääkärille tai sairaanhoitajalle välittömästi, jos havaitset jonkin seuraavista.
Aivoinfektion merkit
- persoonallisuuden tai käytöksen muutokset, kuten sekavuus, hourailu tai tajunnanmenetys
- kouristuskohtaukset
- päänsärky
- pahoinvointi/oksentelu
- niskajäykkyys
- äärimmäinen kirkkaan valon arkuus
- kuume
- ihottuma (missä tahansa keholla).
Näiden oireiden syynä voi olla aivojen infektio (aivotulehdus eli enkefaliitti tai progressiivinen multifokaalinen leukoenkefalopatia) tai aivoja peittävän kalvon tulehdus (aivokalvontulehdus eli meningiitti).
Muiden vakavien infektioiden merkit
- selittämätön kuume
- vaikea ripuli
- hengenahdistus
- pitkäkestoinen huimaus
- päänsärky
- painonlasku
- raukeus
- näön heikentyminen
- silmän tai silmien kipu tai punoitus.
Allergisen reaktion merkit
- kutiseva ihottuma (nokkosihottuma)
- kasvojen, huulten tai kielen turvotus
- hengitysvaikeudet
- rintakipu tai epämukava tunne rinnassa
- verenpaineen nousu tai lasku (lääkäri tai sairaanhoitaja huomaa tämän, jos verenpainettasi seurataan).
Näitä esiintyy todennäköisimmin pistoksen aikana tai pian sen jälkeen.
Mahdollisiin maksan toimintahäiriöihin viittaavat merkit
- ihon tai silmien valkuaisten keltaisuus
- virtsan epätavallinen tummuus
- poikkeavuudet maksan toimintakokeissa.
Kerro välittömästi lääkärille tai sairaanhoitajalle, jos saat jonkin edellä mainituista haittavaikutuksista tai jos epäilet, että sinulla on jokin infektio. Näytä potilaan seurantakortti ja tämä pakkausseloste kaikille sinua hoitaville lääkäreille tai sairaanhoitajille, muillekin kuin neurologille.
Muut haittavaikutukset
Hyvin yleiset (esiintyy yli 1 potilaalla 10:stä)
- virtsatieinfektio
- kurkkukipu ja nenän vuotaminen tai tukkoisuus
- päänsärky
- huimaus
- pahoinvointi
- nivelkipu
- väsymys.
Yleiset (esiintyy enintään 1 potilaalla 10:stä)
- anemia (vähentynyt veren punasolumäärä, josta voi aiheutua ihon kalpeutta, hengästyneisyyden tunnetta ja voimattomuutta)
- allergia (yliherkkyys)
- lihasvärinä
- kutiseva ihottuma (nokkosihottuma)
- oksentelu
- kuume
- hengitysvaikeudet (hengenahdistus)
- kasvojen tai kehon punoitus (punastelu)
- herpesinfektiot
- epämiellyttävä tunne pistoskohdan ympärillä. Sinulla voi esiintyä kipua, mustelmia, punoitusta, kutinaa tai turvotusta.
Melko harvinaiset (esiintyy enintään 1 potilaalla 100:sta)
- vaikea allergia (anafylaktinen reaktio)
- progressiivinen multifokaalinen leukoenkefalopatia (PML)
- tulehduksellinen häiriö lääkevalmisteen käytön lopettamisen jälkeen
- kasvojen turvotus
- valkosolujen määrän lisääntyminen (eosinofilia)
- verihiutaleiden määrän väheneminen
- mustelmaherkkyys.
Harvinaiset (esiintyy enintään 1 potilaalla 1 000:sta)
- herpesinfektio silmässä
- vaikea anemia (vähentynyt veren punasolumäärä, josta voi aiheutua ihon kalpeutta, hengästyneisyyden tunnetta ja voimattomuutta)
- vaikea ihonalainen turvotus
- veren korkea bilirubiinipitoisuus (hyperbilirubinemia), joka voi aiheuttaa silmänvalkuaisten tai ihon keltaisuutta, kuumetta ja väsymystä.
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)
- epätavalliset aivojen ja silmien infektiot
- maksavauriot.
Jos epäilet, että sinulla on jokin infektio, ota yhteys lääkäriisi mahdollisimman pian.
Nämä tiedot löytyvät myös potilaan seurantakortista, jonka olet saanut lääkäriltäsi.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä etiketissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Pidä ruiskut ulkopakkauksessa. Herkkä valolle.
Esitäytettyjä ruiskuja voidaan säilyttää huoneenlämmössä (enintään 30 °C) yhteensä enintään 24 tuntia, johon luetaan mukaan aika, jonka ruiskun annetaan lämmetä huoneenlämpöön ennen lääkkeen antoa. Ruiskut voidaan laittaa takaisin jääkaappiin ja käyttää ennen etiketissä ja kotelossa mainittua viimeistä käyttöpäivämäärää. Jääkaapista poistamisen päivämäärä ja kellonaika on merkittävä koteloon. Ruiskut on hävitettävä, jos ne ovat olleet poissa jääkaapista yli 24 tunnin ajan. Älä käytä esitäytettyjen ruiskujen lämmittämiseen mitään ulkoisia lämmönlähteitä, kuten kuumaa vettä.
Älä käytä tätä lääkettä, jos huomaat ruiskussa olevassa nesteessä hiukkasia ja/tai värimuutoksia.
Pakkauksen sisältö ja muuta tietoa
Mitä Tysabri sisältää
Vaikuttava aine on natalitsumabi.
Yksi 1 ml:n esitäytetty ruisku sisältää 150 mg natalitsumabia.
Muut aineet ovat:
yksiemäksinen natriumfosfaatti, monohydraatti
kaksiemäksinen natriumfosfaatti, heptahydraatti
natriumkloridi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Tysabri sisältää natriumia”)
polysorbaatti 80 (E 433)
injektionesteisiin käytettävä vesi
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Tysabri on väritön tai hieman kellertävä, hieman läpikuultava tai läpikuultava liuos.
Yksi pahvipakkaus sisältää kaksi ruiskua.
Tysabri on saatavana kahden tai kuuden esitäytetyn ruiskun pakkauksina.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija ja valmistaja
Biogen Netherlands B.V.
Prins Mauritslaan 13
1171 LP Badhoevedorp
Alankomaat
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Biogen Finland Oy
Puh/Tel: +358 207 401 200
Tämä pakkausseloste on tarkistettu viimeksi 01/2026.
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu.
Ohjeet käyttäjälle
Tysabri 150 mg
injektioneste, liuos
natalitsumabi
injektio ihon alle
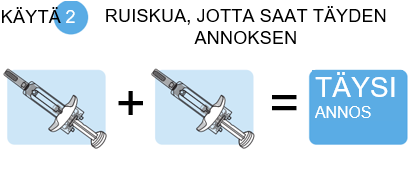
Täysi annos = kaksi esitäytettyä ruiskua
Näissä käyttöohjeissa kerrotaan, miten injektio Tysabri- esitäytetyllä ruiskulla annetaan.
Lue nämä käyttöohjeet ennen kuin aloitat Tysabri- esitäytettyjen ruiskujen (kutsutaan näissä ohjeissa ruiskuiksi) käytön ja aina, kun saat uuden lääkepakkauksen, sillä niissä voi olla uutta tietoa.
Nämä tiedot eivät korvaa terveydenhuollon ammattilaisen kanssa käytävää keskustelua sairaudestasi tai hoidostasi.
Tysabri-laitteen osat
Älä irrota sormitukea. Sormituki auttaa saamaan ruiskusta paremman otteen pistosta annettaessa.

Tärkeitä tietoja ennen Tysabri-valmisteen pistämistä
Tysabri toimitetaan esitäytetyssä ruiskussa (kutsutaan näissä ohjeissa ruiskuksi). Kussakin Tysabri-pakkauksessa on kaksi ruiskua. Täyteen annokseen tarvitaan molemmat ruiskut, ja pistokset on annettava 30 minuutin kuluessa toisistaan.
- Jos pistät lääkkeen itse tai hoitaja antaa pistokset sinulle, terveydenhuollon ammattilaisen on näytettävä sinulle tai hoitajallesi ennen kuin käytät(te) ruiskuja ensimmäisen kerran, miten ruiskut valmistellaan ja pistokset annetaan. Jos pistät lääkkeen itse tai hoitajasi antaa pistokset sinulle ja sinulta on jäänyt annos väliin tai olet pistänyt vain yhden ruiskun sisällön, ota yhteys apteekkiin tai hoitavaan lääkäriin.
- Ruiskut on tarkoitettu ainoastaan ihonalaiseen injektioon (lääke pistetään suoraan ihonalaiseen rasvakudokseen).
- Kutakin ruiskua voidaan käyttää vain yhden kerran (ruiskut ovat kertakäyttöisiä). Niitä ei voi käyttää uudelleen.
- Älä anna kenenkään toisen käyttää ruiskujasi, vaikka heillä olisi sama sairaus kuin sinulla. Saatat tartuttaa muihin infektion tai saada itse tartunnan muilta.
Huomautus terveydenhuollon ammattilaisille:
Potilaita on tarkkailtava injektioon liittyvien reaktioiden, kuten yliherkkyyden, merkkien ja oireiden varalta ihonalaisten injektioiden aikana ja 1 tunnin ajan niiden jälkeen. Ensimmäisten kuuden Tysabri-annoksen jälkeen, riippumatta näiden kuuden ensimmäisen annoksen antoreitistä, potilaita on tarkkailtava ihonalaisten injektioiden jälkeen lääkärin harkinnan mukaan.
Tysabri-valmisteen säilyttäminen
- Pidä ruisku ja kaikki lääkkeet poissa lasten ulottuvilta ja näkyviltä.
- Säilytä ruiskut jääkaapissa (2 °C – 8 °C).
- Ruiskuja voidaan tarvittaessa säilyttää huoneenlämmössä (enintään 30 °C) yhteensä enintään 24 tuntia. Jos ruiskut ovat olleet poissa jääkaapista yli 24 tunnin ajan, älä käytä niitä.
- Pidä ruiskut alkuperäispakkauksessa suojassa auringonvalolta.
- Ruiskut eivät saa jäätyä eivätkä altistua yli 30 °C:n lämpötiloille.
- Ruiskut voidaan palauttaa jääkaappiin ja käyttää ennen etikettiin ja ulkopakkaukseen merkittyä viimeistä käyttöpäivämäärää (EXP).
Tysabri-pistokseen valmistautuminen:
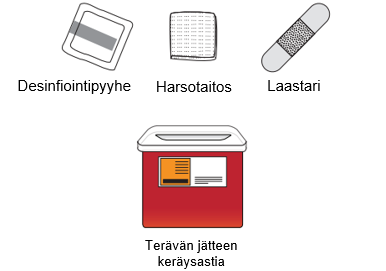
1. Ota tarvikkeet esille.
|  |
2. Ota jääkaapista 2 ruiskua ja odota 30 minuuttia.
| 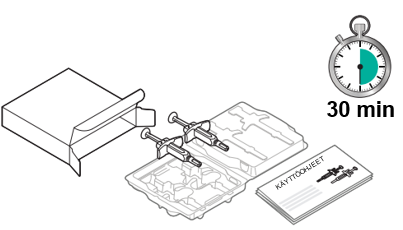 |
| Ruiskujen lämmittämiseen ei saa käyttää ulkoisia lämmönlähteitä, kuten kuumaa vettä. | |
3. Pese ja kuivaa kädet.
| 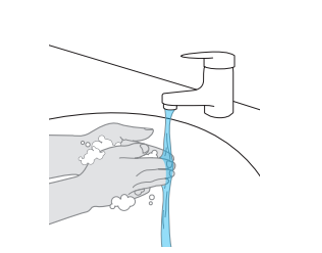 |
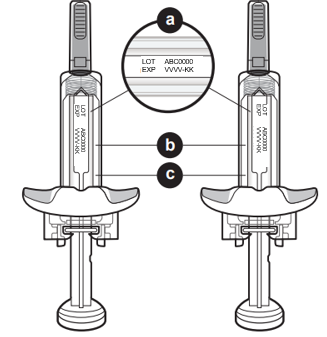
4. Tarkista ruiskut. a. Tarkista molempien ruiskujen viimeinen käyttöpäivämäärä (kuvassa kohta a). |
|
| Älä käytä ruiskua, jos viimeinen käyttöpäivämäärä on ohitettu. | |
| b. Tarkista ruiskut vaurioiden tai halkeamien varalta (kuvassa kohta b). | |
| Ruiskua ei saa käyttää, jos siinä on vaurioita tai halkeamia. | |
| c. Tarkista, että kummankin ruiskun sisältämä lääke on väritöntä tai hieman kellertävää, kirkasta tai hieman läpikuultavaa (helmiäishohtoista) liuosta, jossa ei ole näkyviä hiukkasia (kuvassa kohta c). | |
Älä käytä ruiskua, jos liuoksessa on näkyviä hiukkasia. Älä käytä ruiskua, jos se on pudonnut ennen käyttöä. Jos ruiskuissa on mitä tahansa edellä mainittuja ongelmia, ilmoita siitä terveydenhuollon ammattilaiselle. | |
Lääkkeessä saattaa näkyä kuplia. Se on normaalia. Huom.: Lääkkeen ulkonäkö saattaa muuttua, kun se on otettu jääkaapista. Se on normaalia. | |
5. Valitse ensimmäinen pistoskohta. a. Käytä jotakin seuraavista pistoskohdista:
b. Pistosta ei saa antaa alueelle, jonka iho aristaa, punoittaa, on tulehtunut, mustelmilla tai arpeutunut. c. Vaihda (kierrätä) pistoskohtia jokaisen pistoksen välillä. | 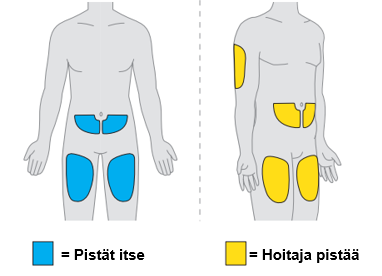 |
6. Puhdista ensimmäinen pistoskohta. a. Puhdista iho desinfiointipyyhkeellä. b. Anna pistoskohdan kuivua itsestään ennen annoksen pistämistä. | 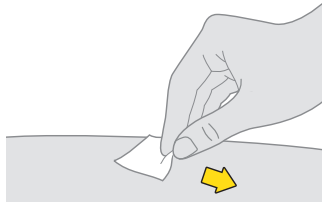 |
| Älä kosketa, leyhyttele tai puhalla puhdistettua aluetta. |
Ensimmäisen ruiskun sisällön pistäminen
7. Poista suojakorkki. a. Pitele ruiskua toisella kädellä rungosta neula ylöspäin. b. Tartu suojakorkkiin tukevasti toisella kädellä ja vedä korkki suoraan pois neulan päältä. c. Hävitä irrotettu suojakorkki välittömästi. Huom.: Neulan kärjessä voi näkyä pisara nestettä. Se on normaalia. | 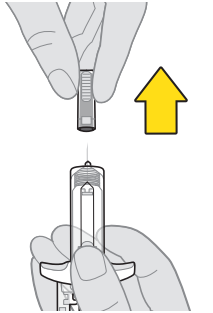 |
| |
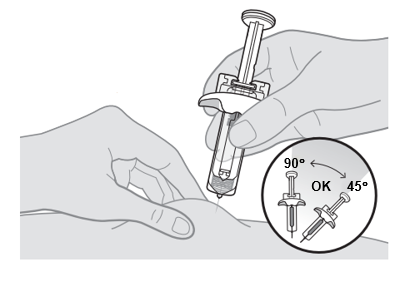
8. Työnnä neula ensimmäiseen pistoskohtaan. a. Nipistä puhdistetun pistoskohdan ympärysiho poimulle. b. Pitele ruiskua toisessa kädessä kuin kynää ja työnnä neulaa nopealla liikkeellä (kuin heittäisit tikkaa) ihopoimuun 45–90 asteen kulmassa, kunnes neula on kokonaan ihon alla. |
|
9. Anna ensimmäinen pistos. a. Kun neula on ihossa, vapauta ihopoimu. b. Anna kaikki lääke painamalla mäntä hitaasti pohjaan. | 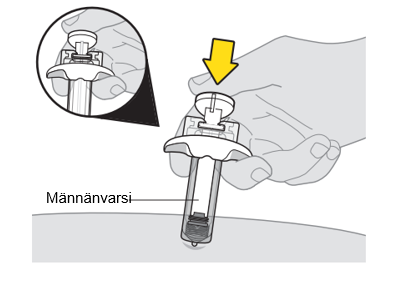 |
| Varmista, että painat männänvartta niin pitkälle kuin se menee, jotta kaikki lääke tulee annetuksi ja neulansuojus laukeaa. | |
10. Poista neula pistoskohdasta.
| 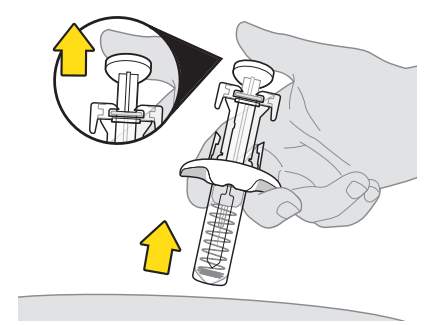 |
| Jos neulansuojus ei siirry neulan päälle, älä laita korkkia takaisin ruiskuun. Laita ruisku terävän jätteen keräysastiaan ja kysy neuvoa terveydenhuollon ammattilaiselta. | |
11. Tarkista ja hoida pistoskohta.
|  |
Toisen ruiskun sisällön pistäminen
12. Valitse toinen pistoskohta. a. Valitse toinen pistoskohta. Voit käyttää jotakin seuraavista pistoskohdista:
b. Pistosta ei saa antaa alueelle, jonka iho aristaa, punoittaa, on tulehtunut, mustelmilla tai arpeutunut. c. Vaihda (kierrätä) pistoskohtia jokaisen pistoksen välillä. d. Jos käytät samaa kehon aluetta, varmista, että toinen pistoskohta on vähintään 3 senttimetrin etäisyydellä ensimmäisestä. | 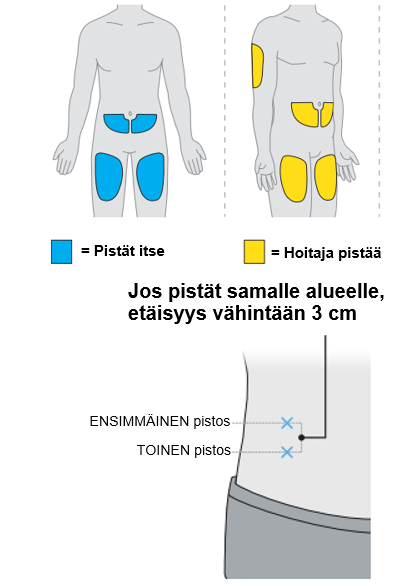 |
13. Puhdista toinen pistoskohta. a. Puhdista iho desinfiointipyyhkeellä. b. Anna pistoskohdan kuivua itsestään ennen annoksen pistämistä. | 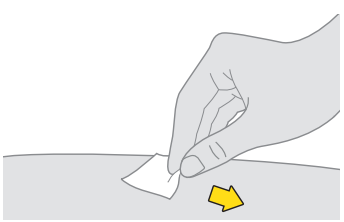 |
| Älä kosketa, leyhyttele tai puhalla puhdistettua aluetta. | |
14. Anna toinen pistos. a. Toista vaiheet 7–11 TOISEN ruiskun sisällön pistämiseksi, jotta saat täyden annoksen. Anna pistokset peräjälkeen ilman suurta viivettä. Toinen pistos on annettava viimeistään 30 minuutin kuluttua ensimmäisestä pistoksesta. |
|
Tysabri-valmisteen hävittäminen
15. Hävitä molemmat ruiskut.
| 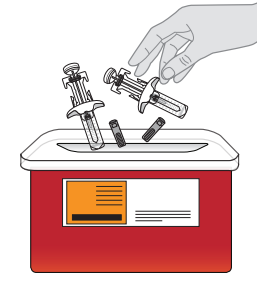 |
| Terävän jätteen keräysastiaa tai käytettyjä ruiskuja ei saa hävittää talousjätteen mukana. | |
Jos sinulla ei ole terävän jätteen keräysastiaa, voit pyytää sellaista terveydenhuollon ammattilaiselta tai käyttää jotakin kotoa löytyvää astiaa
Kun terävän jätteen keräysastia on lähes täynnä, se on hävitettävä paikallisten ohjeiden mukaisesti. Käytettyjen ruiskujen hävittämisestä voi olla paikallisia tai alueellisia määräyksiä. Terävän jätteen keräysastiaa ei saa hävittää talousjätteen mukana, elleivät paikalliset suositukset salli sitä. Terävän jätteen keräysastiaa ei saa kierrättää. | |