Pakkausseloste
SOFTACORT ögondroppar, lösning i endosbehållare 3,35 mg/ml
Tilläggsinformation
Softacort 3,35 mg/ml ögondroppar, lösning i endosbehållare
hydrokortisonnatriumfosfat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Softacort är och vad det används för
- Vad du behöver veta innan du använder Softacort
- Hur du använder Softacort
- Eventuella biverkningar
- Hur Softacort ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Detta läkemedel är en ögondroppslösning, i endosbehållare, som innehåller ett ämne som kallas hydrokortison. Detta ämne är en kortikosteroid som hämmar inflammatoriska symtom.
Det används för att behandla lindriga allergiska eller inflammatoriska tillstånd i den ytliga delen av ögat (bindhinnan).
Ögat får inte vara infekterat (se Använd inte Softacort).
Hydrokortison som finns i Softacort kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apotekspersonal eller annan hälsovårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Använd inte Softacort:
- Om du är allergisk mot hydrokortison eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- Om du har högt tryck i ögat (okulär hypertension), som man vet beror på glukosteroider (en typ av kortikosteroider) eller andra orsaker.
- Vid akut infektion i ögat orsakad av herpesvirus eller annan virussjukdom med sårbildning i ögat (om inte infektionen samtidigt behandlas)
- Om du har bindhinneinflammation (konjunktivit) med sårbildning på hornhinnan (keratit) även om infektionen är i ett tidigt skede
- Om du har en bakteriell ögoninfektion (akut varig infektion, konjunktivit, ögonlocksinflammation och vagel)
- Om du har en svampinfektion i ögat (okulär mykos)
- Om du har en bakteriell infektion kallad tuberkulos som påverkar ögat (okulär tuberkulos).
Varningar och försiktighet
- Tala med läkare, apotekspersonal eller sjuksköterska innan du använder detta läkemedel.
- Om du har ett rött öga som inte har fått diagnos, använd inte detta läkemedel.
- Om du har en viral ögoninfektion (herpes), använd endast detta läkemedel om infektionen behandlas med en antiviral behandling. Noggrann övervakning av ögonen krävs.
- Om du har en sjukdom som orsakar förtunning av den yttre delen av ögat (hornhinnan och senhinnan), kan det finnas en högre risk för hålbildning i ögats hinnor på grund av användningen av lokala kortikosteroider i ögat.
- Om du har använt kortikosteroidläkemedel under lång tid och har en ögonskada (sår på hornhinnan), kan en svampinfektion misstänkas.
- Under behandlingen behöver ögonen kontrolleras ofta och regelbundet. Speciellt hos patienter som redan lider av högt ögontryck eller är i riskzonen för att utveckla ett sådant tillstånd har långvarig användning av kortikosteroider visat sig orsaka en ökning av ögontrycket och förekomsten av glaukom (se Eventuella biverkningar). Långvarig användning av kortikosteroider har även visat sig orsaka en grumling av linsen i ögat (katarakt) speciellt hos barn och äldre
- Användning av kortikosteroider kan orsaka ögoninflammationer hos individer med nedsatt immunförsvar. Kortikosteroider som används i ögat kan även förvärra eller maskera tecken och symtom på för denna typ av ögoninflammation
- Du ska inte använda kontaktlinser under behandlingen med detta läkemedel.
- Kontakta läkare om du upplever dimsyn eller andra synrubbningar.
Barn
Det saknas data avseende säkerhet och effekt hos barn.
Kontinuerlig långtidsbehandling med kortikosteroider hos barn kan ge binjurebarksuppression.
Ökningen av ögontrycket hos barn tillstöter oftare, mer allvarligt och snabbare än hos vuxna.
Andra läkemedel och Softacort
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel, även receptfria sådana.
Vissa läkemedel kan öka effekten av Softacort och din läkare kan vilja övervaka dig noggrant om du tar dessa läkemedel (inklusive vissa läkemedel mot HIV: ritonavir, cobicistat).
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
- Användning av detta läkemedel under graviditet rekommenderas inte, utom när det bedöms nödvändigt av läkaren och sker under strikt övervakning.
- Det är inte känt om detta läkemedel utsöndras i bröstmjölk. Din läkare avgör om du kan använda detta läkemedel under amning eller inte.
Körförmåga och användning av maskiner
Övergående dimsyn eller andra synstörningar kan påverka förmågan att köra bil eller använda maskiner. Kör inte bil eller använd maskiner förrän du återfått normal syn.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Softacort innehåller fosfat
Detta läkemedel innehåller 0,227 mg fosfat per droppe.
Hur produkten används
Dosering
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Rekommenderad dos är 2 droppar i det påverkade ögat (ögonen), 2-4 gånger per dag beroende på ordinationen. Gradvis dosminskning rekommenderas för att undvika återfall. Behandlingstiden varierar vanligen från några dagar till högst 14 dagar.
Samma dos används för både vuxna och äldre.
Användning för barn
Effekt och säkerhet hos barn har inte fastställts.
Hur man använder dropparna
Detta läkemedel är avsett att användas i ögat.
Följ dessa instruktioner för att använda dropparna:
1. Tvätta händerna och sitt eller stå bekvämt.
2. Öppna påsen som innehåller 10 endosbehållare. Skriv datumet för första öppnandet på påsen.
3. Bryt av en endosbehållare från remsan.
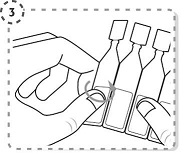
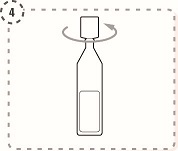
4. Vrid av toppen på endosbehållaren, enligt bilden. Rör inte spetsen efter att endosbehållaren öppnats.
5. Använd fingret för att försiktigt dra ner det undre ögonlocket på det påverkade ögat.
6. Placera spetsen på endosbehållaren nära ögat, utan att vidröra det.
7. Kläm försiktigt på endosbehållaren så att två droppar kommer in i ögat och släpp sedan det undre ögonlocket.
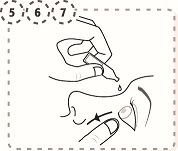
8. Tryck ett finger mot ögonvrån, vid näsan, på det drabbade ögat. Håll kvar i 1 minut medan du blundar.
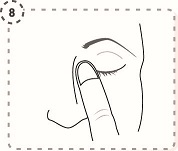
9. Upprepa i andra ögat om din läkare har sagt till dig att göra detta. Varje endosbehållare innehåller tillräckligt med lösning för båda ögonen.
10. Kasta endosbehållaren efter användning. Spara den inte för att använda igen.
11. Lägg tillbaka de oöppnade endosbehållarna i påsen. Placera den öppnade påsen i kartongen. De oöppnade endosbehållarna måste användas inom en månad efter öppnandet av påsen.
Om du använder något annat läkemedel som ska appliceras i ögat, bör du vänta 5 minuter mellan varje applicering.
Om du har använt för stor mängd av Softacort
Skölj ögat med sterilt vatten om du har droppat för mycket av läkemedlet i ögat och du upplever irritation i ögat som inte går över.
Kontakta omedelbart läkare eller apotekspersonal.
Om du använt för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112 [i Sverige] och 0800 147 111 [i Finland]) för bedömning av risken samt rådgivning.
Om du har glömt att använda Softacort
Ta inte dubbel dos för att kompensera för glömd dos.
Om du slutar att använda Softacort
Avsluta inte behandlingen tvärt. Rådfråga alltid din läkare om du överväger att avsluta behandlingen.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Har rapporterats (förekommer hos ett okänt antal användare):
- övergående ögonbesvär (brännande, stickande känsla) efter applicering.
Följande biverkningar har rapporterats för läkemedel i samma grupp (kortikosteroider) när de använts för behandling av ögonsjukdomar.
Har rapporterats (förekommer hos ett okänt antal användare):
- allergiska reaktioner
- fördröjd sårläkning
- grumling av linsen i ögat (bakre kapselkatarakt)
- infektioner hos patienter med ett nedsatt immunförsvar (orsakade av herpesvirus, svampinfektion)
- ökning av trycket i ögat (glaukom)
- utvidgning av pupillen (mydriasis)
- hängande ögonlock (ptos)
- inflammation inuti ögat (uveit)
- förändringar i tjockleken av den främre delen av ögat (hornhinnan)
- inflammation i hornhinnan (kristallin keratopati).
- dimsyn
Om du har allvarligt skadad hornhinna, kan fosfat i mycket sällsynta fall orsaka grumliga fläckar på hornhinnan p.g.a. ansamling av kalcium under behandlingen.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Sverige:
Läkemedelsverket
Box 26
751 03 Uppsala
Finland:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen, påsen och endosbehållaren efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25 °C.
Efter första öppnandet av påsen: använd endosbehållarna inom en månad.
Förvara endosbehållarna i påsen. Ljuskänsligt.
Skriv datumet för första öppnandet på påsen.
Efter första öppnandet av endosbehållaren: använd omedelbart och kassera endosbehållaren efter användning.
Eftersom sterilitet inte kan bibehållas efter det att endosbehållaren öppnats, ska eventuellt återstående innehåll kasseras omedelbart efter administrering.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är hydrokortisonnatriumfosfat.
1 ml ögondroppar, lösning innehåller 3,35 mg hydrokortisonnatriumfosfat. - Övriga innehållsämnen är dinatriumfosfatdodekahydrat, natriumdivätefosfatmonohydrat, natriumklorid, dinatriumedetat, saltsyra (för pH-justering), vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Detta läkemedel är en ögondroppslösning i endosbehållare.
Lösningen är nästintill klar, färglös till svagt gul, praktiskt taget fri från partiklar, förpackad i en påse med 10 endosbehållare, varje endosbehållare innehåller 0,4 ml lösning.
Förpackningsstorlekar: 10 (1 x 10), 20 (2 x 10), 30 (3 x 10) eller 60 (6 x 10) endosbehållare.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Laboratoires THEA
12, rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
Frankrike
Tillverkare
Laboratoires UNITHER
1 rue de l’Arquerie
50200 Coutances
Frankrike
eller
Laboratoires THEA
12, rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
Frankrike
Lokal företrädare:
Théa Nordic AB, Frösundaviks Allé 1, 169 70 Solna, Sverige
info.nordic@theapharma.com
Denna bipacksedel ändrades senast i Finland 07.03.2025
Ytterligare information om detta läkemedel finns på Läkemedelsverkets webbplats www.lakemedelsverket.se, Fimeas webbplats www.fimea.fi.