Pakkausseloste
VEDROP oral lösning 50 mg/ml
Tilläggsinformation
Vedrop 50 mg/ml oral lösning
Tokofersolan
Utökad övervakning
![]() Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om hur du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Detta läkemedel är föremål för utökad övervakning. Detta kommer att göra det möjligt att snabbt identifiera ny säkerhetsinformation. Du kan hjälpa till genom att rapportera de biverkningar du eventuellt får. Information om hur du rapporterar biverkningar finns i slutet av avsnitt Eventuella biverkningar.
Allmänna direktiv
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Vedrop är och vad det används för
- Vad du behöver veta innan du tar Vedrop
- Hur du tar Vedrop
- Eventuella biverkningar
- Hur Vedrop ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vedrop innehåller E-vitamin (i form av tokofersolan). Det används för att behandla E-vitaminbrist på grund av bristfälligt upptag vid matsmältning (där näringen i magen inte lätt absorberas när maten smälts) hos patienter från födseln (fullgångna nyfödda) till 18 års ålder med kronisk kolestas (en ärftlig eller medfödd sjukdom där galla inte kan transporteras från levern till tarmen).
Vad du behöver veta innan produkten används
Ta inte Vedrop
- om du är allergisk mot E-vitamin (d-alfa-tokoferol) eller mot något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- Vedrop får inte användas hos nyfödda för tidigt födda spädbarn.
Varningar och försiktighet
Tala med läkare innan du tar Vedrop om du har:
- problem med njurarna eller lider av uttorkning. Vedrop bör endast användas med varsamhet och din njurfunktion bör övervakas noga eftersom polyetylenglykol, en del av den aktiva substansen tokofersolan, kan skada dina njurar.
- problem med levern. Vedrop bör endast användas med varsamhet och leverfunktionen bör övervakas noga.
Andra läkemedel och Vedrop
Tala om för läkare eller apotekspersonal om du tar eller nyligen har tagit andra läkemedel, även receptfria sådana.
Tala om för läkare och apotekspersonal om du tar:
- vissa läkemedel för förtunning av blodet (orala antikoagulantia som t.ex. warfarin). En läkare kommer då att ta regelbundna blodprov och kan eventuellt justera dosen för att undvika en högre risk för blödning.
- fettlösliga vitaminer (t.ex. A, D, E eller K) eller avsevärt fettlösliga läkemedel (t.ex. kortikoider, cyklosporin, takrolimus eller antihistamin). Eftersom Vedrop kan öka upptaget under matsmältningen, kommer läkaren att övervaka behandlingseffekten och justera doserna vid behov.
Graviditet och amning
Inga kliniska uppgifter finns tillgängliga om exponering för detta läkemedel under graviditet. Informera läkare om du är gravid så att han/hon kan besluta om läkemedlet kan användas.
Det finns inga uppgifter om detta läkemedel utsöndras i bröstmjölk. Informera läkare om du vill amma. Han/hon kommer att hjälpa dig bestämma vad som är bäst för dig och ditt barn.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Det är osannolikt att Vedrop påverkar din förmåga att köra och använda maskiner.
Vedrop innehåller natriummetylparahydroxibensoat (E219) och natriumetylparahydroxibensoat (E215) som kan ge allergisk reaktion (eventuellt fördröjdt).
Vedrop innehåller 0,18 mmol (4,1 mg) natrium per ml. Tala med läkare om du står på diet med kontrollerat natriumintag.
Hur produkten används
Ta alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker. Den vanliga dosen 0,34 ml/kg/dag.
Läkaren kommer att skriva ut dosen i ml.
Dosen kommer att justeras av läkare i enlighet med E-vitaminnivån i ditt blod.
Administreringssätt
Svälj lösningen med eller utan vatten. Det bör endast användas med sprutan för oral användning som medföljer i förpackningen.
Du kan ta Vedrop för eller efter en måltid, med eller utan vatten. Mätning av dosen:
1- Öppna flaskan. 2- Placera sprutan, som medföljer i förpackningen, i flaskan. | 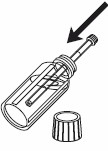 |
| 3- Fyll sprutan med vätskan genom att dra kolven upp till graderingen som motsvarar den mängd i milliliter (ml) som förskrivits av läkare. | 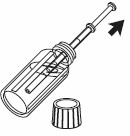 |
4- Ta ut sprutan ur flaskan. 5- Töm innehållet i sprutan genom att trycka ned kolven antingen:
| 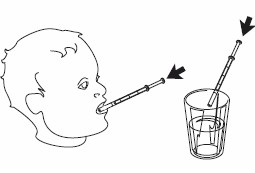 |
6- Stäng flaskan. 7- Tvätta sprutan med vatten. | 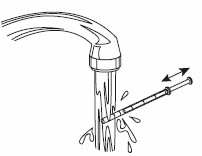 |
Om du har tagit för stor mängd av Vedrop
Om du tar stora doser av E-vitamin kan du uppleva övergående diarré och ont i magen. Tala med läkare eller apotekspersonal om symptomen kvarstår i mer än två dagar.
Om du har glömt att ta Vedrop
Hoppa över den missade dosen och återgå till den normala doseringen. Ta inte dubbel dos för att kompensera för glömd dos.
Om du slutar att ta Vedrop
Avsluta inte behandlingen utan att rådfråga läkare efter som E-vitaminbrist kan komma tillbaka och påverka din hälsa. Kontakta läkare eller apotekspersonal innan du slutar.
Om du har ytterligare frågor om detta läkemedel kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Följande biverkningar har rapporterats:
Vanliga biverkningar (kan påverka upp till 1 av 10 personer)
- Diarré
Mindre vanliga biverkningar (kan påverka upp till 1 av 100 personer)
- Asteni (svaghetskänsla)
- Huvudvärk
- Håravfall
- Klåda
- Utslag (hudreaktioner)
- Onormal natriumnivå i blodet
- Onormal kaliumnivå i blodet
- Ökning av transaminaser (leverenzymer)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
- Ont i magen
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
- Används före utgångsdatum som anges på kartongen och flaskan efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
- Detta läkemedel behöver inga särskilda förvaringsanvisningar.
- Kassera flaskan en månad efter det första öppnandet, även om det finns lösning kvar i flaskan.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar mediciner som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är tokofersolan. Varje ml lösning innehåller 50 mg d-alfa-tokoferol i form av tokofersolan som motsvarar 74,5 IE tokoferol.
- Övriga innehållsämnen är: kaliumsorbat, natriummetylparahydroxibensoat (E219) och natriumetylparahydroxibensoat (E215) (se slutet av avsnitt Vad du behöver veta innan produkten används för ytterligare information om dessa 2 innehållsämnen), glycerol, dinatriumfosfatdodekahydrat, koncentrerad saltsyra och renat vatten.
Läkemedlets utseende och förpackningsstorlekar
Vedrop är en svagt viskös och ljusgul oral lösning i en brun glasflaska som stängs med ett barnsäkert skruvlock. Flaskorna innehåller 10 ml, 20 ml eller 60 ml oral lösning. Varje kartong innehåller en flaska och en spruta för oral användning (en spruta på 1 ml med en flaska på 10 ml eller 20 ml, och en spruta på 2 ml med en flaska på 60 ml).
Innehavare av godkännande för försäljning
Recordati Rare Diseases
Tour Hekla
52 avenue du Général de Gaulle
F-92800 Puteaux
Frankrike
Tillverkare
Recordati Rare Diseases
Tour Hekla
52 avenue du Général de Gaulle
F-92800 Puteaux
Frankrike
eller
Recordati Rare Diseases
Eco River Parc
30, rue des Peupliers
F-92000 Nanterre
Frankrike
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Belgique/België/Belgien Recordati Tél/Tel: +32 2 46101 36 | Lietuva Recordati AB. Tel: + 46 8 545 80 230 Švedija |
България Recordati Rare Diseases Teл.: +33 (0)1 47 73 64 58 Франция | Luxembourg/Luxemburg Recordati Tél/Tel: +32 2 46101 36 Belgique/Belgien |
Česká republika Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 Francie | Magyarország Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 Franciaország |
Danmark Recordati AB. Tlf : +46 8 545 80 230 Sverige | Malta Recordati Rare Diseases Tel: +33 1 47 73 64 58 Franza |
Deutschland Recordati Rare Diseases Germany GmbH Tel: +49 731 140 554 0 | Nederland Recordati Tel: +32 2 46101 36 België |
Eesti Recordati AB. Tel: + 46 8 545 80 230 Rootsi | Norge Recordati AB. Tlf : +46 8 545 80 230 Sverige |
Ελλάδα Recordati Rare Diseases Τηλ: +33 1 47 73 64 58 Γαλλία | Österreich Recordati Rare Diseases Germany GmbH Tel: +49 731 140 554 0 Deutschland |
España Recordati Rare Diseases Spain S.L.U. Tel: + 34 91 659 28 90 | Polska Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 Francja |
France Recordati Rare Diseases Tél: +33 (0)1 47 73 64 58 | Portugal Recordati Rare Diseases SARL Tel: +351 21 432 95 00 |
Hrvatska Recordati Rare Diseases Tél: +33 (0)1 47 73 64 58 Francuska | România Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 Franţa |
Ireland Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 France | Slovenija Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 Francija |
Ísland Recordati AB. Simi:+46 8 545 80 230 Svíþjóð | Slovenská republika Recordati Rare Diseases Tel: +33 (0)1 47 73 64 58 Francúzsko |
Italia Recordati Rare Diseases Italy Srl Tel: +39 02 487 87 173 | Suomi/Finland Recordati AB. Puh/Tel : +46 8 545 80 230 Sverige |
Κύπρος Recordati Rare Diseases Τηλ : +33 1 47 73 64 58 Γαλλία | Sverige Recordati AB. Tel : +46 8 545 80 230 |
Latvija Recordati AB. Tel: + 46 8 545 80 230 Zviedrija |
Denna bipacksedel ändrades senast 11/2024
Detta läkemedel har godkänts i enlighet med reglerna om ”godkännande i undantagsfall”. Detta innebär att det inte varit möjligt att få fullständig information om detta läkemedel eftersom sjukdomen är sällsynt.
Europeiska läkemedelsmyndigheten går varje år igenom all ny information som kan ha kommit fram om detta läkemedel och uppdaterar denna bipacksedel när så behövs.
Ytterligare information om detta läkemedel finns tillgänglig på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.