Pakkausseloste
ENANTON DEPOT DUAL pulver och vätska till injektionsvätska, suspension i förfylld spruta 30 mg
Tilläggsinformation
Enanton Depot Dual 30 mg pulver och vätska till injektionsvätska, suspension i förfylld spruta
leuprorelinacetat
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Enanton Depot Dual 30 mg är och vad det används för
- Vad du behöver veta innan du använder Enanton Depot Dual 30 mg
- Hur du använder Enanton Depot Dual 30 mg
- Eventuella biverkningar
- Hur Enanton Depot Dual 30 mg ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Enanton Depot Dual 30 mg är ett läkemedelspreparat som ges som en injektion under huden. Läkemedlet innehåller leuprorelinacetat, som är ett syntetiskt hormon som minskar testosteron- och östrogenhalterna i kroppen. Läkemedlet används för att behandla avancerad prostatacancer.
Vad du behöver veta innan produkten används
Använd inte Enanton Depot Dual 30 mg om du:
- är allergisk mot leuprorelinacetat eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar) eller mot andra ämnen som liknar leuprorelin (syntetiskt GnRH eller GnRH-derivat).
Varningar och försiktighet
Tala med läkare innan du använder Enanton Depot Dual:
- om du lider av förträngningar i urinvägarna
- om du lider av ryggmärgskompression
- om du är diabetiker
- om du har en ökad risk för ämnesomsättnings- eller hjärt-kärlsjukdom
- om du har någon hjärt-kärlsjukdom inklusive hjärtrytmrubbningar (arytmi), eller om du tar medicin mot detta. Risken för att drabbas av hjärtrytmrubbningar kan vara förhöjd när man använder Enanton Depot Dual.
- om du har en ökad risk för osteoporosis och benfrakturer
- om du har epilepsi eller om du har haft epileptiska anfall
- om du har fettlever
- om du får svår eller återkommande huvudvärk, problem med synen och ringningar eller susningar i öronen, ska du omedelbart kontakta läkare.
Depression, som kan vara allvarlig, har rapporterats hos patienter som tar Enanton Depot Dual. Informera din läkare om du blir nedstämd/deprimerad under tiden du tar Enanton Depot Dual.
Allvarliga hudutslag inklusive Steven–Johnsons syndrom, toxisk epidermal nekrolys (SJS/TEN) har rapporterats i samband med leuprorelin. Sluta genast att använda leuprorelin och sök omedelbart vård om du upplever något av de symtom som förknippas med dessa allvarliga hudreaktioner och som beskrivs i avsnitt Eventuella biverkningar.
Andra läkemedel och Enanton Depot Dual 30 mg
Enanton Depot Dual kan påverka vissa andra läkemedel som används för att behandla hjärtrytmrubbningar (t.ex. kinidin, prokainamid, amiodaron och sotalol) eller kan öka risken för hjärtrytmrubbningar när det används tillsammans med andra läkemedel (t.ex. metadon (används mot smärta och vid behandling av drogberoende), moxifloxacin (ett antibiotikum), antipsykotika (används mot allvarlig psykisk sjukdom).
Tala om för läkare om du använder, nyligen har använt eller kan tänkas använda andra läkemedel. Detta gäller såväl receptmediciner som receptfria mediciner, naturprodukter och naturmedel. Berätta för läkaren också om du lider av andra sjukdomar eller allergier.
Tala om att du använder det här preparatet i samband med nästa läkarbesök.
Graviditet och amning
Preparatet är avsett endast för män, för behandling av prostatacancer.
Körförmåga och användning av maskiner
Enanton Depot Dual kan förorsaka trötthet, svindel och synstörningar och kan därför påverka din förmåga att köra bil eller använda verktyg eller maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Enanton Depot Dual innehåller polysorbat
Detta läkemedel innehåller polysorbat 1,0 mg/injektionsspruta. Polysorbater kan orsaka allergiska reaktioner. Tala om för din läkare om du har några kända allergier.
Andra innehållsämnen
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dosenhet, d.v.s. är näst intill “natriumfritt”.
Hur produkten används
Läkaren har ordinerat en lämplig dosering och behandlingslängd med tanke på din sjukdom. Använd alltid detta läkemedel enligt läkarens anvisningar. Om du finner att effekten av preparatet är för stark eller för svag, kontakta läkare eller apotekspersonal.
Enanton Depot Dual bör endast ges av din läkare eller en sjuksköterska som även färdigställer läkemedlet.
Dosering och behandlingstid
- En läkemedelsbehandling av prostatacancer är oftast långvarig.
- 30 mg läkemedel ges som engångsdos under huden med cirka 6 månaders mellanrum (168–180 dagar).
- Det är viktigt att tiden mellan doseringarna är rätt (6 månader), så att prostatacancerns symtom inte blir värre.
- Läkemedlet ges, som en injektion under huden. Injektion i en ven eller artär kan orsaka blodpropp.
En läkare eller sjuksköterska kommer att ge dig injektionen. Se avsnittet ”Beredning och administrering av injektionsvätskan” i slutet av denna bipacksedel.
Om du har tagit för stor mängd av Enanton Depot Dual 30 mg
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 0800 147 111) för bedömning av risken samt rådgivning.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem. Läkemedlets biverkningar beror huvudsakligen på förändringar i hormonverksamheten.
I början av behandlingen kan symtomen av prostatacancern tillfälligt förvärras, vilket kan leda till bensmärta, symtom från urinkanalen, svaghet i de nedre extremiteterna och sinnesvillor. Enanton Depot Dual 30 mg kan även ge upphov till förändringar i ämnesomsättningen (t.ex. glukosintolerans eller att existerande diabetes förvärras) eller en ökad risk för hjärt-kärlhändelser.
Blödning och vävnadsdöd i hypofysen (hypofysär apoplexi) har beskrivits som en mycket sällsynt biverkning, när läkemedel av denna typ har getts för första gången till patienter med en tumör i hypofysen. Symtom på apoplexi är plötslig huvudvärk, kräkning, synstörningar och ögonmuskelförlamning.
Har rapporterats (förekommer hos okänt antal användare):
Sök akut läkarvård om du drabbas av:
- rödaktiga, icke upphöjda, måltavleliknande eller runda fläckar på överkroppen, ofta med en liten blåsa i mitten, hudflagning, sår i mun, hals, näsa, könsorgan och ögon. Dessa allvarliga hudutslag kan föregås av feber och influensaliknande symtom. (Steven–Johnsons syndrom/toxisk epidermal nekrolys/exfoliativ dermatit).
- hudrodnad och kliande hudutslag (toxiskt hudutslag)
- hudutslag med blåsor
- en hudreaktion som orsakar röda prickar eller fläckar på huden som kan likna en måltavla och har ett mörkrött parti i mitten som omsluts av blekare röda ringar (erythema multiforme)
- snabbt uppträdande områden av röd hud som är full med små pustler (små blåsor med vit/gul vätska), så kallad akut generaliserad exantematös pustulos (AGEP).
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 användare):
Humörförändringar, depression, sömnlöshet, blodvallningar, förhöjd mängd av leverenzymet laktatdehydrogenas i blodet, leverfunktionsstörningar (gulsot), svettning, muskelsvaghet, minskad sexuell lust och förmåga, minskning av testiklar, reaktioner vid injektionsstället, värmekänsla.
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 användare):
Blodbrist, minskad mängd blodplättar, viktförändringar, nedsatt aptit, förhöjda blodvärden för triglycerider och totalkolesterol, socker, kalium och urinsyra, huvudvärk, yrsel, myrkrypningar (pirrande känsla i huden), dövhet, tinnitus, EKG‑förändringar, förstorat hjärta, blodvallning i ansiktet, illamående, kräkning, förhöjda bilirubin‑ och leverenzymvärden i blodet, hudinflammation, ökad hårväxt på huvudet, utslag, klåda, ledvärk, bensmärta, smärta i axlarna, nederdelen av ryggen, armarna eller benen, behov att kissa ofta, blod i urinen, förhöjda mängder urinämne i blodet, bröstförstoring, obehag i bäckenbotten, svårigheter att gå, svullnad på grund av vätskeansamling, tryckkänsla över bröstet, stelhet, sjukdomskänsla, trötthet, feber, reaktion vid injektionsstället (smärta, förhårdnad, rodnad).
Sällsynta biverkningar (kan förekomma hos upp till 1 av 1 000 användare):
Överkänslighet, utslag, klåda, nässelutslag, andningssvårigheter, feber, frossa, anafylaktisk reaktion, blodpropp, blodpropp i lungorna, diarré, muskelvärk, böld vid injektionsstället.
Mycket sällsynta biverkningar (kan förekomma hos upp till 1 av 10 000 användare):
Blödning och vävnadsdöd i hypofysen.
Har rapporterats (förekommer hos ett okänt antal användare):
Metabolt syndrom såsom högt blodtryck, dyslipidemi (skadligt tillstånd p.g.a. en ämnesomsättningsstörning där blodlipidernas relativa andelar eller halter avviker från målvärdena), insulinresistens (egenskap som leder till att insulinet minskar blodets glukoshalt mindre än förväntat) eller nedsatt insulintolerans, fettlever, epileptiska anfall, synstörningar, hjärtklappning, förändringar i EKG (QT‑förlängning), inflammation i lungor, lungsjukdom, osteoporos (inkl. ryggradsfraktur), minskad bentäthet, idiopatisk intrakraniell hypertension (ökat tryck inuti skallen, runt hjärnan som kännetecknas av huvudvärk, dubbelseende och andra problem med synen samt ringningar eller susningar i ena eller båda öronen).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvaras i skydd mot kyla. Får ej frysas.
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen. Utgångsdatumet är den sista dagen i angiven månad. Efter beredning ska suspensionen administreras omedelbart.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Pulvret till injektionsvätskan innehåller 30 mg leuprorelinacetat, som motsvarar 28,58 mg leuprorelinbas. Hjälpämnena i pulvret är poly(mjölksyra) och mannitol.
Den förfyllda sprutan innehåller 1 ml vätska, som innehåller mannitol, karmellosnatrium, polysorbat 80, koncentrerad ättiksyra (för reglering av pH) och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Den förfyllda sprutan är en tvåkammarspruta, försedd med injektionsnål och säkerhetsskydd, och den innehåller vitt pulver och klar, färglös vätska.
1 förfylld tvåkammarspruta, varav ena kammaren innehåller pulver för injektionsvätska och den andra 1 ml vätska för injektionsvätska (glas Ph. Eur. typ I, gummipropparna är av silikoniserat klorobutylgummi), och 1 nål (23G) försedd med säkerhetsskydd.
Innehavare av godkännande för försäljning
Orion Corporation
Orionvägen 1
FI-02200 Esbo
Finland
Tillverkare
Orion Corporation Orion Pharma
Orionvägen 1
FI-02200 Esbo
Finland
Orion Corporation Orion Pharma
Joensuunkatu 7
FI-24100 Salo
Finland
Denna bipacksedel ändrades senast 28.10.2024
Direktiv för experterna inom hälsovården
Beredning och administrering av injektionsvätskan
Pulvret och vätskan till injektionsvätskan ska blandas ihop före användningen. OBS! Dra aldrig tillbaka kolven under beredning, detta kan orsaka separation vid propparna vilken kan medföra läckage mellan propparna eller vid kolven.
Allmänna råd
- Se till att suspensionen har en jämn konsistens före dosering.
- Den färdiga suspensionen ska användas omedelbart.
- Läkemedlet får inte injiceras på samma plats två gånger i följd, utan injektionsstället bör varieras.
- Den färdiga suspensionen får inte förvaras, eftersom produkten inte innehåller något konserveringsmedel.
- Injektionsstället får inte masseras.
- Vid behov kan plåster läggas på injektionsstället.
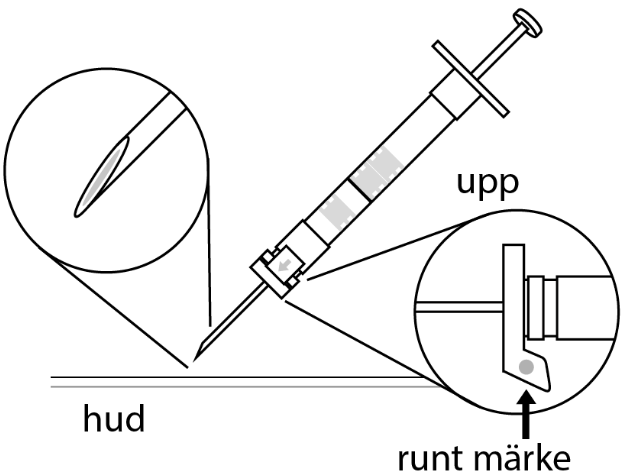
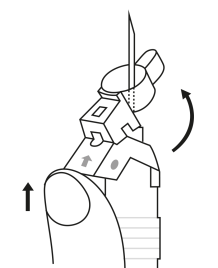
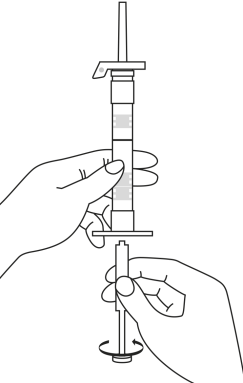 | 1. Håll sprutan upprätt (nålen uppåt). Skruva fast kolvens skaft på sprutans botten tills den bakre gummiproppen börjar snurra. | 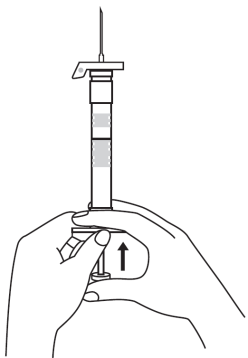 | 5. Håll sprutan med nålen uppåt så att du ser om det finns luftbubblor i sprutan. Om luftbubblor syns, tryck försiktigt på kolven tills all luft (men ingen vätska) har avlägsnats från sprutan. |
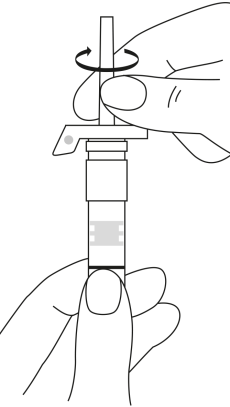 | 2. Håll sprutan upprätt (nålen uppåt). Kontrollera att nålen är ordentligt fastskruvad på sprutan genom att skruva nålskyddet medsols. Skruva inte åt det för hårt. Knacka försiktigt på sprutan med ett finger så att pulvret lossnar från kammarens vägg. |
6. Rengör hudområdet med antiseptiskt medel före injektionen. När injektionen ges ska pricken på säkerhetsskyddet peka uppåt. Kontrollera att nålen inte punkterar ett blodkärl och injicera hela innehållet i sprutan på en gång under huden som vid en normal injektion. | |
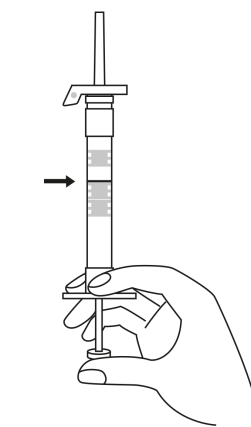 | 3. Håll sprutan upprätt (nålen uppåt). Tryck in kolven långsamt (6‑8 sekunder) tills den mellersta gummiproppens övre del når den blå linjen. | ||
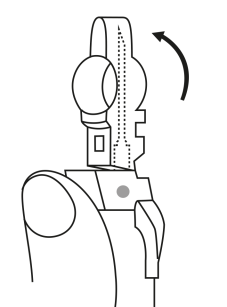
EFTER INJEKTION 7. En pil är tryckt på säkerhetsskyddets klaff. Tryck på säkerhetsskyddets klaff i pilens riktning genast efter injektionen. Då glider skyddet mot nålspetsen och låses som skydd för nålen. Kontrollera låsningen genom att lyssna eller känna (när skyddet låses hör du ett ”klick” eller känner en knäpp). | |||
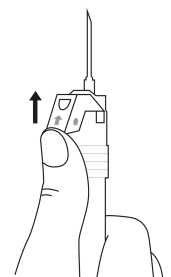
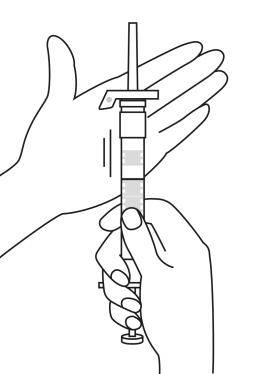 | 4. Håll sprutan upprätt (nålen uppåt). Skaka sprutan försiktigt tills suspensionen är jämn. Färdig injektion är en vit, mjölkaktig suspension. Dra försiktigt av nålskyddet. | ||