Pakkausseloste
TRIAXIS injektionsvätska, suspension i förfylld spruta
Tilläggsinformation
Triaxis injektionsvätska, suspension i förfylld spruta
Vaccin mot difteri, stelkramp och kikhosta, acellulärt, komponent, adsorberat, med reducerat antigeninnehåll
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du eller ditt barn vaccineras. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta vaccin har ordinerats enbart åt dig eller ditt barn. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du eller ditt barn får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad Triaxis är och vad det används för
- Vad du behöver veta innan Triaxis ges till dig eller ditt barn
- Hur och när Triaxis ges
- Eventuella biverkningar
- Hur Triaxis ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Triaxis (Tdap) är ett vaccin. Vacciner används för att skydda mot infektionssjukdomar. De verkar genom att de får kroppen att producera sitt eget skydd mot de bakterier som orsakar dessa sjukdomar.
Detta vaccin används för att förstärka skyddet mot difteri, stelkramp och kikhosta hos barn från 4 års ålder, ungdomar och vuxna, efter en fullständig grundimmunisering.
Användning av Triaxis under graviditet ger ett skydd som kan överföras till barnet i livmodern och skydda barnet mot kikhosta under de första levnadsmånaderna.
Begränsningar av skyddet
Triaxis förhindrar dessa sjukdomar endast om de orsakas av de bakterier som vaccinet är riktat mot. Du eller ditt barn kan ändå få liknande sjukdomar om de orsakas av andra bakterier eller virus.
Triaxis innehåller inte några levande bakterier eller virus och det kan inte orsaka någon av de infektionssjukdomar som det skyddar mot.
Kom ihåg att inget vaccin kan ge fullständigt, livslångt skydd hos alla människor som vaccineras.
Vad du behöver veta innan produkten används
För att vara säker på att Triaxis är lämpligt för dig eller ditt barn är det viktigt att du talar om för läkaren eller sköterskan om någon av nedanstående punkter gäller dig eller ditt barn. Om det är någonting du inte förstår, be läkaren eller sköterskan förklara det.
Använd inte Triaxis om du eller ditt barn
- har haft en allergisk reaktion:
- mot vaccin mot difteri, stelkramp eller kikhosta
- mot något av de övriga innehållsämnena (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- mot något restämne från tillverkningen (formaldehyd, glutaraldehyd), som det kan finnas spårmängder av.
- någon gång fått en allvarlig reaktion som påverkat hjärnan inom en vecka efter en tidigare dos av ett kikhostevaccin
- har en akut allvarlig febersjukdom. Vaccinationen ska skjutas upp tills du eller ditt barn har blivit friskt. En lättare sjukdom utan feber är vanligtvis inte någon anledning till att skjuta upp vaccinationen. Läkaren avgör om du eller ditt barn ska få Triaxis.
Varningar och försiktighet
Tala med läkare eller sjuksköterska före vaccinationen om du eller ditt barn har
- fått en boosterdos av ett vaccin mot difteri och stelkramp inom de senaste 4 veckorna. I detta fall ska du eller ditt barn inte få Triaxis och din läkare avgör mot bakgrund av officiella rekommendationer när du eller ditt barn kan få en ytterligare injektion.
- haft Guillain-Barrés syndrom (tillfällig förlust av rörelseförmåga och känsel i hela eller delar av kroppen) inom 6 veckor efter en tidigare dos av ett stelkrampsvaccin. Läkaren avgör om du eller ditt barn ska få Triaxis.
- en icke-kontrollerad sjukdom som påverkar nervsystemet eller okontrollerade epilepsianfall. Läkaren börjar först behandling och vaccinerar när tillståndet har stabiliserats.
- svagt eller nedsatt immunförsvar på grund av
- medicinering (t.ex. steroider, cellgifter eller strålbehandling).
- HIV-infektion eller AIDS.
- någon annan sjukdom.
Vaccinet skyddar eventuellt inte lika bra som det skyddar personer med friskt immunförsvar. Om möjligt ska vaccinationen skjutas upp tills sådan sjukdom eller behandling har upphört.
- något problem med blodet som gör att blåmärken lätt uppstår, eller det blöder länge efter en mindre skada (till exempel på grund av en blodsjukdom som till exempel hemofili eller trombocytopeni eller behandling med blodförtunnande mediciner).
Svimning kan förekomma efter, eller även före, all nålinjektion. Tala därför om för läkaren eller sjuksköterskan om du eller ditt barn har svimmat vid tidigare injektion.
Tala om för läkare, apotekspersonal eller sjuksköterska innan du använder Triaxis om du eller ditt barn har haft en allergisk reaktion mot latex. De förfyllda sprutorna (1,5 ml) med mjuka spetsskydd innehåller ett derivat av naturgummi (latex), som kan framkalla en allergisk reaktion.
Andra läkemedel och Triaxis
Tala om för läkare, sjuksköterska eller apotekspersonal om du eller ditt barn tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Eftersom Triaxis inte innehåller levande bakterier kan det i allmänhet ges samtidigt som andra vacciner eller immunglobuliner men vid ett annat injektionsställe. Studier har visat att Triaxis kan användas samtidigt som något av följande vacciner: ett hepatit B-vaccin, vaccin mot polio (som injiceras eller tas via munnen) och ett inaktiverat influensavaccin. Dessutom kan Triaxis administreras tillsammans med humant papillomvirusvaccin och/eller meningokockpolysackarid (serogrupper A, C, Y och W) konjugatvaccin (antingen alla tre vaccin eller parvis). Injektion av flera vaccin vid samma tillfälle ska göras i olika kroppsdelar.
Om du eller ditt barn får läkemedelsbehandling som påverkar ditt eller barnets blod eller immunförsvar (som till exempel blodförtunnande läkemedel, kortikosteroider eller cellgifter) ska du läsa avsnittet ”Varningar och försiktighet” ovan.
Graviditet, amning och fertilitet
Tala om för läkare eller sjuksköterska om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn. Läkaren hjälper dig avgöra om du borde få Triaxis under graviditeten.
Körförmåga och användning av maskiner
Det har inte studerats om vaccinet påverkar körförmågan eller förmågan att använda maskiner. Vaccinet har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med läkare eller apotekspersonal om du är osäker.
Hur produkten används
När du eller ditt barn ges vaccinet
Läkaren avgör om Triaxis är lämpligt för dig eller ditt barn beroende på:
- vilka vacciner du eller ditt barn har fått tidigare
- hur många doser av liknande vacciner du eller ditt barn har fått tidigare
- när du eller ditt barn fick den senaste dosen av liknande vaccin
Läkaren avgör hur länge du ska vänta mellan vaccinationerna.
Om du är gravid kommer läkaren att hjälpa dig avgöra om du borde få Triaxis under graviditeten.
Dosering och administreringssätt
Vem ger dig Triaxis?
Triaxis ska ges av vårdpersonal som fått utbildning i att ge vacciner och på en klinik eller mottagning som har utrustning för att ta hand om en eventuell sällsynt allvarlig allergisk reaktion mot vaccinet.
Dosering
Alla åldersgrupper för vilka Triaxis är avsett får en injektion (en halv milliliter).
Om du eller ditt barn drabbas av en skada som kräver förebyggande åtgärder mot stelkramp, kan läkaren besluta att ge Triaxis med eller utan immunoglobulin mot stelkramp.
Triaxis kan användas för förnyelsevaccination. Läkaren kommer att ge dig råd om förnyelsevaccination.
Administreringssätt
Läkaren eller sköterskan ger dig vaccinet i en muskel i överarmen (deltoidmuskeln).
Läkaren eller sköterskan ger dig inte vaccinet i ett blodkärl, i skinkorna eller under huden. Vid en rubbning i blodets levringsförmåga kan de besluta sig för att injicera under huden, men det kan orsaka fler lokala biverkningar, bland annat en liten knöl under huden.
Om du har ytterligare frågor om användningen av detta läkemedel, kontakta läkare, apotekspersonal eller sköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Allvarliga allergiska reaktioner
Om något av dessa symtom uppstår efter att du lämnat stället där du eller ditt barn fick injektionen måste du OMEDELBART kontakta läkare:
- andningssvårigheter
- blåfärgning av tungan eller läpparna
- utslag
- svullnad av ansiktet eller halsen
- lågt blodtryck som orsakar yrsel eller kollaps
Om dessa tecken eller symtom inträffar, utvecklas de vanligtvis mycket snabbt efter att injektionen har givits och medan du eller ditt barn fortfarande är på kliniken eller läkarmottagningen. Som med alla vacciner kan det i mycket sällsynta fall (hos 1 av 10 000 patienter) förekomma allvarliga allergiska reaktioner.
Övriga biverkningar
Följande biverkningar observerades under kliniska prövningar som utfördes i specifika åldersgrupper.
Barn i åldrarna 4 till 6 år
Mycket vanliga (kan förekomma hos fler än 1 av 10 personer):
- minskad aptit
- huvudvärk
- diarré
- trötthet
- smärta
- rodnad
- svullnad i det område där vaccinet injicerades.
Vanliga (kan förekomma hos 1 av 10 personer):
- illamående
- kräkningar
- utslag
- värk (i hela kroppen) eller muskelsvaghet
- värkande eller svullna leder
- feber
- frossa
- besvär från lymfkörtel i armhålan.
Ungdomar i åldrarna 11 till 17 år
Mycket vanliga (kan förekomma hos fler än 1 av 10 personer):
- huvudvärk
- diarré
- illamående
- värk (i hela kroppen) eller muskelsvaghet
- värkande eller svullna leder
- trötthet/svaghet
- allmän sjukdomskänsla
- frossa
- smärta
- rodnad och svullnad i det område där vaccinet injicerades.
Vanliga (kan förekomma hos 1 av 10 personer):
- kräkning
- utslag
- feber
- besvär från lymfkörtel i armhålan.
Vuxna i åldrarna 18 till 64 år
Mycket vanliga (kan förekomma hos fler än 1 av 10 personer):
- huvudvärk
- diarré
- värk (i hela kroppen) eller muskelsvaghet
- trötthet/svaghet
- allmän sjukdomskänsla
- smärta
- rodnad och svullnad i det område där vaccinet injicerades.
Vanliga (kan förekomma hos 1 av 10 personer):
- illamående
- kräkningar
- utslag
- värkande eller svullna leder
- feber
- frossa
- besvär från lymfkörtel i armhålan.
Följande ytterligare biverkningar har rapporterats i de olika rekommenderade åldersgrupperna under den tid som Triaxis har varit på marknaden. Frekvensen för dessa biverkningar kan inte beräknas exakt, eftersom det skulle baseras på frivillig rapportering i förhållande till ett uppskattat antal vaccinerade personer.
- Allergiska/allvarliga allergiska reaktioner (hur du känner igen en sådan reaktion kan du läsa om i början av avsnitt Eventuella biverkningar), stickningar eller domningar, förlamning av en del av eller hela kroppen (Guillain-Barrés syndrom), nervinflammation i armen (brakial neurit), förlust av funktion i den nerv som styr ansiktsmusklerna (ansiktsförlamning), anfall (kramper), svimning, inflammation i ryggmärgen (myelit), inflammation i hjärtmuskulaturen (myokardit), klåda, nässelfeber, inflammation i en muskel (myosit), omfattande svullnad av armen med rodnad, värme och ömhet eller smärta i det område där vaccinet injicerades, blåmärke, böld eller en liten knöl eller i det område där vaccinet injicerades.
Rapportering av biverkningar
Om du eller ditt barn får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på etiketten efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2°C-8°C). Får ej frysas. Fruset vaccin ska kasseras.
Förvara sprutan i ytterkartongen. Ljuskänsligt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
De aktiva substanserna i varje dos (0,5 ml) vaccin är:
Difteritoxoid inte mindre än 2 internationella enheter (2 Lf)
Tetanustoxoid inte mindre än 20 internationella enheter (5 Lf)
Pertussisantigener
- Pertussistoxoid 2,5 mikrogram
- Filamentöst hemagglutinin 5 mikrogram
- Pertaktin 3 mikrogram
- Fimbria typ 2 och 3 5 mikrogram
Adsorberat på aluminiumfosfat 1,5 mg (0,33 mg Al3+)
Detta vaccin innehåller aluminiumfosfat som adjuvans. Adjuvanser är innehållsämnen som finns i vissa vacciner för att påskynda, förbättra och/eller förlänga den skyddande effekten av vaccinet.
Övriga innehållsämnen är: fenoxyetanol, vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
Triaxis finns som suspension för injektion i förfylld spruta (0,5 ml):
- utan nål – förpackningar om 1 eller 10
- med 1 eller 2 separata nålar – förpackningar om 1 eller 10
- med separat nål med nålskydd – förpackningar om 1 eller 10.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Vaccinets normala utseende är en grumlig vit suspension som kan bilda bottensats och klumpar eller flagor vid förvaring. Efter noggrann omskakning är det en homogen vit vätska. Om klumpar eller flagor förekommer kan sprutan skakas igen tills en homogen suspension erhålls.
Innehavare av godkännande för försäljning:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly
Frankrike
Tillverkare:
Sanofi Winthrop Industrie
1541 avenue Marcel Mérieux
69280 Marcy l’Etoile
Frankrike
Sanofi Winthrop Industrie
Voie de l’Institut - Parc Industriel d’Incarville
B.P 101
27100 Val de Reuil
Frankrike
Lokal representant:
Sanofi Oy
Norrskensgränden 1
02100 Esbo
Tel: +358 (0) 201 200 300
Denna bipacksedel ändrades senast 12.12.2025
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Förberedelse för administrering
Den förfyllda sprutan kan ha en Luer Lock-koppling med antingen ett mjukt spetsskydd (bild A) eller ett styvt spetsskydd (bild B). Sprutan med injektionsvätska, suspension ska kontrolleras visuellt före administrering. Om främmande partiklar, läckage, för tidig aktivering av kolven eller ett defekt spetsskydd förekommer ska den förfyllda sprutan kasseras. Sprutan är endast avsedd för engångsbruk och får inte återanvändas.
Bruksanvisning för användning av förfylld Luer Lock-spruta:
Bild A: Luer Lock-spruta med mjukt spetsskydd
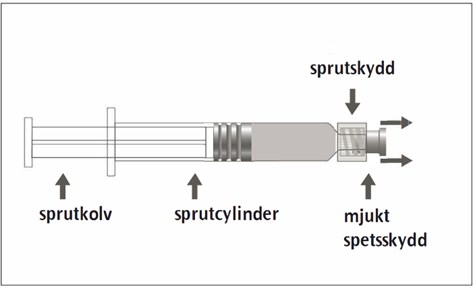
| Steg 1: Håll i sprutskyddet med en hand (undvik att hålla i sprutkolven eller sprutcylindern), dra av spetsskyddet. | 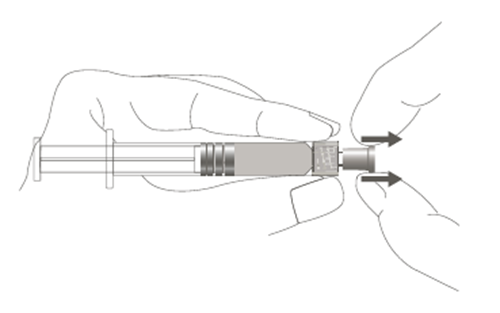 |
| Steg 2: Fäst nålen vid sprutan genom att försiktigt vrida nålen medurs på sprutan, tills du känner ett litet motstånd. | 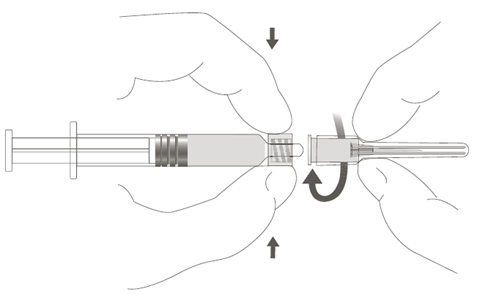 |
Bild B: Luer Lock-spruta med styvt spetsskydd
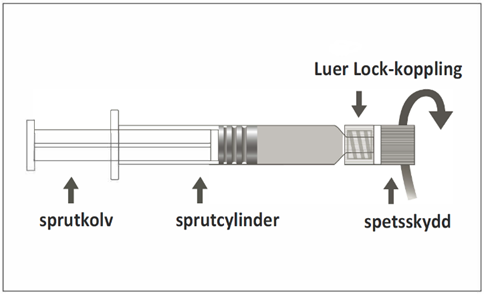
Steg 1: Håll i Luer Lock-kopplingen med en hand (undvik att hålla i sprutkolven eller sprutcylindern), ta av spetsskyddet genom att vrida det. | 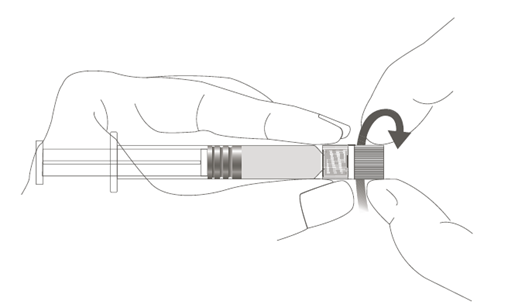 |
Steg 2: Fäst nålen vid sprutan genom att försiktigt vrida fast nålen i Luer Lock-kopplingen på sprutan, tills du känner ett litet motstånd. | 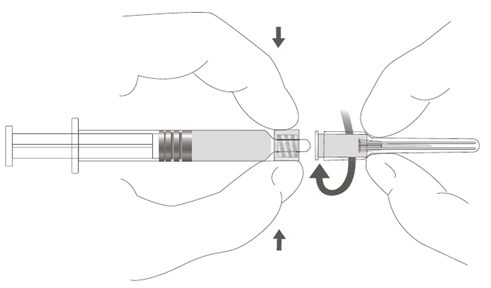 |
Bruksanvisning för användning av förfylld Luer Lock-spruta med nålskydd:
Följ Steg 1 och 2 ovan för att bereda Luer Lock-sprutan och nålen för fastsättning.
| Bild C: Nål med nålskydd (inuti hylsa) | Bild D: Delar av nål med nålskydd (förberett för användning) |
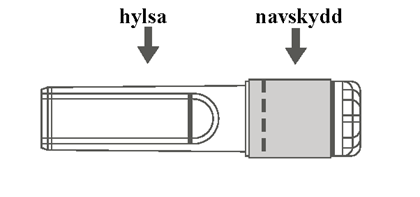 | 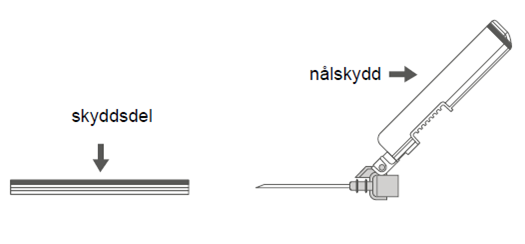 |
Steg 3: Dra nålskyddets hylsa rakt av. Nålen täcks av nålskyddet och skyddsdelen. | |
Steg 4: A: Lyft nålskyddet bort från nålen och bakåt mot sprutcylindern till den vinkel som visas i bilden.
| 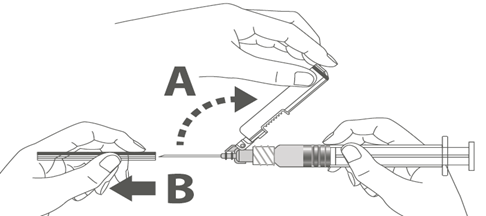 |
Steg 5: Efter injektionen ska nålskyddet låsas (aktiveras) genom att använda en av de tre (3) enhandsteknikerna som visas i bilden: aktivering mot en yta, med tummen eller med fingret. Observera: Aktiveringen har lyckats när du hör och/eller känner ett ”klick”.
| 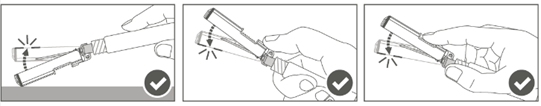 |
Steg 6: Kontrollera visuellt att nålskyddet har aktiverats. Nålskyddet ska vara helt låst (aktiverat) såsom visas i bild C.
I bild D visas ett nålskydd som INTE är helt låst (inte aktiverat).
| 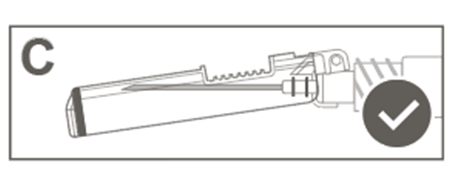 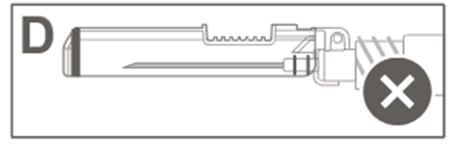 |
Varning: Försök inte låsa upp (avaktivera) skyddsmekanismen genom att tvinga ut nålen från nålskyddet.
| |
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Skyddshättan ska inte sättas tillbaka på kanyler.