Pakkausseloste
ELIGARD injektiokuiva-aine ja liuotin, liuosta varten 7,5 mg
ELIGARD 7,5 mg
injektiokuiva-aine ja liuotin, liuosta varten
leuproreliiniasetaatti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Eligard on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Eligard-valmistetta
- Miten Eligard-valmistetta käytetään
- Mahdolliset haittavaikutukset
- Eligard-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Eligard-valmisteen vaikuttava aine kuuluu gonadotropiinien vapauttajahormonien ryhmään. Näitä lääkkeitä käytetään vähentämään tiettyjen sukupuolihormonien (testosteronin) muodostumista.
Eligard-valmistetta käytetään aikuisten miesten hormoniriippuvaisen, metastasoituneen eturauhassyövän hoitoon sekä suuririskisen, ei-metastasoituneen hormoniriippuvaisen eturauhassyövän hoitoon yhdistettynä sädehoitoon.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Eligard-valmistetta
- jos olet nainen tai lapsi
- jos olet yliherkkä (allerginen) vaikuttavalle aineelle, leuproreliiniasetaatille; valmisteille, jotka vaikuttavat samalla tavalla kuin luonnollinen gonadotropiinihormoni tai Eligard-valmisteen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- Kirurgisen kivestenpoiston jälkeen, sillä tässä tapauksessa Eligard ei alenna seerumin testosteronitasoja enempää.
- Jos käytät ainoastaan Eligard-valmistetta ja sinulla on selkäytimen pinteeseen liittyviä oireita tai selkärangan etäpesäkkeitä, Eligard-valmistetta tulee käyttää ainoastaan yhdistettynä muuhun eturauhassyövän hoitoon käytettyyn lääkkeeseen.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät Eligard-valmistetta.
- Jos sinulla on jokin seuraavista: sydän- tai verisuonisairaus, mukaan lukien sydämen rytmihäiriöt (arytmia) tai saat lääkehoitoa näihin tiloihin. Rytmihäiriöiden riski saattaa suurentua Eligard-hoidon aikana.
- Jos sinulla on virtsaamisvaikeuksia. Sinua tarkkaillaan huolellisesti hoidon ensimmäisten viikkojen ajan.
Jos sinulle kehittyy selkäytimen pinnetila tai virtsaamishäiriöitä. Muiden sellaisten lääkkeiden yhteydessä, joiden vaikutusmekanismi on samanlainen kuin Eligard-valmisteen, on raportoitu vakavasta selkäytimen pinnetilasta sekä munuaisten ja virtsarakon välisten virtsanjohtimien ahtaumasta, joka voi johtaa halvautumista muistuttaviin oireisiin. Näissä tapauksissa on välittömästi annettava oireenmukaista standardihoitoa.
- Jos sinulla ilmenee äkillistä päänsärkyä, oksentelua, mielentilan muutoksia ja joskus sydänkollapsia kahden viikon kuluessa Eligardin ottamisesta, ota välittömästi yhteyttä lääkäriin tai hoitohenkilökuntaan. Nämä liittyvät harvinaiseen pituitaariseen apopleksiaan, jota on todettu MUILLA lääkkeillä, joilla on sama mekanismi kuin Eligardilla.
- Jos sinulla on diabetes (kohonneet veren sokeritasot). Sinua tulisi tarkkailla säännöllisesti hoidon aikana.
- Eligard-hoito saattaa lisätä osteoporoosista (luun tiheyden aleneminen) johtuvaa murtumariskiä.
- Eligardia käyttävillä potilailla on todettu masennusta. Kerro lääkärille, jos tunnet itsesi alakuloiseksi/masentuneeksi Eligardin käytön aikana.
- Potilailla, jotka käyttävät Eligardia muistuttavia lääkkeitä, on todettu sydän- ja verisuonitapahtumia. Ei ole tiedossa, onko näiden tapahtumien ja lääkkeiden välillä yhteyttä. Kerro lääkärille, jos saat sydämeen ja verisuoniin liittyviä oireita tai merkkejä Eligardin käytön aikana.
- Potilailla, joille on annettu Eligardia, on todettu kouristuksia. Kerro lääkärille, jos saat kouristuksia Eligardin käytön aikana.
- Jos sinulle ilmaantuu kovaa tai toistuvaa päänsärkyä, näköhäiriöitä ja korvien soimista tai surinaa, ota välittömästi yhteys lääkäriin.
Jos sinulla on rasvamaksasairaus.
Leuproreliinin yhteydessä on raportoitu vaikeita ihottumia, mukaan lukien Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi (SJS/TEN). Lopeta leuproreliinin käyttö ja hakeudu välittömästi lääkärin hoitoon, jos havaitset jotakin näihin vakaviin ihoreaktioihin liittyvistä oireista, jotka on kuvattu kohdassa Mahdolliset haittavaikutukset.
Hoidon alussa ilmenevät komplikaatiot
Eligard-hoidon ensimmäisen viikon aikana veren testosteronitasot yleensä nousevat hieman. Tästä voi aiheutua oireiden ohimenevää pahenemista ja uusia oireita, joita ei ole aiemmin ilmennyt. Näitä voivat erityisesti olla luukipu, virtsaamisvaivat, selkäytimen pinnetila tai verivirtsaisuus. Tavallisesti oireet häviävät hoidon jatkuessa. Jos oireet eivät häviä, ota yhteyttä lääkäriin.
Jos Eligard-valmisteesta ei ole apua
Osalla potilaista on kasvaimia, jotka eivät ole herkkiä seerumin alentuneille testosteronipitoisuuksille. Kerro lääkärillesi, jos sinusta tuntuu, että Eligard-valmisteen vaikutus on liian heikko.
Muut lääkevalmisteet ja Eligard
Eligard saattaa häiritä joitakin sydämen rytmihäiriöihin käytettyjä lääkkeitä (esim. kinidiini, prokainamidi, amiodaroni ja sotaloli) tai se saattaa lisätä rytmihäiriöiden riskiä käytettynä muiden lääkkeiden kanssa, esim. metadoni (kivunlievitykseen ja osana lääkevieroitusta), moksifloksasiini (antibiootti), vakaviin psyykkisiin sairauksiin käytettävät psykoosilääkkeet.
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät tai olet äskettäin käyttänyt muita lääkkeitä, myös lääkkeitä, joita lääkäri ei ole määrännyt.
Raskaus ja imetys
Eligard-valmistetta ei ole tarkoitettu naisille.
Ajaminen ja koneiden käyttökyky
Väsymys, huimaus ja näköhäiriöt ovat mahdollisia Eligard-hoidosta tai itse sairaudesta johtuvia haittavaikutuksia. Jos sinulla on näitä oireita, noudata varovaisuutta ajaessasi ja käyttäessäsi koneita.
Miten valmistetta käytetään
Annos
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Ellei lääkäri ole toisin määrännyt, Eligard 7,5 mg annetaan kuukauden välein.
Injektiona annetussa liuoksessa vaikuttava aine on pitkävaikutteinen ja valmisteesta vapautuu vaikuttavaa ainetta, leuproreliiniasetaattia kuukauden ajan.
Lisätutkimukset
Lääkärin tulisi tarkistaa Eligard-valmisteen hoitovaste kliinisten parametrien ja prostataspesifistä antigeeniä (PSA) mittaavan verikokeen avulla.
Antotapa
Eligard-valmisteen saa antaa vain lääkäri tai hoitohenkilökunta. He myös huolehtivat valmisteen käyttövalmiiksi saattamisesta.
Liuottamisen jälkeen Eligard-valmiste annetaan ihonalaisena injektiona (injektio ihon alla olevaan kudokseen). Injektiota ei saa antaa intra-arteriaalisesti (valtimoon) tai intravenoosisti (laskimoon).
Kuten muillakin ihon alle injektoitavilla valmisteilla, injektiokohtaa tulisi vaihdella.
Jos käytät enemmän Eligard-valmistetta kuin sinun pitäisi
Koska injektion antaa yleensä lääkäri tai hoitohenkilökunta, yliannos ei ole todennäköinen.
Jos kuitenkin saat vahingossa yliannoksen lääkettä, lääkärisi tarkkailee sinua ja antaa tarvittavaa lisähoitoa.
Jos unohdat käyttää Eligard-valmistetta
Kerro lääkärillesi, jos epäilet, että Eligard-annoksesi on jäänyt ottamatta.
Jos lopetat Eligard-valmisteen käytön
Yleensä prostatasyövän hoito Eligard-valmisteella on pitkäaikaishoitoa. Siksi hoitoa ei pidä keskeyttää, vaikka oireet helpottaisivat tai häviäisivät kokonaan.
Sairauteen liittyvät oireet saattavat pahentua, jos hoito keskeytetään liian aikaisin.
Valmisteen käyttöä ei pidä lopettaa keskustelematta ensin lääkärin kanssa.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, Eligard-valmistekin voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Eligard-hoidon aikana havaitut haittavaikutukset johtuvat pääasiassa vaikuttavan aineen, leuproreliiniasetaatin, vaikutuksesta tiettyjen hormonipitoisuuksien nousuun ja laskuun.
Yleisimmin havaitut haittavaikutukset ovat kuumat aallot (n. 58 %:lla potilaista), pahoinvointi, huonovointisuus ja väsymys sekä ohimenevä ärsytys injektiokohdassa.
Hoidon alussa ilmenevät haittavaikutukset
Ensimmäisinä viikkoina Eligard-hoidon aloittamisen jälkeen sairauteen liittyvät oireet saattavat pahentua, sillä miessukupuolihormonin, testosteronin tasot yleensä nousevat hetkellisesti. Tästä syystä lääkärisi saattaa määrätä sinulle hoidon alussa antiandrogeeniä (testosteronin vastavaikuttajaa), mahdollisten jälkivaikutusten vähentämiseksi (ks. myös kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä. Mitä sinun on tiedettävä, ennen kuin käytät Eligard-valmistetta, Hoidon alussa ilmenevät komplikaatiot).
Paikalliset haittavaikutukset
Eligard-injektion jälkeen ilmenevät paikalliset haittavaikutukset ovat samoja kuin muillakin subkutaanisesti (ihon alla olevaan kudokseen) injektoitavilla valmisteilla. Lievä kirvely injektion antamisen jälkeen on erittäin yleistä. Pistely ja kipu sekä mustelma injektiokohdassa ovat yleisiä. Ihon punoitusta injektiokohdassa on todettu yleisesti. Ihokudoksen kovettuminen ja haavaumat ovat melko harvinaisia.
Nämä ihonalaisesta injektiosta johtuvat paikalliset haittavaikutukset ovat lieviä ja lyhytaikaisia. Niitä ei ilmene uudelleen yksittäisten injektioiden välillä.
Hyvin yleiset haittavaikutukset (saattavat esiintyä useammalla kuin 1 käyttäjällä 10:stä)
- kuumat aallot
- ihon tai limakalvojen äkilliset verenvuodot, ihon punoitus
- väsymys, injektiokohdan haittavaikutukset (ks. myös paikalliset haittavaikutukset yllä)
Yleiset haittavaikutukset (saattavat esiintyä enintään 1 käyttäjällä 10:stä)
- nenän ja nielun tulehdus (kylmettymisoireet)
- pahoinvointi, huonovointisuus, ripuli, maha-suolitulehdus (gastroenteriitti/koliitti)
- kutina, yöhikoilu
- nivelkipu
- tihentynyt virtsaamistarve (myös öisin), virtsaamisvaikeudet, kipu virtsatessa, alentunut virtsaneritys
- rintojen arkuus, rintojen suureneminen, kivesten surkastuminen, kipu kiveksissä, infertiliteetti, erektiohäiriöt, peniksen koon pieneneminen
- vilunväristykset (puistatukset ja korkea kuume), heikkouden tunne
- pidentynyt vuotoaika, veriarvojen muutokset, vähentynyt/alhainen veren punasolujen määrä
Melko harvinaiset haittavaikutukset (saattavat esiintyä enintään 1 käyttäjällä 100:sta)
- virtsatieinfektio, paikallinen ihotulehdus
- diabeteksen paheneminen
- epätavalliset unet, masennus, libidon (seksuaalinen halukkuus) heikkeneminen
- heitehuimaus, päänsärky, heikentynyt tunto, unettomuus, maku- ja hajuaistin häiriöt
- hypertonia (kohonnut verenpaine), hypotonia (alentunut verenpaine)
- hengästyminen
- ummetus, suun kuivuminen, ruoansulatushäiriöt, oksentelu
- ihon nihkeys, lisääntynyt hikoilu
- selkäkipu, lihaskouristukset
- verivirtsaisuus
- virtsarakon kouristus, tihentynyt virtsaamistarve, virtsaamisvaikeudet
- rintakudoksen suureneminen miehillä, impotenssi
- uneliaisuus, kipu, kuume
- painonnousu
- tasapainohäiriöt, pyörrytys
- lihasten surkastuminen/lihaskudoksen häviäminen pitkäaikaisen käytön jälkeen
Harvinaiset haittavaikutukset (saattavat esiintyä enintään 1 käyttäjällä 1000:sta)
- epänormaalit tahattomat liikkeet
- äkillinen tajuttomuus, pyörtyminen
- ilmavaivat, röyhtäily
- hiustenlähtö, ihottuma
- rintakipu
- injektiokohdan haavaumat
Hyvin harvinaiset haittavaikutukset (saattavat esiintyä enintään 1 käyttäjällä 10 000:sta)
- injektiokohdan kuolio
Raportoitu (esiintymistiheys ei tiedossa)
- muutokset EKG:ssä (QT-ajan pidentyminen)
- keuhkojen tulehdus, keuhkosairaus
- idiopaattinen kallonsisäisen paineen (aivopaineen) kohoaminen (jonka oireita ovat päänsärky, kaksoiskuvat ja muut näköhäiriöt sekä korvan tai korvien soiminen tai surina)
punoittavia läiskiä keholla (maalitaulua muistuttavia tai rengasmaisia läiskiä, jotka eivät ole koholla ja joiden keskellä saattaa olla rakkuloita), ihon kesimistä, haavaumia suussa, nielussa, nenässä, sukupuolielimissä ja silmissä. Näitä vakavia ihottumia voivat edeltää kuume ja flunssankaltaiset oireet (Stevens-Johnsonin oireyhtymä / toksinen epidermaalinen nekrolyysi)
ihon punoitus ja kutiseva ihottuma (toksinen ihottuma)
ihoreaktio, joka aiheuttaa iholle punaisia täpliä tai läiskiä, joiden muoto saattaa muistuttaa maalitaulua (tummanpunainen keskiosa, jota ympäröivät vaaleammat punertavat renkaat) (erythema multiforme)
Muita haittavaikutuksia
Muita Eligard-valmisteen vaikuttavan aineen, leuproreliinin käytön yhteydessä kirjallisuudessa kuvattuja haittavaikutuksia ovat ödeema (nesteen kertyminen kudoksiin, ilmenee käsien ja jalkojen turpoamisena), keuhkoembolia (aiheuttaa hengästymistä, hengitysvaikeuksia ja rintakipua), sydämentykytys (sydämen sykinnän aiheuttama tuntemus), lihasheikkous, vilunväristykset, ihottuma, muistin heikentyminen, näön heikentyminen. Luun tiheyden alenemiseen (osteoporoosi) viittaavia merkkejä voidaan olettaa ilmenevän pitkään jatkuvan Eligard-hoidon aikana. Osteoporoosin myötä luunmurtumariski kasvaa.
Hengitysvaikeuksia tai huimausta aiheuttaneita vakavia allergisia reaktioita on joskus harvoin raportoitu sen jälkeen, kun potilaalle on annettu Eligardin kanssa samaan luokkaan kuuluvia valmisteita.
Kouristuksia on raportoitu sen jälkeen, kun potilaalle on annettu Eligardin kanssa samaan luokkaan kuuluvia valmisteita.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytysohjeet
Säilytä jääkaapissa 2 °C–8 °C.
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Valmisteen on oltava huoneenlämpöistä ennen pistämistä. Ota pois jääkaapista noin 30 minuuttia ennen käyttöä. Kun valmiste on otettu pois jääkaapista, sitä voidaan säilyttää alkuperäispakkauksessaan huoneenlämmössä (alle 25 °C) enintään 4 viikon ajan.
Alustan avaamisen jälkeen valmiste on saatettava käyttövalmiiksi ja annettava välittömästi. Ainoastaan kertakäyttöön.
Käyttämättömien tai vanhentuneiden Eligard-pakkausten hävitysohjeet
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Eligard sisältää
- Vaikuttava aine on leuproreliiniasetaatti.
Yksi esitäytetty ruisku (ruisku B) sisältää 7,5 mg leuproreliiniasetaattia.
- Muut aineet ovat poly(DL-laktaattiglykolaatti)(50:50) ja N-metyylipyrrolidoni esitäytetyssä liuotinruiskussa (ruisku A).
Lääkevalmisteen kuvaus ja pakkauskoot
Eligard-valmisteen lääkemuoto on injektiokuiva-aine ja liuotin, liuosta varten.
Eligard 7,5 mg -valmisteesta ovat saatavina seuraavat pakkaukset:
- Lämpömuovattu alustapakkaus ja steriili 20 G neula pahvikotelossa.
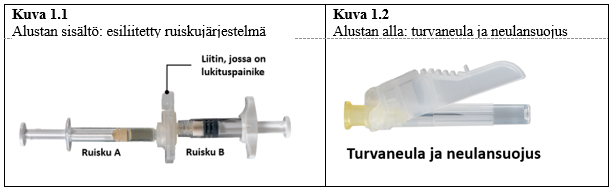
Alusta sisältää kuivikeainepussin ja esiliitetyn ruiskujärjestelmän, joka koostuu seuraavista osista:- liuottimella esitäytetty ruisku A
- kuiva-aineella esitäytetty ruisku B
- liitin, jossa on lukituspainike ruiskuille A ja B.
- Monipakkaus, jossa on 3 esiliitettyä ruiskujärjestelmää sisältäviä settejä.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali 1
20148 Milano
Italia
Valmistaja
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali 1
20148 Milano
Italia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Recordati AB, Ruotsi
Puh.: +46 8 545 80 230
Tällä lääkevalmisteella on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä:
Itävalta: Eligard Depot 7.5 mg
Belgia: Depo-Eligard 7.5 mg
Kypros: Eligard
Tshekki: Eligard
Tanska: Eligard
Viro: Eligard
Suomi: Eligard
Ranska: Eligard 7.5 mg
Saksa: Eligard 7.5 mg
Unkari: Eligard 7.5 mg
Islanti: Eligard
Irlanti: Eligard 7.5 mg
Italia: Eligard
Latvia: Eligard 7.5 mg
Liettua: Eligard 7.5 mg
Luxemburg: Depo-Eligard 7.5 mg
Alankomaat: Eligard 7.5 mg
Norja: Eligard
Puola: Eligard 7.5 mg
Portugali: Eligard 7.5 mg
Slovakia: Eligard 7.5 mg
Slovenia: Eligard 7.5 mg
Ruotsi: Eligard
Tämä pakkausseloste on tarkistettu viimeksi 11.10.2024
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhoitoalan ammattilaisille:
Anna tuotteen lämmetä huoneenlämpöiseksi ennen käyttöä ottamalla se pois jääkaapista noin 30 minuuttia ennen käyttöä. Valmistele potilas injektiota varten ennen valmisteen käyttövalmiiksi saattamista seuraavien ohjeiden mukaan. Jos valmistetta ei ole saatettu käyttövalmiiksi asianmukaista tekniikkaa käyttäen, sitä ei pidä antaa potilaalle, sillä valmisteen kliininen teho saattaa heikentyä, jos käyttövalmiiksi saattamista ei ole tehty oikein.
Vaihe 1
Ottaaksesi sisällön pois alustasta avaa alusta puhtaalla pinnalla repimällä folio irti kulmista. Hävitä kuivikepussi. Ota esiliitetty ruiskujärjestelmä (kuva 1.1) alustasta. Avaa turvaneulapakkaus (kuva 1.2) vetämällä suojapaperista. Huom. Ruiskujen A ja B ei pidä vielä olla kohdakkain.
Vaihe 2
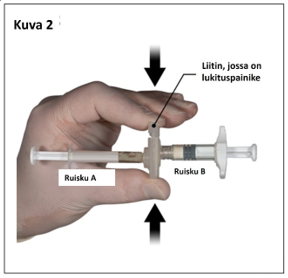
Ota peukalolla ja etusormella kiinni liittimessä sijaitsevasta lukituspainikkeesta ja paina sitä (kuva 2), kunnes kuulet napsahduksen. Ruiskut asettuvat kohdakkain. Ruiskujärjestelmää ei tarvitse pidellä tietynsuuntaisesti liittimen aktivoimiseksi. Älä taivuta ruiskujärjestelmää (huom. taivuttaminen voi aiheuttaa vuotoja, sillä ruiskut saattavat kiertyä osittain irti).
Vaihe 3
Pitele ruiskuja vaakatasossa ja siirrä ruiskussa A oleva neste ruiskussa B olevaan leuproreliiniasetaatti¬kuiva-aineeseen. Sekoita perusteellisesti mutta varovasti siirtämällä valmistetta edestakaisin ruiskusta toiseen 60 kierroksen verran (yksi kierros tarkoittaa ruiskun A männän yhtä painallusta ja ruiskun B männän yhtä painallusta) pitäen ruiskut vaaka-asennossa, jotta saat tasaisen, viskoosisen liuoksen (kuva 3). Älä taivuta ruiskujärjestelmää (huom. taivuttaminen voi aiheuttaa vuotoja, sillä ruiskut saattavat kiertyä osittain irti).
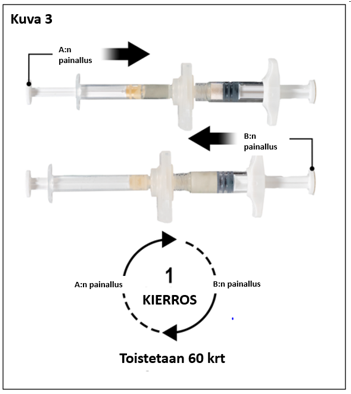
Huolellisen sekoittamisen jälkeen muodostuu viskoosinen, väriltään väritön, valkoinen tai ruskehtava liuos (häivähdys valkoisesta kellertävään).
Tärkeää: Etene seuraavaan vaiheeseen välittömästi sekoittamisen jälkeen, sillä valmisteen viskositeetti kasvaa ajan myötä. Älä laita sekoitettua valmistetta jääkaappiin.
Huom: Sekoittaminen on tehtävä ohjeiden mukaan. Ravistamalla valmiste EI sekoitu riittävästi.
Vaihe 4
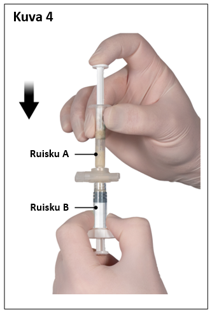
Pidä sekoittamisen jälkeen ruiskut pystyasennossa siten, että ruisku B on alempana. Ruiskujen pitäisi pysyä tiukasti yhdessä. Vedä koko sisältö ruiskuun B (lyhyt, leveä ruisku) painamalla ruiskun A mäntää ja vetämällä kevyesti ruiskun B männästä (kuva 4).
Vaihe 5
Varmista, että ruiskun A mäntä on painettu pohjaan. Pidä kiinni liittimestä ja kierrä se irti ruiskusta B. Ruisku A on edelleen kiinni liittimessä (kuva 5). Varmista, ettei liuosta valu ulos, sillä neula ei tällöin kiinnity kunnolla.
Huom: Valmisteeseen saattaa jäädä yksi iso tai useita pieniä ilmakuplia; tämä on asiaankuuluvaa.
Älä poista ilmakuplia ruiskusta B tässä vaiheessa, sillä valmistetta saattaa joutua hukkaan.
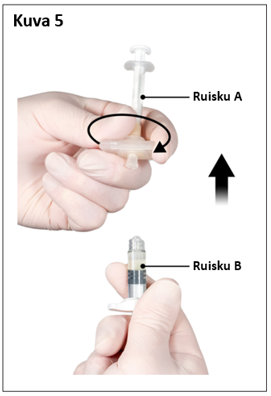
Vaihe 6
- Pidä ruisku B pystyasennossa ja pidä valkoista mäntää vedettynä, jotta liuosta ei joudu hukkaan.
- Kiinnitä turvaneula ruiskuun B pitämällä ruiskua ja kääntämällä neulaa varovasti myötäpäivään noin kolme neljäsosakierrosta, kunnes neula on tukevasti kiinni (kuva 6).
Älä kierrä liian tiukalle, koska neulan kanta voi haljeta, minkä seurauksena liuosta voi vuotaa injektoinnin aikana. Myös turvasuojus voi vahingoittua, jos neula kierretään kiinni liikaa voimaa käyttäen.
Jos neulan kanta halkeaa, näyttää vaurioituneelta tai vuotaa, valmistetta ei saa käyttää. Vaurioitunutta neulaa ei saa korvata tai vaihtaa, eikä liuosta saa injektoida. Koko valmiste on hävitettävä turvallisesti.
Jos neulan kanta vaurioituu, koko valmiste on vaihdettava uuteen.
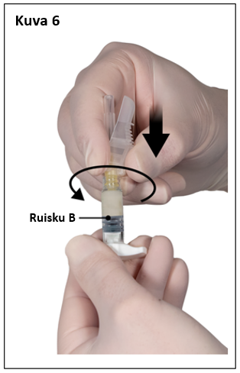
Vaihe 7
Poista neulan turvasuojus ja vedä pois neulansuojus juuri ennen valmisteen antamista (kuva 7).
Tärkeää: Älä koske turvaneulamekanismiin ennen valmisteen antamista. Jos neulan kanta näyttää vaurioituneelta tai vuotaa, valmistetta EI saa käyttää. Vaurioitunutta neulaa EI saa vaihtaa EIKÄ valmistetta pistää. Jos neulan kanta vaurioituu, käytä toista Eligard-settiä.
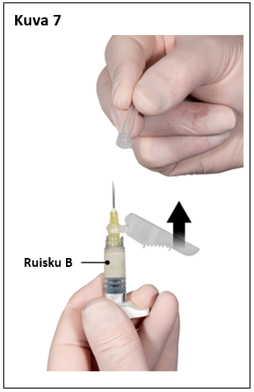
Vaihe 8
Ennen valmisteen antoa poista ruiskussa B mahdollisesti olevat isot ilmakuplat. Anna valmiste ihon alle, ja pidä turvasuojus loitolla neulasta.
Valmisteen anto:
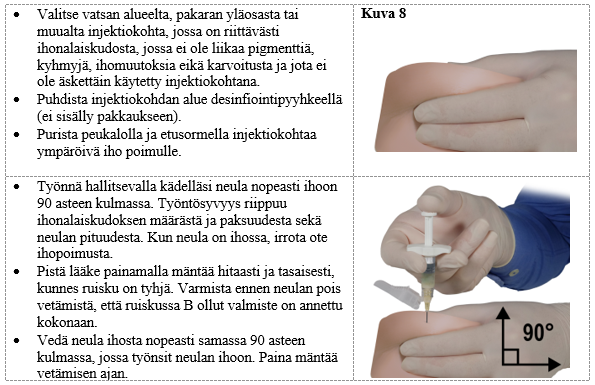
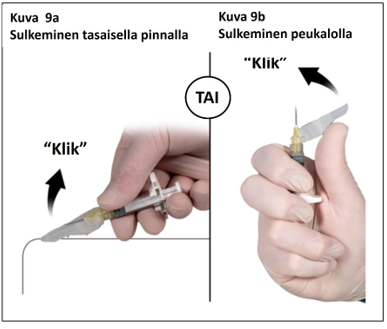
Vaihe 9
Injektion jälkeen lukitse neulan turvasuojus jommalla kummalla alla esitetyistä tavoista.
1. Sulkeminen tasaisella pinnalla
Paina turvasuojusta, vipupuoli alaspäin, tasaista pintaa vasten (kuva 9a) neulan peittämiseksi ja suojuksen lukitsemiseksi.
Varmista lukitus kuuntelemalla ja tunnustelemalla (lukituksesta kuuluu ”klik”). Turvaneula on lukittu, kun neulan kärki on kokonaan peitetty.
2. Sulkeminen peukalolla
Aseta peukalo turvasuojuksen alle (kuva 9b), peitä neulan kärki suojuksella, ja lukitse suojus.
Varmista lukitus kuuntelemalla ja tunnustelemalla (lukituksesta kuuluu ”klik”). Turvaneula on lukittu, kun neulan kärki on kokonaan peitetty.
Kun turvasuojus on lukittu, hävitä neula ja ruisku heti laittamalla ne niille kuuluviin säiliöihin.