Pakkausseloste
ADVATE pulver och vätska till injektionsvätska, lösning 250 IU, 500 IU, 1000 IU, 1500 IU, 2000 IU, 3000 IU
Tilläggsinformation
ADVATE 250 IE pulver och vätska till injektionsvätska, lösning
ADVATE 500 IE pulver och vätska till injektionsvätska, lösning
ADVATE 1000 IE pulver och vätska till injektionsvätska, lösning
ADVATE 1500 IE pulver och vätska till injektionsvätska, lösning
ADVATE 2000 IE pulver och vätska till injektionsvätska, lösning
ADVATE 3000 IE pulver och vätska till injektionsvätska, lösning
octocog alfa (rekombinant human koagulationsfaktor VIII)
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna bipacksedel, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad ADVATE är och vad det används för
2. Vad du behöver veta innan du använder ADVATE
3. Hur du använder ADVATE
4. Eventuella biverkningar
5. Hur ADVATE ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
ADVATE innehåller den aktiva substansen octocog alfa, human koagulationsfaktor VIII tillverkad genom rekombinant DNA‑teknologi. Faktor VIII behövs för att blodet ska kunna bilda koagel och stoppa blödningar. Hos patienter med hemofili A (medfödd brist på faktor VIII) saknas detta, eller fungerar inte normalt.
ADVATE används för att behandla och förebygga blödningar hos patienter i alla åldersgrupper som har hemofili A (en ärftlig form av blödarsjuka som orsakas av brist på faktor VIII).
ADVATE tillverkas utan tillsats av något protein från människa eller djur under hela tillverkningsprocessen.
Vad du behöver veta innan produkten används
Använd inte ADVATE
- Om du är allergisk mot octocog alfa eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- Om du är allergisk mot mus‑ eller hamsterprotein
Om du är osäker på detta, fråga din läkare.
Varningar och försiktighet
Tala med läkare innan du använder ADVATE. Tala om för din läkare om du tidigare blivit behandlad med faktor VIII‑produkter, speciellt om du utvecklat inhibitorer, eftersom risken kan vara större att det händer igen. Inhibitorer är blockerande antikroppar mot faktor VIII, vilka minskar ADVATEs effekt att förhindra eller kontrollera blödningar. Utveckling av inhibitorer är en känd komplikation i behandlingen av hemofili A. Kontakta genast din läkare om din blödning inte kontrolleras med ADVATE.
Det finns en liten risk att du får en anafylaktisk reaktion (en allvarlig, plötslig allergisk reaktion) av ADVATE. Du bör vara medveten om tidiga tecken på allergiska reaktioner såsom utslag, nässelfeber, allmän klåda, svullnad av läppar och tunga, andningssvårigheter, tryck över bröstet, allmän sjukdomskänsla och yrsel. Dessa symptom kan utgöra ett tidigt symptom på anafylaktisk chock, reaktioner som dessutom kan inkludera svår yrsel, medvetslöshet och kraftiga andningssvårigheter.
Om du upplever något av dessa symptom, avbryt injektionen/infusionen omedelbart och kontakta din läkare. Svåra symptom, som svårigheter att andas och svimningskänsla kräver omedelbar akutbehandling.
Patienter som utvecklar faktor VIII‑inhibitorer
Utveckling av inhibitorer (antikroppar) är en känd komplikation som kan uppträda vid behandling med alla faktor VIII-läkemedel. Inhibitorerna hindrar, särskilt vid höga halter, att behandlingen fungerar som den ska. Du eller ditt barn kommer att övervakas noggrant avseende utveckling av sådana inhibitorer. Om du eller ditt barn drabbas av en blödning som inte kan kontrolleras med ADVATE ska du omedelbart tala om det för din läkare.
Barn och ungdomar
Informationen om varningar och försiktighet gäller för både vuxna och barn (från 0 till 18 år).
Andra läkemedel och ADVATE
Tala om för din läkare om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel.
Körförmåga och användning av maskiner
ADVATE har ingen effekt på förmågan att framföra fordon och använda maskiner.
ADVATE innehåller natrium
Detta läkemedel innehåller 10 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 0,5 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Hur produkten används
Behandling med ADVATE kommer att påbörjas av läkare, som har erfarenhet av behandling av patienter med hemofili A.
Din läkare kommer att räkna ut dosen ADVATE (i internationella enheter eller IE) beroende på ditt tillstånd, din vikt samt om det används för att förebygga eller behandla blödning. Hur ofta behandlingen ges beror på hur bra ADVATE fungerar på dig. Ersättningsbehandling med ADVATE är vanligen en livslång behandling.
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Förebyggande mot blödningar
Vanlig dos är 20 – 40 IE octocog alfa per kg kroppsvikt som ges varannan till var tredje dag. I vissa fall, särskilt hos unga patienter, kan tätare injektioner eller högre doser vara nödvändiga.
Behandling av blödning
Dosen octocog alfa beräknas beroende på din kroppsvikt och de faktor VIII‑nivåer som ska uppnås. Den önskade faktor VIII‑nivån beror på blödningens läge och svårighetsgrad.
Dos (IE) = kroppsvikt (kg) x önskad faktor VIII‑ökning (% av normal) x 0,5
Om du upplever att du inte får fullgod effekt av ADVATE ska du tala med din läkare.
Din läkare kommer att utföra lämpliga laboratorietester för att säkerställa att du har tillräckliga faktor VIII‑nivåer. Detta är särskilt viktigt om du ska genomgå en större operation.
Användning hos barn och ungdomar (från 0 till 18 år)
När det gäller att behandla blödning är dosen för barn densamma som för vuxna patienter. När det gäller att förebygga blödning hos barn under 6 års ålder rekommenderas doser på 20 till 50 IE per kg kroppsvikt 3 till 4 gånger i veckan. Administrering av ADVATE till barn (intravenöst) skiljer sig inte från administrering till vuxna. En anordning för central venåtkomst kan behövas för att möjliggöra frekventa infusioner av faktor VIII‑produkter.
Hur ADVATE ges
ADVATE injiceras vanligtvis i en ven (intravenöst) av din läkare eller sjuksköterska. Du eller någon annan kan också ge ADVATE som injektion, men bara efter nödvändig utbildning. Detaljerade instruktioner för hur man ger sig själv läkemedlet finns i slutet av denna bipacksedel.
Om du använt för stor mängd av ADVATE
Ta alltid ADVATE enligt läkarens anvisningar. Rådfråga läkare om du är osäker. Ifall du injicerar mer ADVATE än rekommenderat, informera din läkare så snart som möjligt.
Om du har glömt att ta ADVATE
Injicera inte dubbel dos för att kompensera den dos du glömt. Ta nästa dos som planerat och fortsätt enligt läkares föreskrift.
Om du slutar ta ADVATE
Sluta inte använda ADVATE utan att rådfråga din läkare.
Om du har ytterligare frågor om detta läkemedel kontakta läkare.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Om svåra, plötsliga allergiska (anafylaktiska) reaktioner uppträder, avbryt omedelbart injektionen. Du måste kontakta din läkare omedelbart om du får något av följande tidiga tecken på allergiska reaktioner:
- utslag, nässelutslag, allmän klåda,
- svullnad av läppar och tunga,
- andningssvårigheter, väsande andning, tryck över bröstet,
- allmän sjukdomskänsla,
- yrsel, medvetslöshet.
Svåra symptom, som svårigheter att andas och svimningskänsla kräver omedelbar akutbehandling.
Bland barn som inte behandlats med faktor VIII-läkemedel tidigare är det mycket vanligt att hämmande antikroppar utvecklas (se avsnitt Vad du behöver veta innan produkten används) (förekommer hos fler än 1 av 10 användare). För patienter som tidigare har behandlats med faktor VIII (behandling mer än 150 dagar) är dock risken mindre och komplikationen är mindre vanlig (förekommer hos färre än 1 av 100 användare). Om du eller ditt barn utvecklar antikroppar kan läkemedlen upphöra att fungera som de ska, och du eller ditt barn kan drabbas av ihållande blödningar. Om detta händer ska du omedelbart kontakta läkare.
Mycket vanliga biverkningar (förekommer hos fler än 1 av 10 användare)
Inhibitorer mot faktor VIII (hos barn som inte behandlats med faktor VIII-läkemedel tidigare).
Vanliga biverkningar (förekommer hos upp till 1 av 10 användare)
Huvudvärk och feber.
Mindre vanliga biverkningar (förekommer hos upp till 1 av 100 användare)
Inhibitorer mot faktor VIII (hos patienter som har behandlats med faktor VIII-tidigare (behandling under mer än 150 dagar)), yrsel, influensa, svimning, onormal hjärtrytm, röda kliade knölar på huden, obehag i bröstet, blåmärken vid injektionsstället, reaktion vid injektionsstället, klåda, ökad svettning, ovanlig smak i munnen, blodvallningar, migrän, minnesproblem, frossbrytningar, diarré, illamående, kräkningar, andfåddhet, ont i halsen, infektion i lymfkärlen, blekhet, ögoninflammation, eksem, ymniga svettningar, svullna ben och fötter, minskad andel röda blodkroppar i blodet, ökat antal av en viss typ av vita blodkroppar (monocyter) och smärta i övre delen av magen eller nedre delen av bröstet.
I samband med operation
kateterrelaterad infektion, minskad mängd röda blodceller, svullnad av extremiteter och leder, förlängd blödning efter avlägsnande av dränage, minskad faktor VIII‑nivå och postoperativt blåmärke.
I samband med anordning för central venåtkomst
Kateterrelaterad infektion, systemisk infektion och lokal blodpropp vid kateterstället.
Biverkningar med okänd frekvens (kan inte beräknas från tillgängliga data).
Potentiellt livshotande reaktioner (anafylaxi) och andra allergiska reaktioner (överkänslighet), allmänna symtom (trötthet, orkeslöshet).
Ytterligare biverkningar hos barn
Utöver utveckling av inhibitorer hos pediatriska patienter som inte behandlats tidigare, samt kateterrelaterade komplikationer, observerades inga åldersspecifika skillnader i biverkningar under de kliniska studierna.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn‑ och räckhåll för barn.
Används före utgångsdatum som anges på etiketten efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C – 8 °C). Får ej frysas.
Under hållbarhetstiden kan blistret med produkten förvaras i rumstemperatur (vid högst 25 °C) i upp till 6 månader. Utgångsdatum för läkemedlet är då slutet av denna 6‑månadersperiod, alternativt det utgångsdatum som står tryckt på blistret, beroende på vilket som infaller tidigast. Notera slutdatumet för 6‑månadersperioden på ytterkartongen. När läkemedlet förvarats i rumstemperatur får det inte sättas tillbaka i kylskåp.
Förvara blistret med produkten i ytterkartongen. Ljuskänsligt.
Denna produkt är endast för engångsbruk. Kassera oanvänd produkt på lämpligt vis.
Använd produkten omedelbart då pulvret är fullständigt upplöst.
Förvara inte produkten i kylskåp efter beredning.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man gör med mediciner som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är octocog alfa (human koagulationsfaktor VIII producerad med rekombinant DNA‑teknologi). Varje injektionsflaska med pulver innehåller nominellt 250, 500, 1000, 1500, 2000 eller 3000 IE octocog alfa.
- Övriga innehållsämnen är mannitol, natriumklorid, histidin, trehalos, kalciumklorid, trometamol, polysorbat 80 och glutation (reducerat).
Injektionsflaska med vätska: 5 ml sterilt vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
ADVATE är ett vitt till gulvitt pulver. Efter beredning är lösningen klar, färglös och utan främmande partiklar.
Innehavare av godkännande för försäljning
Takeda Manufacturing Austria AG
Industriestrasse 67
A‑1221 Wien
Tfn: +800 66838470
e-post: medinfoEMEA@takeda.com
Tillverkare
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80
B‑7860 Lessines
Belgien
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Takeda Oy
Puh/Tel: 0800 774 051
medinfoEMEA@takeda.com
Denna bipacksedel ändrades senast den 07/2022.
Information om detta läkemedel finns tillgänglig på Europeiska läkemedelsmyndighetens hemsida http://www.ema.europa.eu/.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
Instruktioner för beredning och administrering
ADVATE får inte blandas med andra läkemedel eller lösningar.
Det är starkt rekommenderat att notera namn och batchnummer på produkten varje gång ADVATE administreras till en patient.
Instruktioner för beredning
- Används före utgångsdatum som anges på etikett och kartong.
- Använd inte om inte locket på blistret är helt förslutet.
- Lösningen får inte ställas i kylskåp efter beredning.
- Om produkten fortfarande förvaras i kylskåp: ta det förslutna blistret (som innehåller injektionsflaskor med pulver och vätska ihopsatta med beredningssystemet) ur kylskåpet och låt det uppnå rumstemperatur (mellan 15 °C och 25 °C).
- Tvätta händerna noggrant med tvål och varmt vatten.
- Öppna förpackningen med ADVATE genom att dra av locket. Ta ut BAXJECT III ur blistret.
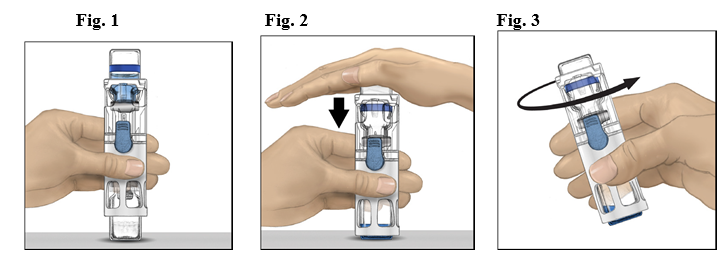
- Placera ADVATE på en plan yta med vattenflaskan överst (Fig. 1). Vattenflaskan har en blå rand. Ta inte av den blå hättan förrän du uppmanas att göra det i ett senare steg.
- Håll ADVATE i BAXJECT III med ena handen och tryck stadigt ned vattenflaskan med den andra handen tills systemet har tryckts ihop helt och vattnet rinner ner i injektionsflaskan med ADVATE (Fig. 2). Luta inte systemet förrän allt vatten har runnit ner i injektionsflaskan.
- Kontrollera att allt vatten har överförts. Snurra flaskan försiktigt tills allt pulver har lösts upp. Se till att ADVATE pulvret är fullständigt upplöst, annars kan inte all färdigberedd lösning passera igenom filtret. Produkten löses upp snabbt (vanligtvis på mindre än 1 minut). Efter beredningen skall lösningen vara klar, färglös och fri från främmande partiklar.
Instruktioner för injektion
Aseptisk teknik är nödvändig under tillförsel.
För administrering krävs en spruta med luer‑lock.
Viktig information:
- Försök inte själv injicera lösningen om du inte har fått träning av din läkare eller sjuksköterska för detta.
- Inspektera den beredda lösningen med avseende på småpartiklar och missfärgning före administrering (lösningen ska vara klar, färglös och fri från främmande partiklar). Använd inte ADVATE om lösningen inte är helt klar eller inte fullständigt löst.
- Avlägsna den blå hättan från BAXJECT III. Dra inte in luft i sprutan. Koppla sprutan till BAXJECT III.
- Vänd på systemet (så att flaskan med färdigberedd lösning hamnar överst). Dra in den färdigberedda lösningen i sprutan genom att sakta dra ut kolven.
- Tag loss sprutan.
- Koppla en ”butterfly”‑nål till sprutan och injicera den beredda lösningen i en ven. Lösningen skall administreras långsamt, i en hastighet som bestäms med hänsyn till patientens tillstånd och får ej överskrida 10 ml per minut. (Se avsnitt Eventuella biverkningar ”Eventuella biverkningar”.)
- Kassera oanvänd produkt på lämpligt vis.
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för sjukvårdspersonal:
Behandling vid behov
I händelse av följande hemorragiska händelser bör faktor VIII‑aktiviteten inte understiga den givna plasmaaktivitetsnivån (i % av normal eller IE/dl) under motsvarande period. Följande tabell kan användas som doseringsvägledning vid blödningsepisoder och kirurgiska ingrepp.
Dos och intervall av administreringen bör anpassas till den kliniska effekten i det enskilda fallet. Under särskilda omständigheter (t.ex. vid förekomst av inhibitor i låg titer) kan högre doser än de beräknade enligt formeln behövas.
| Grad av blödning/typ av kirurgiskt ingrepp |
Erforderlig faktor VIII‑nivå (% eller IE/dl) |
Dosintervall (timmar)/behandlingens längd (dagar) |
|
Blödning |
||
|
Tidig hemartros, muskelblödning eller munblödning. |
20 ‑ 40 |
Upprepa injektionen var 12‑24 timme (8‑24 timme för patienter yngre än 6 år) under minst 1 dag tills blödningsepisoden (upplevd smärta) upphört eller läkning har uppnåtts. |
|
Mer omfattande hemartros, muskelblödning eller hematom. |
30 – 60 |
Upprepa injektionen var 12‑24 timme (8‑24 timme för patienter yngre än 6 år) i 3‑4 dagar eller längre tills smärtlindring och den akuta rörelsebegränsningen hävts. |
| Livshotande blödningar. | 60 ‑ 100 | Upprepa injektionen var 8‑24 timme (6‑12 timme för patienter yngre än 6 år) tills det kritiska tillståndet är övervunnet. |
|
Kirurgi |
||
|
Mindre Inklusive tandutdragning. |
30 ‑ 60 |
Var 24 timme (12‑24 timme för patienter yngre än 6 år) under minst 1 dag, tills läkning uppnåtts. |
| Större |
80 ‑ 100 (pre‑ och postoperativt) |
Upprepa injektionen var 8‑24 timme (6‑24 timme för patienter yngre än 6 år) tills sårläkning inträtt, fortsätt därefter behandlingen i ytterligare minst 7 dagar för att upprätthålla en faktor VIII‑aktivitet på 30 ‑ 60 % (IE/dl). |