Pakkausseloste
REVOLADE filmdragerad tablett 25 mg, 50 mg, 75 mg
Tilläggsinformation
Revolade 12,5 mg filmdragerade tabletter
Revolade 25 mg filmdragerade tabletter
Revolade 50 mg filmdragerade tabletter
Revolade 75 mg filmdragerade tabletter
eltrombopag
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar ta detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
Informationen i denna bipacksedel är till dig eller ditt barn – men i bipacksedeln står det endast ”du”.
I denna bipacksedel finns information om följande
1. Vad Revolade är och vad det används för
2. Vad du behöver veta innan du tar Revolade
3. Hur du tar Revolade
4. Eventuella biverkningar
5. Hur Revolade ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Revolade innehåller eltrombopag, som tillhör en grupp läkemedel som kallas för trombopoetinreceptoragonister. Det används för att öka antalet blodplättar i ditt blod. Blodplättar är blodkroppar som bidrar till att minska eller förhindra blödning.
- Revolade används för att behandla en blödningsrubbning som kallas för immunologisk (primär) trombocytopeni (ITP) hos patienter från 1 års ålder som redan tagit andra läkemedel (kortikosteroider eller immunglobuliner) som inte har fungerat.
ITP orsakas av ett lågt antal blodplättar (trombocytopeni). Personer med ITP har en ökad blödningsrisk. Symtom som patienter med ITP kan märka omfattar petekier (nålspetsstora, platta, runda, röda märken under huden), blåmärken, näsblod, blödande tandkött och blödningar som inte stoppar om de skär sig eller skadar sig. - Revolade kan också användas för att behandla lågt antal blodplättar (trombocytopeni) hos vuxna med hepatit C-virus (HCV) infektion om de haft problem med biverkningar av interferonbehandling. Många med hepatit C kan ha lågt antal blodplättar, inte bara som en följd av sjukdomen utan också på grund av vissa av de antivirala läkemedel som används för att behandla den. Genom att ta Revolade kan det bli lättare att fullfölja en hel kur med antiviralt läkemedel (peginterferon och ribavirin).
- Revolade kan också användas för att behandla vuxna patienter med lågt antal blodkroppar som orsakats av svår aplastisk anemi (SAA). SAA är en sjukdom där benmärgen är skadad, vilket orsakar brist på röda blodkroppar (anemi), vita blodkroppar (leukopeni) och blodplättar (trombocytopeni).
Vad du behöver veta innan produkten används
Ta inte Revolade
om du är allergisk mot eltrombopag eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar under ”Innehållsdeklaration” ).
→ Kontrollera med din läkare om du tror att detta stämmer in på dig.
Varningar och försiktighet
Tala med läkare innan du tar Revolade:
- om du har leverproblem. Om man har lågt antal blodplättar och samtidigt en framskriden kronisk (långvarig) leversjukdom är risken större för biverkningar, även livshotande leverskador och blodproppar. Om läkaren anser att fördelarna med att ta Revolade överväger riskerna kommer du att följas upp noggrant under behandlingen.
- om det finns risk för att du får blodpropp i dina vener eller artärer eller om du vet att det är vanligt med blodpropp i din familj.
Du kan ha högre risk för blodproppar:- när du blir äldre
- om du har behövt ligga till sängs en längre tid
- om du har cancer
- om du tar p-piller eller hormonersättningsterapi
- om du nyligen har opererats eller skadat dig fysiskt
- om du är mycket överviktig
- om du röker
- om du har en avancerad kronisk leversjukdom.
→ Om något av detta gäller dig, tala om det för din läkare innan behandlingen börjar. Du ska inte ta Revolade såvida inte läkaren anser att de förväntade fördelarna uppväger risken för blodpropp.
- om du har katarakt (grumling av ögats lins)
- om du har någon annan blodsjukdom, såsom myelodysplastiskt syndrom (MDS). Din läkare kommer att göra tester för att kontrollera att du inte har denna blodsjukdom innan du börjar med Revolade. Om du har MDS och tar Revolade kan din MDS förvärras.
→ Tala om för din läkare om något av detta stämmer in på dig.
Ögonundersökningar
Din läkare kommer att rekommendera att du kontrolleras med avseende på katarakt. Om du inte går på rutinundersökningar av ögonen bör din läkare ordna regelbundna undersökningar. Du kan också bli kontrollerad för förekomst av blödningar i och runt näthinnan (det ljuskänsliga skiktet av celler i bakre delen av ögat).
Du behöver ta prov regelbundet
Innan du börjar ta Revolade tar din läkare blodprov för att kontrollera dina blodkroppar, bland annat blodplättarna. Dessa prov upprepas med vissa mellanrum under tiden du tar läkemedlet.
Blodprov för att kontrollera leverfunktionen
Revolade kan göra att dina leverprover visar tecken på leverskador – en ökning av vissa leverenzymer, särskilt bilirubin och alanin-/aspartat-transaminaser. Om du tar interferon-baserade läkemedel tillsammans med Revolade för behandling av lågt antal blodplättar på grund av hepatit C kan vissa leverproblem förvärras.
Du kommer att få lämna blodprov för att kontrollera din leverfunktion innan du börjar ta Revolade och med vissa mellanrum under tiden du tar det. Du kan behöva sluta ta Revolade om mängden av dessa ämnen ökar för mycket eller om du får andra tecken på leverskada.
→ Läs informationen ”Leverproblem” i avsnitt Eventuella biverkningar i denna bipacksedel.
Blodprov för att kontrollera antalet blodplättar
Om du slutar ta Revolade är det troligt att du får ett lågt antal blodplättar igen efter flera dagar. Antalet blodplättar kommer att kontrolleras och läkaren kommer att diskutera lämpliga försiktighetsåtgärder med dig.
Ett mycket högt antal blodplättar kan öka risken för blodproppar. Blodproppar kan emellertid bildas även vid normalt eller till och med lågt antal blodplättar. Läkaren kommer att justera din Revolade-dos så att ditt blodplättsvärde inte blir för högt.
![]() Sök omedelbart medicinsk hjälp om du har något av dessa tecken på blodpropp:
Sök omedelbart medicinsk hjälp om du har något av dessa tecken på blodpropp:
- svullnad, smärta eller ömhet i ett ben
- plötslig andfåddhet, speciellt tillsammans med kraftig smärta i bröstet eller snabb andning
- buksmärta, förstorad buk, blod i avföringen
Kontroll av din benmärg
Hos personer som har problem med benmärgen kan läkemedel som Revolade göra att problemen förvärras. Tecken på benmärgsförändringar kan visa sig som onormala resultat på dina blodprover. Läkaren kan också göra tester för att direkt kontrollera din benmärg under behandlingen med Revolade.
Kontroller för magblödning
Om du tar interferonbaserade behandlingar tillsammans med Revolade kommer du att följas upp för eventuella tecken på blödning i mage eller tarmar när du har slutat ta Revolade.
Hjärtövervakning
Din läkare kan anse det nödvändigt att övervaka ditt hjärta under behandlingen med Revolade och undersöka hjärtat med EKG (elektrokardiogram).
Äldre personer (65 år och äldre)
Det finns begränsade data om användning av Revolade hos patienter i åldern 65 år och äldre. Försiktighet bör iakttas vid användning av Revolade om du är 65 år eller äldre.
Barn och ungdomar
Revolade rekommenderas inte till barn under 1 år som har ITP. Det rekommenderas inte heller till personer under 18 år som har lågt antal blodplättar på grund av hepatit C eller svår aplastisk anemi.
Andra läkemedel och Revolade
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel. Detta inkluderar receptfria sådana och vitaminer.
Vissa vanliga läkemedel samverkar med Revolade – det gäller receptbelagda och receptfria läkemedel och mineraler. Dessa omfattar:
- syraneutraliserande läkemedel för att behandla sur mage, halsbränna eller magsår (se även ” När du ska ta det ” i avsnitt Hur produkten används)
- läkemedel som kallas statiner, för att sänka kolesterolvärdet
- vissa läkemedel för att behandla HIV-infektion som t.ex. lopinavir och/eller ritonavir
- ciklosporin som används vid transplantationer eller immunsjukdomar
- mineraler som t.ex. järn, kalcium, magnesium, aluminium, selen och zink som kan finnas i vitamin- och mineraltillskott (se även ” När du ska ta det ” i avsnitt Hur produkten används)
- läkemedel som t.ex. metotrexat och topotekan, för att behandla cancer
→ Tala om för din läkare om du tar något av dessa. Vissa av dem ska inte tas tillsammans med Revolade. Dosen behöver kanske justeras eller så kan du behöva ändra tidpunkten när du tar dem. Läkaren går igenom de läkemedel du tar och föreslår lämpliga ersättningar om det behövs.
Om du också tar läkemedel som förhindrar blodpropp är risken för blödning större. Din läkare diskuterar det med dig.
Om du tar kortikosteroider, danazol och/eller azatioprin kan du behöva ta lägre doser eller sluta ta dem under tiden du tar Revolade.
Revolade med mat och dryck
Ta inte Revolade tillsammans med mejeriprodukter eller mjölkdrycker eftersom det kalcium som finns i mejeriprodukter påverkar upptaget av medicinen. För mer information se ” När du ska ta det ” i avsnitt Hur produkten används.
Graviditet och amning
Använd inte Revolade om du är gravid såvida inte läkaren speciellt rekommenderar det. Effekten av Revolade under graviditet är inte känd.
- Tala om för din läkare om du är gravid, tror att du kan vara gravid eller planerar att skaffa barn.
- Använd en tillförlitlig preventivmetod när du tar Revolade för att förhindra graviditet.
- Om du blir gravid under behandlingen med Revolade ska du tala om det för din läkare.
Amma inte under tiden du tar Revolade. Det är inte känt om Revolade går över i modersmjölk.
→ Om du ammar eller planerar att amma ska du tala om det för läkaren.
Körförmåga och användning av maskiner
Revolade kan göra dig yr och ge andra biverkningar som kan göra dig mindre uppmärksam.
→ Kör inte bil och använd inte maskiner om du inte är säker på att du är opåverkad.
Revolade innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per tablett, d.v.s. är näst intill “natriumfritt”.
Hur produkten används
Ta alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker. Ändra inte dosen eller dosschemat för hur du tar Revolade om inte din läkare eller apotekspersonal rekommenderar dig att göra det. Medan du tar Revolade kommer du att stå under kontroll av en läkare med specialistkunskaper i behandling av din sjukdom.
Hur mycket du ska ta
För ITP
Vuxna och barn (6–17 år) – den vanliga startdosen för ITP är en 50 mg-tablett Revolade om dagen. Om du är av öst-/sydostasiatiskt ursprung kan du behöva börja med en lägre dos på 25 mg.
Barn (1–5 år) – den vanliga startdosen för ITP är en 25 mg-tablett Revolade om dagen.
För hepatit C
Vuxna – den vanliga startdosen för hepatit C är en 25 mg-tablett Revolade om dagen. Om du är av öst-/sydostasiatiskt ursprung ska du börja med samma dos på 25 mg.
För SAA
Vuxna – den vanliga startdosen för SAA är en 50 mg-tablett Revolade om dagen. Om du är av öst-/sydostasiatiskt ursprung kan du behöva börja med en lägre dos på 25 mg.
Det kan ta 1 till 2 veckor innan Revolade börjar verka. Beroende på hur du reagerar på Revolade kan din läkare rekommendera att din dagliga dos ändras.
Hur du tar tabletterna
Svälj tabletten hel med lite vatten.
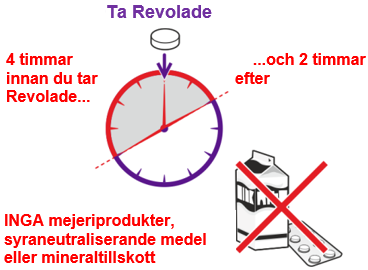
När du ska ta det
Se till att du under
- 4 timmar innan du tar Revolade
- och 2 timmar efter att du tagit Revolade
inte äter eller dricker något av följande:
- mejeriprodukter som t.ex. ost, smör, yoghurt eller glass
- mjölk eller milkshake, drycker som innehåller mjölk, yoghurt eller grädde
- syraneutraliserande medel, en typ av läkemedel mot sur mage och halsbränna
- vissa mineral- och vitamintillskott, t.ex. järn, kalcium, magnesium, aluminium, selen och zink.
Om du gör det tas inte medicinen upp av kroppen på rätt sätt.
Tala med din läkare om du vill ha mer råd om lämplig mat och dryck.
Om du har tagit för stor mängd av Revolade
Kontakta omedelbart läkare eller apotekspersonal. Visa dem förpackningen eller denna bipacksedel om möjligt.
Du kommer att övervakas för eventuella tecken eller symtom på biverkningar och få lämplig behandling omedelbart.
Om du har glömt att ta Revolade
Ta nästa dos vid vanlig tid. Ta inte mer än en dos Revolade på en dag.
Om du slutar att ta Revolade
Sluta inte ta Revolade utan att ha talat med din läkare. Om läkaren råder dig att sluta med behandlingen kommer dina blodplättar att kontrolleras varje vecka i fyra veckor. Se även ” Blödning eller blåmärken efter att du slutat med behandlingen ” i avsnitt Eventuella biverkningar.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Symtom som behöver behandling: uppsök läkare
Personer som tar Revolade för antingen ITP eller låg blodplättsnivå på grund av hepatit C kan få tecken på potentiellt allvarliga biverkningar. Det är viktigt att du berättar för läkare om du utvecklar sådana symtom.
Högre risk för blodproppar
Vissa personer kan ha en högre risk för blodproppar och läkemedel som Revolade kan göra problemet värre. Plötslig blockering av ett blodkärl på grund av en blodpropp är en ovanlig biverkning och kan förekomma hos upp till 1 av 100 personer.
![]() Sök vård omedelbart om du får tecken eller symtom på blodpropp, som t.ex.:
Sök vård omedelbart om du får tecken eller symtom på blodpropp, som t.ex.:
- svullnad, smärta, värme, rodnad eller ömhet i ett ben
- plötslig andfåddhet, speciellt tillsammans med kraftig smärta i bröstet eller snabb andning
- buksmärta, förstorad buk, blod i avföringen.
Leverproblem
Revolade kan orsaka förändringar som visar sig i blodprover och kan vara tecken på leverskada. Leverproblem (förhöjda enzymvärden i blodprover) är vanliga och kan förekomma hos upp till 1 av 10 personer. Andra leverproblem är mindre vanliga och kan förekomma hos upp till 1 av 100 personer.
Om du har något av följande tecken på leverproblem:
- gulfärgning av huden eller ögonvitorna (gulsot)
- ovanligt mörkfärgad urin
→ tala omedelbart om det för din läkare
Blödning eller blåmärken efter att du slutat med behandlingen
Inom två veckor efter att du slutat ta Revolade återgår ditt blodplättsvärde vanligtvis till värdet som var innan du började ta Revolade. Det lägre blodplättsantalet kan öka risken för blödningar och blåmärken. Läkaren kontrollerar ditt blodplättsvärde i minst 4 veckor efter att du slutat ta Revolade.
→ Tala om för läkaren om du får blödningar eller blåmärken när du slutat ta Revolade.
Vissa människor kan få problem med blödningar i matsmältningssystemet när de har slutat ta peginterferon, ribavirin och Revolade. Symtomen är:
- svart tjärliknande avföring (missfärgad avföring är en mindre vanlig biverkning som kan förekomma hos upp till 1 av 100 personer)
- blod i avföringen
- blodkräkning eller kräkning som ser ut som kaffesump.
→ Tala omedelbart om för din läkare om du får något av dessa symtom.
Följande biverkningar har rapporterats vara associerade med behandling med Revolade hos vuxna patienter med ITP:
Mycket vanliga biverkningar
Dessa kan förekomma hos fler än 1 av 10 personer:
- förkylning
- illamående
- diarré
- hosta
- infektion i näsan, bihålorna, halsen och övre luftvägarna (övre luftvägsinfektion)
- ryggsmärta
Mycket vanliga biverkningar som kan dyka upp i blodprov:
- ökning av leverenzym (alaninaminotransferas (ALAT)
Vanliga biverkningar
Dessa kan förekomma hos upp till 1 av 10 personer:
- muskelsmärta, muskelspasm, muskelsvaghet
- skelettsmärta
- kraftig menstruationsblödning eller förlängd menstruation
- ont i halsen och obehag när man sväljer
- ögonproblem bland annat onormalt syntest, torra ögon, ögonsmärta och dimsyn
- kräkningar
- influensa
- munsår
- lunginflammation
- irritation och inflammation (svullnad) i bihålorna
- inflammation (svullnad) och infektion av tonsillerna
- infektion i lungorna, bihålorna, näsan och halsen
- tandköttsinflammation
- aptitlöshet
- stickningar eller domningar i händer eller fötter
- minskad hudkänslighet
- dåsighet
- öronsmärta
- smärta, svullnad och ömhet i ett benen (vanligtvis vaden) med varm hud i det drabbade området (tecken på blodpropp i en djup ven)
- lokal, blodfylld svullnad på grund av ett brustet blodkärl (hematom)
- värmevallningar
- problem i munnen, bland annat muntorrhet eller sår i munnen, känslig tunga, blödande tandkött, munsår
- rinnande näsa
- tandvärk
- buksmärta
- onormal leverfunktion
- hudförändringar, bland annat kraftig svettning, kliande upphöjda utslag, röda fläckar, förändrat utseende
- håravfall
- skumliknande, skummande urin eller urin med synliga bubblor (tecken på protein i urinen)
- feber, värmkänsla
- bröstsmärta
- känna sig svag
- sömnproblem, nedstämdhet
- migrän
- nedsatt syn
- svimningskänsla (yrsel)
- matsmältningsbesvär/gaser
Vanliga biverkningar som kan visa sig i blodprov:
- minskat antal röda blodkroppar (anemi)
- minskat antal blodplättar (trombocytopeni)
- minskat antal vita blodkroppar
- minskad hemoglobinnivå
- ökat antal eosinofiler
- ökat antal vita blodkroppar (leukocytos)
- ökade nivåer av urinsyra
- minskade nivåer av kalium
- ökade nivåer av kreatinin
- ökade halter av alkaliskt fosfatas
- ökning av leverenzymer (aspartataminotransferas (ASAT))
- ökning av bilirubin (ett ämne som produceras i levern) i blodet
- ökade nivåer av vissa proteiner
Mindre vanliga biverkningar
Dessa kan förekomma hos upp till 1 av 100 personer:
- allergisk reaktion
- avbruten blodtillförsel till en del av hjärtat
- plötslig andfåddhet, speciellt vid samtidig kraftig smärta i bröstet och/eller snabb andning, vilket kan vara tecken på blodpropp i lungorna (se ” Högre risk för blodproppar ” tidigare i avsnitt Eventuella biverkningar)
- förlorad funktion i en del av lungan orsakad av en blockering i lungartären
- möjlig smärta, svullnad och/eller rodnad runt en ven, vilket kan vara tecken på blodpropp i en ven
- gulfärgning av huden och/eller buksmärta, vilket kan vara tecken på blockering i gallvägarna, leverskada, leverskada på grund av inflammation (se ” Leverproblem ” tidigare i avsnitt Eventuella biverkningar)
- leverskada på grund av medicinering
- snabba hjärtslag, oregelbunden puls, blå missfärgning av huden, störningar av hjärtrytmen (QT-förlängning) vilket kan vara tecken på störningar relaterade till hjärtat och blodkärlen
- blodpropp
- rodnad
- smärtande, svullna leder som orsakas av urinsyra (gikt)
- bristande intresse, humörförändringar, gråt som är svårt att stoppa, eller sker vid oväntade tidpunkter
- problem med balans, tal- och nervfunktion, darrningar
- smärtsam och onormal hudkänslighet
- förlamning av en sida av kroppen
- migrän med aura
- nervskada
- utvidgning eller svullnad av blodkärl som orsakar huvudvärk
- ögonproblem inklusive ökad produktion av tårar, grumlad lins i ögat (grå starr), blödning i näthinnan, torra ögon
- problem med näsan, halsen och bihålorna, andningsproblem när man sover
- mun- och hals- blåsor/sår
- minskad aptit
- problem med matsmältningssystemet, bland annat: ofta förekommande avföring, matförgiftning, blod i avföringen, kräkning av blod
- blödning från ändtarmen, ändrad färg på avföring, uppblåst mage, förstoppning
- problem i munnen, bland annat muntorrhet eller sår i munnen, tungsmärta, blödande tandkött, obehag i munnen
- solbränna
- känna sig varm, känna sig orolig
- rodnad eller svullnad runt sår
- blödningar i huden runt en kateter (om sådan finns)
- känsla av främmande föremål i kroppen
- njurproblem, bland annat: inflammation i njuren, ökat behov av att urinera på natten, njursvikt, vita blodkroppar i urinen
- kallsvettningar
- generell olustkänsla
- hudinfektion
- hudförändringar inklusive hudmissfärgning, exfoliering (peeling), rodnad, klåda och svettning
- muskelsvaghet
- cancer i ändtarm och tjocktarm
Mindre vanliga biverkningar som kan visa sig i laboratorietester:
- förändringar i form av röda blodkroppar
- förekomst av vita blodkroppar under utveckling som kan indikera vissa sjukdomar
- ökat antal blodplättar
- minskade nivåer av kalcium
- minskat antal röda blodkroppar (anemi) orsakad av överdriven destruktion av röda blodkroppar (hemolytisk anemi)
- ökat antal myelocyter
- ökat antal bandneutrofiler
- ökad nivå av blodurea
- ökad nivå av protein i urin
- ökade nivåer av blodalbumin
- ökade nivåer av totalprotein
- minskade nivåer av blodalbumin
- ökat pH-värde i urinen
- ökade nivåer av hemoglobin
Följande ytterligare biverkningar har rapporterats vara associerade med behandling med Revolade hos barn (i åldern 1 till 17 år) med ITP:
Om dessa biverkningar blir svåra, kontakta din läkare, apotekspersonal eller sjuksköterska.
Mycket vanliga biverkningar
Dessa kan förekomma hos fler än 1 av 10 barn
- infektion i näsan, bihålorna, halsen och övre luftvägarna, förkylning (övre luftvägsinfektion)
- diarré
- buksmärta
- hosta
- feber
- illamående
Vanliga biverkningar
Dessa kan förekomma hos upp till 1 av 10 barn
- sömnsvårigheter (sömnlöshet)
- tandvärk
- smärta i näsan och halsen
- kliande, rinnande eller blockerad näsa
- halsont, snuva, nästäppa och nysningar
- munproblem inklusive torr mun, ont i munnen, känslig tunga, blödande tandkött, munsår
Följande biverkningar har rapporterats vara associerade med behandling med Revolade i kombination med peginterferon och ribavirin hos patienter med HCV:
Mycket vanliga biverkningar
Dessa kan förekomma hos fler än 1 av 10 personer
- huvudvärk
- aptilöshett
- hosta
- illamående, diarré
- muskelsmärta, muskelsvaghet
- klåda
- känna sig trött
- feber
- ovanligt håravfall
- känna sig svag
- influensaliknande sjukdom
- svullnad i händer eller fötter
- frossa
Mycket vanliga biverkningar som kan visa sig i blodprov:
- minskat antal röda blodkroppar (anemi)
Vanliga biverkningar
Dessa kan förekomma hos upp till 1 av 10 personer
- infektion i urinvägarna
- inflammation i näspassager, hals och mun, influensaliknande symtom, muntorrhet, sår eller inflammerad mun, tandvärk
- viktminskning
- sömnstörningar, onormal sömnighet, depression, ångest
- yrsel, problem med uppmärksamhet och minne, förändring i humör
- minskad hjärnfunktion orsakat av leverskada
- stickningar eller domningar i händer eller fötter
- feber, huvudvärk
- ögonproblem, inklusive grumlig lins i ögat (grå starr), torra ögon, små gula avlagringar i näthinnan, gulfärgning av ögonvita
- blödning i näthinnan
- svimningskänsla (yrsel)
- snabba eller oregelbundna hjärtslag (hjärtklappning), andfåddhet
- hosta som leder till slem, rinnande näsa, influensa, munsår, ont i halsen och obehag vid sväljning
- besvär från magtarmkanalen, inklusive kräkningar, magont, matsmältningsbesvär, förstoppning, svullnad i magen, smakstörningar, hemorrojder, obehag/magsmärta, svullna blodkärl och blödande matstrupe
- tandvärk
- leverproblem, inklusive tumör i levern, gulfärgning av ögonvitor eller huden (gulsot), leverskada på grund av medicinering (se ”Leverproblem” tidigare i avsnitt Eventuella biverkningar)
- hudförändringar, inklusive utslag, torr hud, eksem, hudrodnad, klåda, överdriven svettning, ovanliga hudtillväxter, håravfall
- ledsmärta, ryggsmärta, skelettsmärta, smärta i extremiteter (armar, ben, händer eller fötter), muskelspasmer
- irritabilitet, generellt illamående, hudreaktioner såsom rodnad eller svullnad och smärta vid injektionsstället, bröstsmärta, och obehag, ansamling av vätska i kroppen eller extremiteter som orsakar svullnad
- infektion i näsan, bihålorna, halsen och övre luftvägarna, förkylning (övre luftvägsinfektion), inflammation i slemhinnan i bronkerna
- nedstämdhet, ångest, sömnproblem, nervositet
Vanliga biverkningar som kan visa sig i blodprov:
- ökad nivå blodsocker (glukos)
- minskat antal vita blodkroppar
- minskat antal neutrofiler
- minskad nivå av blodalbumin
- minskad nivå av hemoglobin
- ökning av bilirubin i blodet (ett ämne som produceras i levern)
- förändringar i enzymer som styr blodkoagulering
Mindre vanliga biverkningar
Dessa kan förekomma hos upp till 1 av 10 personer
- smärtsam urinering
- störningar i hjärtrytmen (QT-förlängning)
- maginfluensa (gastroenterit), halsont
- munblåsor/- sår, maginflammation
- hudförändringar inklusive färgförändring, exfoliering (peeling), rodnad, klåda, hudförändring och nattlig svettning
- blodproppar i en ven i levern (eventuell lever- och/ eller matsmältningssystemskada)
- onormal blodproppsbildning i små blodkärl med njursvikt
- utslag, blåmärken på injektionsstället, obehag i bröstet
- minskat antal röda blodkroppar (anemi) orsakad av överdriven destruktion av röda blodkroppar (hemolytisk anemi)
- förvirring, agitation
- leversvikt
Följande biverkningar har rapporterats vara associerade med behandling med Revolade hos patienter med svår aplastisk anemi (SAA):
Om dessa biverkningar blir svåra, kontakta din läkare, apotekspersonal eller sjuksköterska.
Mycket vanliga biverkningar
Dessa kan förekomma hos fler än 1 av 10 personer
- hosta
- huvudvärk
- mun och halssmärta
- diarré
- känna sig sjuk, (illamående)
- ledsmärta (artralgi)
- smärta i extremiteterna (armar, ben, händer och fötter)
- yrsel
- känsla av väldig trötthet
- feber
- frossa
- kliande ögon
- blåsor i munnen
- buksmärtor
- muskelryckningar
Mycket vanliga biverkningar som kan visa sig i blodprov:
- onormal förändringar i cellerna i benmärgen
- ökning av leverenzym (aspartataminotransferas (ASAT)
Vanliga biverkningar
Dessa kan förekomma hos upp till 1 av 10 personer
- ångest
- depression
- känna sig kall (frysa)
- generellt må dåligt
- ögonproblem, inklusive synproblem, dimsyn, grumlig lins i ögat (grå starr), fläckar eller avsättningar i ögats glaskropp (fläckar i synfältet), torra ögon, kliande ögon, gulfärgning av ögonvitorna eller huden
- näsblod
- blödande tandkött
- matsmältningsproblem, inklusive sväljsvårigheter, munsmärta, svullen tunga, kräkningar, aptitlöshet, magont/obehag, svullnad i magen, gasbildning, förstoppning, störningar av tarmkanalens rörelser som kan orsaka förstoppning, uppblåsthet, diarré och/ eller ovan nämnda symtom, förändring av färg på avföringen
- svimning
- hudproblem inklusive små röda eller lila fläckar som orsakats av blödning i huden (petekier) utslag, klåda, nässelfeber, hudskada
- blödning i tandköttet
- ryggsmärta
- muskelsmärta
- skelettsmärta
- svaghet (asteni)
- svullnad i nedre extremiteter på grund av ackumulering av vätskor
- onormalt färgad urin
- avbrott i blodtillförseln till mjälte (mjältinfarkt)
- rinnande näsa
Vanliga biverkningar som kan visa sig i blodprov:
- ökning av enzymer på grund av muskelnedbrytning (kreatinfosfokinas)
- ackumulering av järn i kroppen (järnöverbelastning)
- minskade blodsockernivåer (hypoglykemi)
- ökning av bilirubin (ett ämne som produceras i levern) i blodet
- minskade nivåer av vita blodkroppar
Biverkningar med okänd frekvens
Frekvensen kan inte beräknas från tillgängliga data
- missfärgning av huden
- mörkare hudton
- leverskada på grund av medicinering
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via det nationella rapporteringssystemet. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och blisterkarta efter EXP.
Inga särskilda förvaringsanvisningar.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen i Revolade är eltrombopag
12,5 mg filmdragerade tabletter
En filmdragerad tablett innehåller eltrombopagolamin motsvarande 12,5 mg eltrombopag.
25 mg filmdragerade tabletter
En filmdragerad tablett innehåller eltrombopagolamin motsvarande 25 mg eltrombopag.
50 mg filmdragerade tabletter
En filmdragerad tablett innehåller eltrombopagolamin motsvarande 50 mg eltrombopag.
75 mg filmdragerade tabletter
En filmdragerad tablett innehåller eltrombopagolamin motsvarande 75 mg eltrombopag.
Övriga innehållsämnen är: hypromellos, makrogol 400, magnesiumstearat, mannitol (E421), mikrokristallin cellulosa, povidon, natriumstärkelseglykolat, titandioxid (E171).
Revolade 12,5 mg och 25 mg filmdragerade tabletter innehåller också polysorbat 80 (E433).
Revolade 50 mg filmdragerade tabletter innehåller också röd järnoxid (E172) och gul järnoxid (E172).
Revolade 75 mg filmdragerade tabletter innehåller också röd järnoxid (E172) och svart järnoxid (E172).
Läkemedlets utseende och förpackningsstorlekar
Revolade 12,5 mg filmdragerade tabletter är runda, bikonvexa, vita, stansade med "GS MZ1" och "12,5" på en sida.
Revolade 25 mg filmdragerade tabletter är runda, bikonvexa, vita, stansade med "GS NX3" och "25" på en sida.
Revolade 50 mg filmdragerade tabletter är runda, bikonvexa, bruna, stansade med "GS UFU" och "50" på en sida.
Revolade 75 mg filmdragerade tabletter är runda, bikonvexa, rosa, stansade med "GS FFS" och "75" på en sida.
De levereras i aluminumblister i en kartong innehållande 14 eller 28 filmdragerade tabletter och multipelförpackning innehållande 84 (3 förpackningar om 28) filmdragerade tabletter.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Irland
Tillverkare
Lek d.d
Verovskova Ulica 57
Ljubljana 1526
Slovenien
Novartis Pharmaceutical Manufacturing LLC
Verovskova Ulica 57
Ljubljana 1000
Slovenien
Novartis Farmacéutica SA
Gran Via de les Corts Catalanes, 764
08013 Barcelona
Spanien
Glaxo Wellcome S.A.
Avenida de Extremadura, 3
09400 Aranda de Duero
Burgos
Spanien
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Nürnberg
Tyskland
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel.
Suomi/Finland
Novartis Finland Oy
Puh/Tel: +358 (0)10 6133 200
Denna bipacksedel ändrades senast 6.11.2025
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats: https://www.ema.europa.eu