Pakkausseloste
PROLASTINA pulver och vätska till infusionsvätska, lösning 1000 mg
Tilläggsinformation
Prolastina 1000 mg pulver och vätska till infusionsvätska, lösning
alfa1-proteinashämmare, human
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Prolastina är och vad det används för
2. Vad du behöver veta innan du använder Prolastina
3. Hur du använder Prolastina
4. Eventuella biverkningar
5. Hur Prolastina ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Prolastina tillhör en läkemedelsklass som kallas proteinashämmare.
Alfa1-proteinashämmare är en substans som bildas i kroppen för att hämma effekten av ämnen som kallas för elastaser och som skadar lungorna. Vid ärftlig brist på alfa1-proteinashämmare finns det en obalans mellan alfa1-proteinashämmare och elastas. Detta kan leda till gradvis nedbrytning av lungvävnad och utvecklande av lungemfysem. Lungemfysem är ett onormalt förstorande av lungorna, med nedbrytning av lungvävnaden. Prolastina används för att återställa balansen mellan alfa1-proteinashämmare och elastas i lungorna, vilket förhindrar ytterligare försämring av lungemfysemet.
Prolastina används vid långtidsbehandling av patienter med vissa former av brist på alfa1-proteinashämmare, vilket avgörs av din läkare.
Alfa1-proteinashämmare, human som finns i Prolastina kan också vara godkänd för att behandla andra
sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apoteks- eller annan hälso- och sjukvårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Använd inte Prolastina
- om du är allergisk (överkänslig) mot den aktiva substansen alfa1-proteinashämmare eller något annat innehållsämne i Prolastina (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har en känd brist på vissa immunoglobuliner (IgA) eftersom svåra allergiska reaktioner och även anafylaktisk chock då kan uppträda.
Varningar och försiktighet
- Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Prolastina.
- Tala med din läkare om du har ett mycket försvagat hjärta (hjärtsvikt). Särskild försiktighet ska iakttas eftersom Prolastina kan leda till en tillfällig ökning av blodvolymen.
Allergiska reaktioner (överkänslighetsreaktion)
I sällsynta fall kan överkänslighetsreaktioner mot Prolastina ske även om du har tålt alfa1-proteinashämmare väl vid tidigare administrering.
Din läkare kommer att informera dig om tecken på allergiska reaktioner och vad du ska göra om de uppstår (se även avsnitt Eventuella biverkningar).
Tala medelbart om för din läkare eller sjuksköterska om du upplever tecken på en svår allergisk reaktion under infusion av detta läkemedel.
Information om säkerhet vad gäller risk för infektioner
När läkemedel framställs av human plasma eller blod vidtas speciella åtgärder för att förhindra att infektioner överförs till patienter. Detta inkluderar:
- noggrant urval av blod- och plasmagivare för att försäkra sig om att personer med risk för att vara smittbärare utesluts, samt
- test av enskilda donationer och plasmapooler för tecken på virus/infektion.
- inkludering av steg i processningen av blod och plasma som kan inaktivera och avskilja virus.
Trots detta kan risken för överföring av infektion inte helt uteslutas när läkemedel som tillverkats av humant blod eller plasma ges. Detta gäller även nya, hittills okända virus samt andra typer av infektioner.
De åtgärder som vidtagits anses vara effektiva mot höljeförsedda virus såsom HIV, hepatit B och hepatit C virus. De kan vara av begränsat värde mot icke höljeförsedda virus såsom hepatit A och parvovirus B19. Infektion av parvovirus B19 kan vara allvarlig för gravida kvinnor (infektion av foster) och för individer med försämrat immunförsvar eller patienter med viss typ av anemi (t.ex. hemolytisk anemi).
Din läkare kan komma att föreslå vaccination mot hepatit A och B om du regelbundet/upprepat behandlas med plasmaderiverade humana proteinashämmare.
Det är mycket viktigt,att produktnamn och satsnummer registreras varje gång du ges Prolastina,för att kunna upprätthålla ett register över de satsnummer av Prolastina du fått.
Rökning
Eftersom effekten av Prolastina påverkas negativt av tobaksrök i lungorna, rekommenderas rökstopp.
Barn och ungdomar
Ingen erfarenhet finns från användning av Prolastina till barn och ungdomar upp till 18 år.
Andra läkemedel och Prolastina
Det finns för närvarande inga kända interaktioner mellan Prolastina och andra läkemedel.
Tala om för läkare eller apotekspersonal om du tar eller nyligen har tagit andra läkemedel, även receptfria sådana.
Graviditet och amning
Rådfråga läkare eller apotekspersonal innan du tar något läkemedel.
Det finns ingen erfarenhet av användning av Prolastina under graviditet. Berätta för din läkare om du är gravid eller planerar att bli gravid.
Det är inte känt om Prolastina passerar över i bröstmjölk. Rådfråga din läkare om du ammar.
Körförmåga och användning av maskiner:
Det finns ingenting som tyder på att Prolastina påverkar förmågan att köra eller att använda maskiner.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Prolastina innehåller natrium
Prolastina 1000 mg innehåller cirka 110,4 mg natrium (huvudingrediensen i koksalt/bordssalt). Om patienten väger 75 kg, motsvarar den rekommenderade dosen 24,84 % av högsta rekommenderat dagligt intag av natrium för vuxna. Tala med din läkare eller apotekspersonalen om du har ordinerats att följa en saltfattig kost.
Hur produkten används
Efter beredning med den medföljande flaskan med lösningsmedel, ges Prolastina som infusion i en ven. En läkare med erfarenhet av behandling av patienter med kroniska obstruktiva lungsjukdomar kommer att övervaka de första infusionerna med Prolastina.
Behandling i hemmet
Efter de första infusionerna kan även annan sjukvårdspersonal geProlastina, men endast först efter att ha fått tillräcklig träning. Din behandlande läkare avgör om du är lämplig för behandling i hemmet och kommer att se till att sjukvårdspersonalen får instruktioner om:
- hur man bereder och ger den färdiga infusionsvätskan (se de illustrerade instruktionerna i slutet av denna bipacksedel).
- hur man håller läkemedlet sterilt (aseptiska infusionstekniker).
- hur man för en behandlingsdagbok.
- hur man identifierar biverkningar, inklusive tecken på allergiska reaktioner, och åtgärder som ska vidtas om sådana biverkningar uppstår (se även avsnitt Vad du behöver veta innan produkten används och avsnitt Eventuella biverkningar)
Dosering
Mängden Prolastina du får baseras på din kroppsvikt.En dos i veckan om 60 mg aktiv substans per kg kroppsvikt (motsvarar, i det fall patienten väger 75 kg, 180 ml av färdigberedd infusionsvätska innehållande 25 mg/ml human alfa1-proteinashämmare) är vanligtvis tillräckligt för att bibehålla skyddande nivåer av human alfa1-proteinashämmare i serum, som förebygger fortsatt försämring av lungemfysem.
Den behandlingsansvarige läkaren bestämmer behandlingstidens längd. Det finns idag inga tecken på att behandlingstidens längd behöver begränsas.
Om du tycker att effekten av Prolastina är för stark eller för svag, tala med din läkare eller apotekspersonalen.
Om du har använt för stor mängd av Prolastina
Hittills finns inga kända följder av överdosering.
- Tala med din läkare eller din sjukvårdspersonal. om du tror att du fått mer Prolastina än du borde. Han eller hon kommer att vidta lämpliga åtgärder.
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112 i Sverige, 0800 147 111 i Finland) för bedömning av risken samt rådgivning.
Om du har glömt att använda Prolastina
- Tala med din läkare, som bestämmer om du ska ges den missade dosen.
- Ta inte dubbel dos för att kompensera för glömd infusion.
Om du slutar att använda Prolastina
Om behandling med Prolastina stoppas, kan ditt tillstånd förvärras. Tala med läkaren som har hand om din behandling om du vill att behandlingen med Prolastina ska avbrytas i förtid.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan Prolastina orsaka biverkningar men alla användare behöver inte få dem.
Om biverkningar uppstår under infusion med Prolastina, skall infusionen avbrytas tillfälligt eller stoppas helt beroende på typen av biverkan och hur allvarlig den är.
Eventuella allvarliga biverkningar
I sällsynta fall (kan förekomma hos upp till 1 av 1 000 användare) kan överkänslighetsreaktioner förekomma, i vissa mycket sällsynta fall (kan förekomma hos upp till 1 av 10 000 användare) kan dessa reaktioner förekomma som allergiska reaktioner av något slag, även om du inte upplevt några tecken på allergi vid tidigare infusioner.
Tala omedelbart om för din läkare eller sjuksköterska, om du märker något av följande tecken:
- utslag, nässelutslag, klåda,
- sväljsvårigheter,
- svullnad av ansikte eller mun,
- rodnad,
- andningssvårigheter (dyspné),
- blodtrycksfall,
- förändring av hjärtfrekvens,
- frossa.
Din läkare eller sjukvårdspersonal kan besluta om att bromsa eller avbryta infusionen helt och inleda lämplig nödvändig behandling.
Vid behandling i hemmet ska infusionen omedelbart avbrytas och läkare eller sjukvårdspersonal kontaktas.
Följande biverkningar har observerats vid behandling med Prolastina:
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare):
- frossa, feber, influensaliknande symptom, bröstsmärta
- nässelutslag (urtikaria)
- yrsel, svimningskänsla, huvudvärk
- andningssvårighet (dyspné)
- utslag
- illamående
- ledsmärta (artralagi)
Sällsynta (kan förekomma hos upp till 1 av 1 000 användare):
- överkänslighetsreaktioner
- snabb puls (takykardi)
- lågt blodtryck (hypotension)
- högt blodtryck (hypertension)
- ryggsmärta
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 användare):
- allergisk chock
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Finland
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Sverige
Läkemedelsverket
Box 26
751 03 Uppsala
Hur produkten ska förvaras
Förvaras vid högst 25 ºC. Får ej frysas.
Den färdigberedda lösningen ska inte förvaras i kylskåp och ska alltid användas inom tre timmar efter beredning. Ej använt läkemedel ska kasseras. Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på flasketiketten och kartongen. Utgångsdatum är den sista dagen i angiven månad.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är alfa1-proteinashämmare, human (utvunnen ur humant blod eller plasma).
- Övriga innehållsämnen är natriumklorid, natriumdivätefosfat, vatten för injektionsvätskor (lösningsmedel).
Läkemedlets utseende och förpackningsstorlekar
Alfa1-proteinashämmare är ett vitt, svagt gult eller svagt brunt pulver eller spröd massa.
Efter beredning med vattnet för injektionsvätskor, ska lösningen vara klar till lätt opaliserande,
färglös, svagt grön, svagt gul eller svagt brun, samt fri från synliga partiklar.
1 ml av den färdigberedda lösningen innehåller 25 mg alfa1-proteinashämmare.
En enkelförpackning innehåller:
Prolastina 1000 mg pulver och vätska till infusionsvätska, lösning:
- 1 injektionsflaska med pulver som innehåller 1000 mg alfa1-proteinashämmare, human
- 1 injektionsflaska med 40 ml vätska (vatten för injektionsvätskor).
- 1 överföringsset för beredning.
Prolastina multiförpackning innehåller:
- 4 enkla Prolastinakartonger med 1000 mg
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning
Grifols Deutschland GmbH
Colmarer Straße 22
60528 Frankfurt Tyskland
Tel: +49 69/660 593 100
Epost: info.germany@grifols.com
Tillverkare
Instituto Grifols, S.A.
Can Guasc, 2 – Parets del Vallès
08150 Barcelona
Spanien
Ytterligare information ges av det lokala ombudet för innehavaren av godkännande för försäljning:
Grifols Nordic AB
113 46 Stockholm
Sverige
Tel.: +46 8 441 89 50
Epost: infonordic@grifols.com
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnen:
Prolastin 1000 mg Irland, Frankrike, Tyskland
Prolastin Österrike, Italien, Grekland, Polen, Portugal, Nederländerna
Prolastina Danmark, Finland, Norge, Spanien, Sverige
Pulmolast 1000 mg Belgien
Denna bipacksedel ändrades senast 2024-05-20 (SE), 15.07.2024 (FI)
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Fimeas webbplats http//www.fimea.fi.
Ytterligare information om detta läkemedel finns på Läkemedelsverkets webbplats http://www.lakemedelsverket.se.
Information för hälso- och sjukvårdspersonal och för patienter som är lämpliga för behandling i hemmet:
Anvisningar för beredning av färdig infusionsvätska, lösning.
1. Använd aseptisk (ren och desinficerad) teknik för att säkerställa fortsatt sterilitet. Beredningen av lösningen görs på en plan arbetsyta.
2. Säkerställ att injektionsflaskor med Prolastina (pulver) och lösningsmedel (sterilt vatten för injektion) har uppnått rumstemperatur (20-25ºC).
3. Ta bort skyddshylsan både från injektionsflaskan med Prolastina och injektionsflaskan med lösningsmedlet och rengör injektionsflaskornas översta kanter och proppar med en alkoholindränkt tuss. Låt gummipropparna torka.
4. Öppna den sterila förpackningen med överföringssetet genom att helt dra av locket. Ta inte ut överföringssetet ur förpackningen.
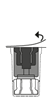
| 5. Placera injektionsflaskan med vätskan upprätt på ett plant underlag och håll den i ett stadigt grepp. Utan att ta bort den yttre förpackningen, tryck den blå delen av överföringssetet rakt ned tills spetsen tränger igenom proppen och fastnar. Undvik att vrida.
| 6. Ta bort den yttre genomskinliga förpackningen från överföringssetet och kassera den.
|
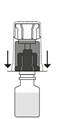
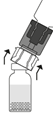
7. Placera injektionsflaskan med Prolastina pulver upprätt på arbetsytan. Vänd enheten med överföringssetet och lösningsmedelsflaskan upp och ned 180°. Tryck den genomskinliga/vita delen av överföringssetet rakt ner – utan att vrida – tills spetsen tränger igenom proppen och fastnar.
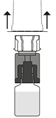
| 8. Vakuumet i injektionsflaskan med Prolastina pulvret gör att lösningsmedlet överförs automatiskt. Vänta tills lösningsmedlet helt har förts över. Dra bort överföringssetet med den sammankopplade lösningsmedelsflaskan, genom att vinkla det i 45°.
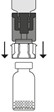
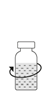
| 9. Snurra försiktigt flaskan med Prolastina pulver tills allt pulver är fullständigt upplöst. Skaka inte för att undvika skumbildning. Rör inte gummiproppen. Administrera preparatet med aseptisk teknik.
|
10. Om mer än en injektionsflaska kommer att behövas för att uppnå önskad dos, upprepa instruktionerna ovan med ytterligare en förpackning innehållande ett nytt överföringsset. Återanvänd inte överföringssetet.
Pulvret bör vara fullständigt upplöst inom ca 5 minuter för Prolastina 1000 mg..
Endast klara till svagt opaliserande lösninga, färglösa, svagt gröna, svagt gula eller svagt bruna och utan synbara partiklar ska användas. Prolastina ska inte blandas med andra infusionslösningar. Den färdigberedda lösningen ska alltid användas inom 3 timmar efter beredning.
Den färdiga lösningen ska administreras genom långsam intravenös infusion med hjälp av ett passande infusions set (ej inkluderat). Infusionshastigheten ska inte överstiga 0,08 ml per kg kroppsvikt (motsvarar 6 ml hos en patient som väger 75 kg) per minut.