Pakkausseloste
PERGOVERIS injektionsvätska, lösning i förfylld injektionspenna (450 IU+225 IU)/0,72 ml
Tilläggsinformation
Pergoveris (450 IE + 225 IE)/0,72 ml injektionsvätska, lösning i förfylld injektionspenna
follitropin alfa/lutropin alfa
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Pergoveris är och vad det används för
2. Vad du behöver veta innan du använder Pergoveris
3. Hur du använder Pergoveris
4. Eventuella biverkningar
5. Hur Pergoveris ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Vad Pergoveris är
Pergoveris injektionsvätska innehåller två olika aktiva substanser kallade ”follitropin alfa” och ”lutropin alfa”. Båda tillhör en familj av hormoner som kallas gonadotropiner, vilka är involverade i fortplantningen och fertiliteten.
Vad Pergoveris används för
Detta läkemedel används för att stimulera utvecklandet av folliklarna (var och en innehåller ett ägg) i dina äggstockar (ovarier). Detta för att hjälpa dig att bli gravid. Det ska användas av vuxna kvinnor (18 år eller äldre) som har låga halter (allvarlig brist) av ”follikelstimulerande hormon” (FSH) och ”luteiniserande hormon” (LH). Dessa kvinnor är vanligtvis infertila.
Hur Pergoveris fungerar
De aktiva substanserna i Pergoveris är kopior av de naturliga hormonen FSH och LH. I din kropp:
- stimulerar FSH äggproduktion
- stimulerar LH frisättningen av ägg.
Genom att ersätta de hormoner som saknas, gör Pergoveris det möjligt för kvinnor med låga halter av FSH och LH att utveckla en follikel. Denna kommer sedan att frisätta ett ägg efter en injektion med hormonet ”humant koriongonadotropin (hCG)”. Detta hjälper kvinnan att bli gravid.
Vad du behöver veta innan produkten används
Innan behandlingen påbörjas ska din och din partners fruktsamhet utvärderas av en läkare med erfarenhet av att behandla fertilitetsstörningar.
Använd inte Pergoveris
- om du är allergisk mot follikelstimulerande hormon (FSH), luteiniserande hormon (LH) eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- om du har en hjärntumör (i din hypotalamus eller hypofysen)
- om du har stora äggstockar eller vätskefyllda blåsor i äggstockarna (äggstockscystor) av okänt ursprung
om du har oförklarlig vaginal blödning
om du har äggstocks‑, livmoder- eller bröstcancer
om du har ett tillstånd som skulle göra en normal graviditet omöjlig, såsom menopaus eller missbildade könsorgan eller benigna tumörer i livmodern.
Använd inte detta läkemedel om något av ovanstående gäller dig. Om du är osäker, tala med läkare, apotekspersonal eller sjuksköterska innan du tar detta läkemedel.
Varningar och försiktighet
Tala med läkare, apotekspersonal eller sjuksköterska innan du använder Pergoveris.
Porfyri
Tala med läkare innan du påbörjar behandling om du eller någon i din familj har porfyri (en oförmåga att bryta ned porfyriner som kan överföras från föräldrar till barn).
Tala omedelbart om för din läkare om:
- din hud blir skör och lätt får blåsor, särskilt hud som ofta har utsatts för sol
- om du får ont i mage, armar eller ben.
Vid ovanstående händelser kan din läkare rekommendera att du slutar med behandlingen.
Ovariellt hyperstimuleringssyndrom (OHSS)
Detta läkemedel stimulerar äggstockarna. Detta ökar risken att utveckla ovariellt hyperstimuleringssyndrom (OHSS). Detta är när dina folliklar utvecklas för mycket och blir stora cystor. Om du får smärtor i nedre delen av buken, snabbt ökar i vikt, mår illa eller kräks eller om du får svårt att andas, ska du genast tala med läkare. Läkaren kanske ber dig att sluta använda detta läkemedel (se avsnitt Eventuella biverkningar, under ”De mest allvarliga biverkningarna”).
Om du inte har ägglossning och om den rekommenderade dosen och administreringsschemat följs, är uppkomsten av OHSS mindre trolig. Behandling med Pergoveris orsakar sällan svår OHSS. Detta blir mer troligt om medicinen som används för slutgiltig follikelmognad (innehållande humant koriongonadotropin, hCG) ges (se avsnitt Hur produkten används, under ”Hur mycket ska man använda” för information). Om du utvecklar OHSS kanske din läkare inte ger dig något hCG under denna behandlingscykel och du kanske blir tillsagd att inte ha samlag eller att använda barriärpreventivmedel i minst fyra dagar.
Din läkare kommer att se till att det ovariella svaret kontrolleras noggrant med hjälp av ultraljud och blodprov (estradiolmätningar) före och under behandlingen.
Flerbördsgraviditet
När du använder Pergoveris finns det större risk för att du blir gravid med fler än ett barn samtidigt (”flerbördsgraviditet”, oftast tvillingar) än om du blir gravid på naturligt sätt. Flerbördsgraviditet kan medföra medicinska komplikationer för dig och dina barn. Du kan minska risken för flerbördsgraviditet genom att använda rätt dos av Pergoveris vid rätt tidpunkter.
För att minimera risken för flerbördsgraviditeter, rekommenderas ultraljudsundersökning såväl som blodprover.
Missfall
När dina äggstockar stimuleras att producera ägg, löper du större risk att få missfall än den genomsnittliga kvinnan.
Ektopisk graviditet
För kvinnor som har eller har haft blockerad eller skadad äggledare finns risk för graviditet där embryot fäster utanför livmodern (utomkvedshavandeskap). Detta oavsett om graviditeten kommit till stånd genom spontan befruktning eller genom fertilitetsbehandling.
Problem med blodproppar (tromboemboliska händelser)
Tala med läkare innan du använder Pergoveris om du eller en familjemedlem någonsin har haft blodproppar i benen eller i lungorna, eller en hjärtinfarkt eller stroke. Du kan ha ökad risk för att allvarliga blodproppar uppstår eller existerande blodproppar förvärras vid behandling med Pergoveris.
Tumörer på könsorganen
Det har förekommit rapporter om tumörer, både godartade och elakartade, i äggstockarna och andra reproduktionsorgan, hos kvinnor som har genomgått flera kurer av fertilitetsbehandlingar.
Allergiska reaktioner
Det har förekommit enstaka rapporter om icke allvarliga allergiska reaktioner mot Pergoveris. Berätta för din läkare om du har haft denna typ av reaktioner mot ett liknande läkemedel innan du använder Pergoveris.
Barn och ungdomar
Pergoveris ska inte användas till barn eller ungdomar under 18 år.
Andra läkemedel och Pergoveris
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Pergoveris ska inte användas med andra läkemedel i samma injektionsspruta. Du kan använda Pergoveris samtidigt med ett godkänt preparat innehållande follitropin alfa som separata injektioner, om din läkare ordinerat det.
Graviditet och amning
Använd inte Pergoveris om du är gravid eller ammar.
Körförmåga och användning av maskiner
Detta läkemedel förväntas inte påverka din förmåga att köra, cykla eller använda verktyg och maskiner.
Pergoveris innehåller natrium
Pergoveris innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Hur produkten används
Använd alltid detta läkemedel enligt läkarens eller apotekspersonalens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
Användning av detta läkemedel
- Pergoveris är avsett att ges genom injektion precis under huden (subkutant). Välj ett nytt injektionsställe varje dag för att minimera hudirritation.
- Din läkare eller sjuksköterska kommer att visa dig hur du använder Pergoveris förfylld injektionspenna för att injicera läkemedlet.
Om de anser att du kan administrera Pergoveris på ett tryggt sätt kan du sedan bereda och injicera läkemedlet själv hemma.
- Om du själv injicerar Pergoveris, läs noga igenom och följ ”Bruksanvisning”.
Hur mycket du ska använda
Behandlingen inleds med den rekommenderade dosen av Pergoveris innehållande 150 internationella enheter (IE) follitropin alfa och 75 IE lutropin alfa varje dag.
- Beroende på hur du svarar på behandlingen kan din läkare bestämma sig för att varje dag lägga till en dos av ett godkänt preparat innehållande follitropin alfa till din Pergoveris injektion. I det fallet ökar man vanligtvis dosen av follitropin alfa var 7:e eller var 14:e dag med 37,5 till 75 IE.
- Behandlingen fortsätter tills du får önskat svar. Det är när du har utvecklat en lämplig follikel enligt bedömning med ultraljudsskanning och blodprover.
- Detta kan ta upp emot 5 veckor.
När du fått önskat svar, kommer du att få en injektion av humant koriongonadotropin (hCG) 24 till 48 timmar efter dina sista Pergoveris injektioner. Den bästa tiden att ha samlag är samma dag som hCG‑injektionen och dagen efter. Alternativt kan intrauterin insemination eller någon annan medicinskt assisterad reproduktionsteknologi utföras baserat på läkarens bedömning.
Om din kropp svarar för kraftigt, avbryts din behandling och du får inte något hCG (se avsnitt Vad du behöver veta innan produkten används, under ”Ovariellt hyperstimuleringssyndrom (OHSS)”). I det fallet kommer din läkare att ge dig en lägre dos av follitropin alfa under påföljande cykel.
Om du använt för stor mängd av Pergoveris
Effekterna av en överdos av Pergoveris är okända, men det är möjligt att OHSS inträffar. Detta inträffar dock endast om hCG administrerats (se avsnitt Vad du behöver veta innan produkten används, under ”Ovariellt hyperstimuleringssyndrom (OHSS)”).
Om du har glömt att använda Pergoveris
Använd inte dubbel dos för att kompensera för glömd dos. Kontakta din läkare.
Om du har ytterligare frågor om detta läkemedel kontakta läkare, apotekspersonal eller sjuksköterska.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
De mest allvarliga biverkningarna
Ta omedelbart kontakt med din läkare om du får någon av biverkningarna som listas nedan. Läkaren kan komma att be dig att sluta använda Pergoveris.
Allergiska reaktioner
Allergiska reaktioner som hudutslag, hudrodnad, nässelfeber, svullnad i ansiktet med andningssvårigheter kan ibland vara allvarliga. Denna biverkan är mycket sällsynt.
Ovariellt hyperstimuleringssyndrom (OHSS)
- Smärta i nedre delen av buken tillsammans med illamående eller kräkningar. Dessa är symtom på ovariellt hyperstimuleringssyndrom (OHSS). Detta kan tyda på att äggstockarna överreagerar på behandlingen och att stora äggstockscystor utvecklats (se avsnitt Vad du behöver veta innan produkten används, under ”Ovariellt hyperstimuleringssyndrom (OHSS)”). Denna biverkning är vanlig. Om detta sker kommer din läkare att behöva undersöka dig så snart som möjligt.
- OHSS kan bli svårartad med tydligt förstorade äggstockar, minskad urinproduktion, viktökning, andningssvårigheter och/eller eventuell vätskeansamling i bukhåla eller bröstkorg. Denna biverkning är mindre vanlig (kan förekomma hos upp till 1 av 100 användare).
- Komplikationer av OHSS, såsom vridning av äggstockarna eller blodproppar, kan uppstå i sällsynta fall (kan förekomma hos upp till 1 av 1 000 användare).
- Allvarliga blodproppskomplikationer (tromboemboliska händelser) med svårartad OHSS kan förekomma i mycket sällsynta fall. Detta kan orsaka smärtor i bröstkorgen, andfåddhet, stroke eller hjärtinfarkt. I sällsynta fall kan detta även ske oberoende av OHSS (se avsnitt Vad du behöver veta innan produkten används, under ”Problem med blodproppar (tromboemboliska händelser)”).
Andra biverkningar inkluderar
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
- vätskefyllda blåsor i äggstockarna (ovariella cystor)
- huvudvärk
- lokala reaktioner på injektionsstället såsom smärta, klåda, blåmärken, svullnad eller irritation.
Vanliga (kan förekomma hos upp till 1 av 10 användare)
- diarré
- bröstsmärtor
- illamående eller kräkning
- buk- och bäckensmärtor
- kramper i buken och väderspänning
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 användare)
- Din astma kan förvärras.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
FI‐00034 Fimea
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på etiketten och kartongen efter Utg.dat eller EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C‑8 °C). Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
När förpackningen har öppnats kan den förfyllda injektionspennan förvaras i maximalt 28 dagar utanför kylskåp (vid 25 °C). Använd inte läkemedel som är kvar i den förfyllda injektionspennan efter 28 dagar.
Använd inte Pergoveris om du ser tecken på försämrad produkt, om vätskan innehåller partiklar eller inte är klar.
Kasta den använda nålen på ett säkert sätt efter injektionen.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
De aktiva substanserna är follitropin alfa och lutropin alfa.
- 1 Pergoveris (450 IE + 225 IE)/0,72 ml förfylld injektionspenna innehåller 450 IE (internationella enheter) follitropin alfa och 225 IE lutropin alfa i 0,72 ml och kan avge tre doser Pergoveris 150 IE/75 IE.
Övriga innehållsämnen är:
- Sackaros, argininmonohydroklorid, poloxamer 188, metionin, fenol, dinatriumfosfatdihydtrat, natriumdivätefosfatmonohydrat och vatten för injektionsvätskor. Mycket små mängder av koncentrerad fosforsyra och natriumhydroxid tillsätts för att hålla surhetsgraden (pH‑värdet) normal.
Läkemedlets utseende och förpackningsstorlekar
Pergoveris tillhandahålls som en klar, färglös till svagt gul injektionsvätska, lösning, i en förfylld flerdos injektionspenna:
- Pergoveris (450 IE + 225 IE)/0,72 ml tillhandahålls i förpackningar med 1 förfylld flerdos injektionspenna och 7 injektionsnålar för engångsbruk.
Innehavare av godkännande för försäljning
Merck Europe B.V., Gustav Mahlerplein 102, 1082 MA Amsterdam, Nederländerna
Tillverkare
Merck Serono S.p.A, Via delle Magnolie 15 (Zona industriale), 70026 Modugno (Bari), Italien
Denna bipacksedel ändrades senast 06-2025.
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.
Direktiv för användaren
Pergoveris
(300 IE + 150 IE)/0,48 ml (450 IE + 225 IE)/0,72 ml (900 IE + 450 ml)/1,44 ml
Injektionsvätska, lösning i förfylld injektionspenna
follitropin alfa/lutropin alfa
Viktig information om Pergoveris förfylld injektionspenna
(300 IE + 150 IE)/0,48 ml |
|
(450 IE + 225 IE)/0,72 ml |
|
(900 IE + 450 IE)/1,44 ml |
|
OBS!
- Den högsta dos du kan ställa in för varianten (300 IE + 150 IE)/0,48 ml är 300 IE.
- Den högsta dos du kan ställa in för både variant (450 IE + 225 IE)/0,72 ml och variant (900 IE + 450 IE)/1,44 ml är 450 IE.
- Dosinställningsknappen vrids i steg om 12,5 IE till önskad dos.
Se bipacksedeln för mer information om den rekommenderade dosen och använd alltid den dos som hälso- och sjukvårdspersonalen har rekommenderat.
a. Ställa in den ordinerade dosen (figur 1). |
|
| b. Kontrollera att injektion är slutförd (figur 2). |
|
| c. Eller läsa av den dos som återstår att injicera med en annan injektionspenna (figur 3). |
|
• Ta bort nålen från injektionspennan omedelbart efter varje injektion.
Återanvänd inte nålar.
Dela inte injektionspennan och/eller nålarna med någon annan.
Använd inte Pergiveris förfylld injektionspenna om den har tappats eller om injektionspennan är sprucken eller skadad eftersom detta kan orsaka skada.
Hur du använder behandlingsdagboken till Pergoveris förfylld injektionspenna
I slutet av bruksanvisningen finns en behandlingsdagbok. Använd behandlingsdagboken för att anteckna den mängd du har injicerat.
Om du injicerar fel mängd läkemedel kan det påverka din behandling.
- Anteckna behandlingsdagens nummer (kolumn 1), datum (kolumn 2), tid för injektionen (kolumn 3) och volymen i injektionspennan (kolumn 4).
- Anteckna den ordinerade dosen (kolumn 5).
- Kontrollera att du har ställt in rätt dos innan du injicerar (kolumn 6).
- Läs av den siffra som visas i doseringsfönstret efter injektionen.
- Bekräfta att du fått en fullständig injektion (kolumn 7) eller anteckna den siffra som visas i doseringsfönstret om den inte är ”0” (kolumn 8).
- Om det behövs, ger du dig själv en injektion med en ny injektionspenna genom att ställa in den återstående dos som du har antecknat i avsnittet ”Mängd som ska ställas in för en andra injektion” (kolumn 8).
- Anteckna denna återstående dos i avsnittet ”Mängd inställd för injektion” (kolumn 6) på nästa rad.
Om du använder behandlingsdagboken för att anteckna daglig(a) injektion(er) kan du varje dag kontrollera att du har fått den fullständiga ordinerade dosen.
Exempel på en behandlingsdagbok för en (450 IE + 225 IE)/0,72 ml injektionspenna:
1 Behandlingsdag Nummer |
2 Datum |
3 Tid |
4 Volym i injektionspennan (300 IE + 150 IE)/0,48 ml (450 IE + 225 IE)/0,72 ml (900 IE + 450 IE)/1,44 ml |
5 Ordinerad dos |
6 7 8 Doseringsfönster |
||
Mängd inställd för injektion |
Mängd som ska ställas in för en andra injektion |
||||||
Nr 1 |
10/06 |
19:00 |
450 IE + 225 IE |
150 IE/ 75 IE |
150 |
slutförd injektion |
null om inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
Nr 2 |
11/06 |
19:00 |
450 IE + 225 IE |
150 IE/ 75 IE |
150 |
slutförd injektion |
null om inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
Nr 3 |
12/06 |
19:00 |
450 IE + 225 IE |
225 IE/ 112,5 IE |
225 |
null om ”0”, slutförd injektion |
Injicera denna mängd 75 med en ny penna |
Nr 3 |
12/06 |
19:00 |
450 IE + 225 IE |
N/A |
75 |
slutförd injektion |
null om inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
Bekanta dig med Pergoveris förfylld injektionspenna
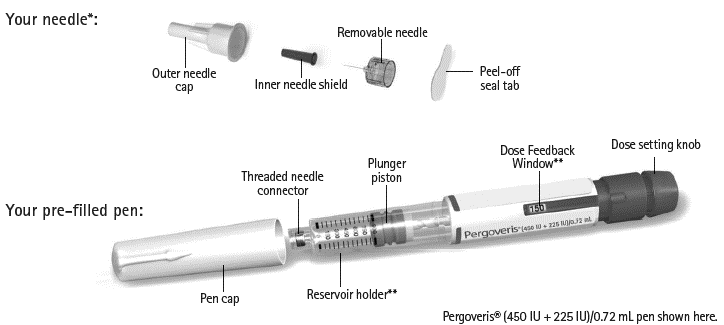
Gängad nålanslutning
Kolv
Doserings- fönster**
Dosinställnings- knapp
Avdragbar förslutning
Avtagbar nål
Inre nålskydd
Yttre nålskydd
Behållare**
Här visas Pergoveris ® (450 IE + 225 IE/0,72 ml injektionspenna
Skydd till injektionspenna
Den förfyllda injektionspennan:
Nålen*:
* Endast för illustrationsändamål. Medföljande nålar kan se lite annorlunda ut.
** Siffrorna i doseringsfönstret och behållaren anger antalet internationella enheter (IE) av läkemedlet.
Steg 1 Samla ihop det du behöver
1.1 Låt den förfyllda injektionspennan ligga i rumstemperatur i minst 30 minuter så att läkemedlet antar rumstemperatur före injektionen. Använd inte mikrovågsugn eller annan uppvärmningsmetod för att värma upp injektionspennan. |
|
1.2. Gör i ordning en ren och plan yta, t.ex. ett bord eller en bänk, på en plats med bra belysning. 1.3 Du behöver också (ingår inte i förpackningen):
1.4 Tvätta händerna med tvål och vatten och torka dem noga (figur 5). |
|
1.5 Använd händerna till att ta ut Pergoveris förfylld injektionspenna ur förpackningen. Använd inte några verktyg, eftersom det kan skada injektionspennan. |
|
1.6 Kontrollera att det står Pergoveris på injektionspennan. |
|
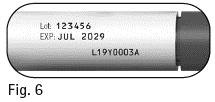
1.7 Kontrollera utgångsdatumet på injektionspennans etikett (figur 6). Använd inte Pergoveris förfylld injektionspenna om utgångsdatumet har passerats eller om det inte står Pergoveris på injektionspennan. |
|
Steg 2 Gör dig redo för injektionen
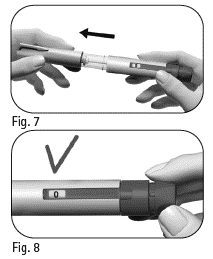
2.1 Dra av skyddet till injektionspennan (figur 7). |
||
2.2 Kontrollera att läkemedlet är klart, färglöst och inte innehåller partiklar. Använd inte den förfyllda injektionspennan om läkemedlet är missfärgat eller grumligt, eftersom detta kan orsaka infektion. 2.3 Kontrollera att ”0” visas i doseringsfönstret (figur 8). |
|
|
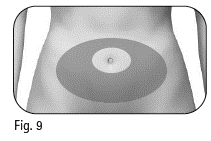
Välja injektionsställe: |
||
2.4 Hälso- och sjukvårdspersonalen ska ha visat dig de injektionsställen som du ska använda på magen (figur 9). Välj ett nytt injektionsställe varje dag för att minimera hudirritationen. 2.5 Tvätta huden vid injektionsstället med en spritsudd. Vidrör inte och täck inte över den rengjorda huden. |
|
|
Steg 3 Ansluta nålen
| Viktigt: Se alltid till att använda en ny nål till varje injektion. Återanvändning av nålar kan orsaka infektion. |
|
||||||
3.1 Ta fram en ny nål – använd bara de medföljande engångsnålarna. |
|||||||
3.2 Kontrollera att det yttre nålskyddet inte är skadat. |
|||||||
3.3 Håll stadigt i det yttre nålskyddet. |
|||||||
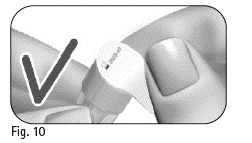
3.4 Kontrollera att den avdragbara förseglingen på det yttre nålskyddet inte är skadad eller sitter löst, och att utgångsdatumet inte har passerats (figur 10). |
|
||||||
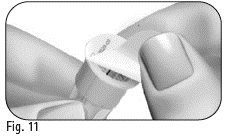
3.5 Ta av den avdragbara förseglingen (figur 11). |
|||||||
Använd inte nålen om den är skadad, utgångsdatumet har passerats eller om det yttre nålskyddet eller den avdragbara förseglingen är skadat/skadad eller sitter löst. Användning av utgångna nålar eller nålar med skadad avdragbar försegling eller skadat yttre nålskydd kan leda till infektion. Kasta den i en behållare för vassa föremål och ta fram en ny nål. |
|||||||
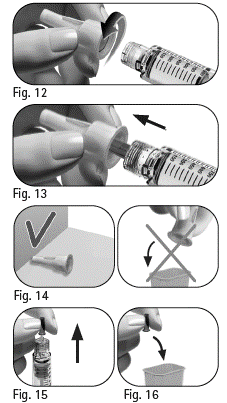
3.6 Skruva fast det yttre nålskyddet på den gängade spetsen på Pergoveris förfyllda injektionspenna tills du känner ett lätt motstånd (figur 12). Dra inte åt nålen för hårt. Nålen kan vara svår att ta bort efter injektionen. |
|||||||
3.7 Ta bort det yttre nålskyddet genom att dra i det försiktigt (figur 13). |
|||||||
3.8 Lägg det åt sidan för senare användning (figur 14). Kasta inte det yttre nålskyddet eftersom det kommer att förhindra nålsticksskada och infektion när nålen tas bort från den förfyllda injektionspennan. |
|||||||
3.9 Håll Pergoveris förfylld injektionspenna med nålen pekande uppåt (figur 15). |
|||||||
3.10 Ta försiktigt bort det inre skyddet och kasta det (figur 16). Sätt inte tillbaka det inre skyddet på nålen eftersom det kan leda till nålsticksskada och infektion. |
|||||||
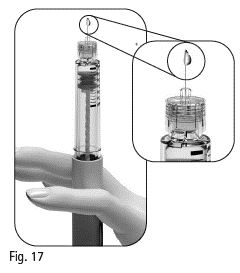
3.11 Titta noga på nålspetsen efter en lite droppe/små droppar vätska (figur 17).
|
|
Om du inte ser en liten droppe/små droppar vid eller nära spetsen första gången du använder en ny injektionspenna:
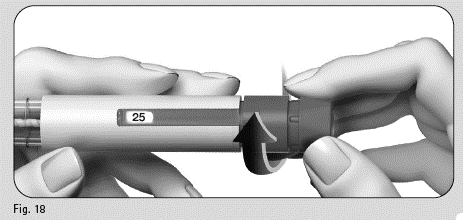
1. Vrid försiktigt dosinställningsknappen framåt tills du ser ”25” i doseringsfönstret (figur 18).
|
||
- Du kan vrida knappen bakåt om du har vridit den förbi ”25”.
2. Håll injektionspennan med nålen pekande uppåt.
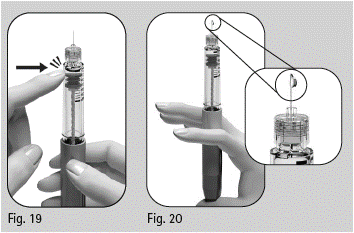
3. Knacka försiktigt på behållaren (figur 19).
4. Tryck in dosinställningsknappen så långt det går. En liten vätskedroppe syns på nålens spets (figur 20).
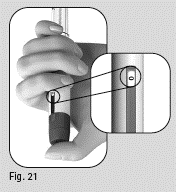
5. Kontrollera att doseringsfönstret visar ”0” (figur 21).
6. Gå vidare till steg 4 Ställa in dosen.
Kontakta hälso- och sjukvårdspersonal om du inte ser en liten droppe vätska.
Steg 4 Ställ in dosen
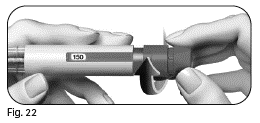
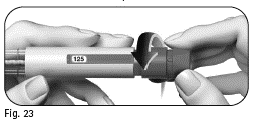
4.1 Vrid dosinställningsknappen tills din dos visas i doseringsfönstret.
|
|
Vrid dosinställningsknappen framåt för att öka (figur 22). |
|
4.2 Kontrollera att din fullständiga ordinerade dos visas i doseringsfönstret innan du går vidare till nästa steg. |
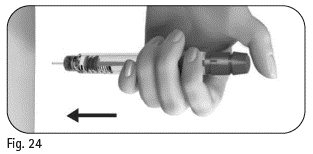
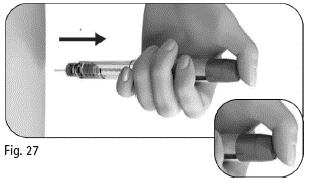
Steg 5 Injicera dosen
Viktigt: Injicera dosen såsom hälso- och sjukvårdspersonalen har visat dig. |
|
5.1 Tryck långsamt in hela nålen i huden (figur 24). |
|
5.2 Placera tummen mitt på dosinställningsknappen. Tryck ned dosknappen så långt det går och håll ned den för att avsluta den fullständiga injektionen (figur 25). |
|
Obs! Ju större dosen är, desto längre tid tar injektionen. |
|
5.3 Håll ned dosknappen minst 5 sekunder innan du drar ut nålen ur huden (figur 26).
|
|
Släpp inte dosinställningsknappen förrän du har dragit ut nålen ur huden. |
Steg 6 Ta bort nålen efter varje injektion
6.1 Placera det yttre nålskyddet på en plan yta. |
|
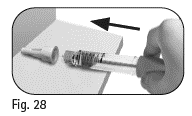
6.2 Håll Pergoveris förfylld injektionspenna med en hand och för in nålen i det yttre nålskyddet (figur 28). |
|
6.3 Fortsätt genom att trycka nålen med nålskyddet mot en fast yta tills du hör ett klickljud (”click”) (figur 29). |
|
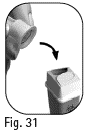
6.4 Ta tag i det yttre nålskyddet och skruva loss nålen genom att vrida den i motsatt riktning (figur 30). 6.5 Kasta den använda nålen på ett säkert sätt i en behållare för vassa föremål (figur 31). Hantera nålen försiktigt för att förhindra att du skadas av nålen. |
|
Återanvänd och dela inte en använd nål |
Step 7 Efter injektionen
7.1 Kontrollera att du har givit en fullständig injektion
|
|
Om ”0” visas i doseringsfönstret har du givit den fullständiga dosen. Om en siffra som är högre än ”0” visas i doseringsfönstret är Pergoveris förfylld injektionspenna tom. Du har inte fått den fullständiga ordinerade dosen och måste utföra steg 7.2 nedan. |
|
7.2 Avsluta en delinjektion (bara vid behov):
|
|
Steg 8 Förvara Pergoveris förfylld injektionspenna
8.1 Sätt tillbaka skyddet på injektionspennan för att undvika infektion (figur 34). |
|
8.2 Förvara injektionspennan i originalförpackningen på ett säkert ställe och i enlighet med anvisningarna i bipacksedeln. |
|
8.3 När pennan är tom, fråga hälso- och sjukvårdspersonal hur du kastar den. |
|
| Förvara inte injektionspennan med nålen ansluten eftersom det kan orsaka infektion. |
|
Återanvänd inte Pergoveris förfylld injektionspenna om den har tappats eller om injektionspennan är sprucken eller skadad eftersom detta kan orsaka skada. |
|
| Kontakta hälso- och sjukvårdspersonalen om du har frågor. |
|
Behandlingsdagbok till Pergoveris förfylld injektionspenna
1 Behandlingsdag nummer |
2 Datum |
3 Tid |
4 Volym i pennan (300 IE + 150 IE)/0,48 ml (450 IE + 225 IE)/0,72 ml (900 IE + 450 IE)/1,44 ml |
5 Ordinerad dos |
6 7 8 Doseringsfönstret |
||
Mängd inställd för injektion |
Mängd som ska ställas in för en andra injektion |
||||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
| / |
: |
nullom "0", slutförd injektion |
nullom inte ”0”, en andra injektion krävs Injicera denna mängd ..........med ny penna |
||||
Denna bruksanvisning ändrades senast: 06-2025