Pakkausseloste
PERGOVERIS injektioneste, liuos, esitäytetty kynä (450 IU+225 IU)/0,72 ml
Pergoveris (450 IU + 225 IU)/0,72 ml injektioneste, liuos, esitäytetty kynä
follitropiinialfa/lutropiinialfa
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Pergoveris on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät Pergoveris‑valmistetta
3. Miten Pergoveris‑valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. Pergoveris‑valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Pergoveris on
Pergoveris injektioneste, liuos sisältää kahta vaikuttavaa ainetta ”follitropiinialfaa” ja ”lutropiinialfaa”. Kumpikin kuuluu hormoniperheeseen nimeltä ”gonadotropiinit”, jotka osallistuvat lisääntymisen ja hedelmällisyyden säätelyyn.
Mihin Pergoveris‑valmistetta käytetään
Tätä lääkettä käytetään follikkelien eli munarakkuloiden (joissa kussakin on munasolu) kehittymisen stimulointiin munasarjoissa. Sitä käytetään aikuisille naisille (18‑vuotiaille tai vanhemmille), joilla on vähän (vaikea puutos) ”follikkeleita stimuloivaa hormonia” (FSH) ja ”lutenisoivaa hormonia” (LH). Nämä naiset ovat yleensä hedelmättömiä.
Kuinka Pergoveris toimii
Pergoveris‑valmisteen vaikuttavat aineet ovat luonnollisten FSH‑ ja LH‑hormonien kopioita. Kehossasi
- FSH stimuloi munasolujen tuotantoa
- LH stimuloi munasolujen irtoamista.
Korvaamalla puuttuvat hormonit Pergoveris mahdollistaa follikkelin kehittymisen naisilla, joiden FSH‑ ja LH‑tasot ovat alhaiset. Munasolu irtoaa follikkelista ”ihmisen koriongonadotropiini” (hCG) ‑hormonipistoksen jälkeen. Tämä auttaa naisia tulemaan raskaaksi.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Hedelmällisyysongelmien hoitoon perehtyneen lääkärin tulisi arvioida sinun ja kumppanisi hedelmällisyys ennen hoidon aloittamista.
Älä käytä Pergoveris‑valmistetta
• jos olet allerginen follikkelia stimuloivalle hormonille (FSH), luteinisoivalle hormonille (LH) tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
• jos sinulla on aivokasvain (hypotalamuksessa tai aivolisäkkeessä),
• jos sinulla on suurentuneet munasarjat tai munasarjakystia, joiden syy on tuntematon,
• jos sinulla on tuntemattomasta syystä johtuvaa verenvuotoa emättimestä,
• jos sinulla on munasarja‑, kohtu‑ tai rintasyöpä,
• jos sinulla on tila, joka yleensä tekee normaalin raskauden mahdottomaksi, kuten ennenaikaiset vaihdevuodet, synnytyselinten epämuodostuma tai hyvänlaatuisia kasvaimia kohdussa.
Älä käytä tätä lääkettä, jos jokin yllä mainituista koskee sinua. Jos et ole varma, keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät valmistetta.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin käytät Pergoveris‑valmistetta.
Porfyria
Keskustele lääkärin kanssa ennen Pergoveris‑valmisteen käytön aloittamista, jos sinulla tai jollakin sukulaisellasi on porfyria (elimistö ei kykene hajottamaan porfyriinejä; sairaus, joka voi periytyä vanhemmilta lapsille).
Kerro lääkärillesi heti, jos:
- ihostasi tulee hauras ja siihen tulee helposti rakkuloita, erityisesti jos iho on altistunut usein auringolle
sinulla on vatsa‑, käsivarsi‑ tai säärikipua.
Yllä mainituissa tapauksissa lääkäri saattaa ehdottaa hoidon lopettamista.
Munasarjojen hyperstimulaatio‑oireyhtymä (OHSS)
Tämä lääke stimuloi munasarjojasi. Se lisää riskiäsi saada munasarjojen hyperstimulaatio‑oireyhtymä (OHSS). Tämä tarkoittaa, että munarakkulasi kehittyvät liikaa ja muuttuvat suuremmiksi kystiksi. Jos sinulle tulee alavatsakipua, painosi nousee nopeasti, voit pahoin tai oksentelet tai jos sinulla on hengitysvaikeuksia, hakeudu heti lääkärinhoitoon. Tämän lääkevalmisteen käyttö täytyy ehkä lopettaa (ks. kohta Mahdolliset haittavaikutukset, ”Vakavimmat haittavaikutukset”).
Jos ovulaatiota ei tapahdu ja jos suositeltuja annostus‑ ja antotapaohjeita noudatetaan, vaikean OHSS:n ilmeneminen on epätodennäköisempää. Pergoveris‑hoito aiheuttaa harvoin vaikean OHSS:n. Sen todennäköisyys kasvaa, jos munarakkulan lopullisen kypsymisen aikaansaamiseksi käytettävää lääkettä (sisältää ihmisen istukkagonadotropiinia hCG:tä) annetaan (katso lisätietoja kohdasta Miten valmistetta käytetään ”Kuinka paljon valmistetta käytetään”). Jos sinulle on kehittymässä OHSS, lääkäri ei ehkä anna sinulle hCG:tä tässä hoitojaksossa ja saattaa pyytää sinua pidättäytymään yhdynnästä tai käyttämään mekaanista ehkäisymenetelmää vähintään neljän vuorokauden ajan.
Lääkäri varmistaa, että munasarjavastetta seurataan huolellisesti ultraäänitutkimuksin ja verikokein (estradioliarvot) ennen hoidon aloittamista ja sen aikana.
Monisikiöraskaus
Käyttäessäsi Pergoveris‑valmistetta sinulla on suurempi monisikiöraskauden (useimmiten kaksoset) riski kuin jos tulisit raskaaksi luonnollisesti. Monisikiöraskaus voi aiheuttaa lääketieteellisiä ongelmia sinulle ja vauvoillesi. Voit vähentää monisikiöraskauden riskiä käyttämällä aina oikean annoksen Pergoveris‑valmistetta oikeaan aikaan.
Monisikiöraskauden riskin minimoimiseksi suositellaan ultraäänitutkimuksia ja verikokeita.
Keskenmeno
Käytettäessä avusteisia lisääntymismenetelmiä tai munasarjojen stimulointia munasolujen tuottamiseen on todennäköisempää saada keskenmeno kuin tavanomaisen hedelmöittymisen jälkeen.
Kohdunulkoinen raskaus
Naisilla, joilla on aiemmin ollut tukkeutuneet tai vahingoittuneet munanjohtimet (munanjohdinsairaus) on olemassa riski, että alkio kiinnittyy kohdun ulkopuolelle (kohdunulkoinen raskaus). Näin voi tapahtua riippumatta siitä, onko raskaus alkanut spontaanilla hedelmöitymisellä vai hedelmällisyyshoidoilla.
Verenhyytymisongelmat (veritulpat)
Keskustele lääkärin kanssa ennen Pergoveris‑valmisteen käytön aloittamista, jos sinulla tai sukulaisellasi on aiemmin esiintynyt veritulppia jaloissa tai keuhkoissa, tai sinulla on ollut sydänkohtaus tai aivohalvaus, tai jos sellaisia on ilmennyt suvussasi. Sinulla saattaa olla suurempi riski vakavien veritulppien ilmenemiseen tai olemassa olevien tulppien pahenemiseen Pergoveris‑hoidon myötä.
Sukuelinten kasvaimet
Munasarjojen ja muiden sukuelinten kasvaimia, sekä hyvän‑ että pahanlaatuisia, on raportoitu naisilla, joita on hoidettu lääkkeillä useita hoitojaksoja hedelmättömyyden vuoksi.
Allergiset reaktiot
Pergoveris‑valmisteen käytön yhteydessä on ilmoitettu ilmenneen yksittäisiä lieviä allergisia reaktioita. Keskustele lääkärin kanssa ennen Pergoveris‑valmisteen käytön aloittamista, jos sinulla on ilmennyt allergisia reaktioita samankaltaisten valmisteiden käytön yhteydessä.
Lapset ja nuoret
Pergoveris ei ole tarkoitettu käytettäväksi lapsille tai alle 18‑vuotiaille nuorille.
Muut lääkevalmisteet ja Pergoveris
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Älä käytä Pergoveris‑valmistetta muiden lääkevalmisteiden kanssa samassa injektiossa. Voit käyttää Pergoveris-valmistetta rekisteröidyn follitropiinialfavalmisteen kanssa erillisenä injektiona, jos lääkäri niin määrää.
Raskaus ja imetys
Älä käytä Pergoveris‑valmistetta, jos olet raskaana tai imetät.
Ajaminen ja koneiden käyttö
Tämä lääke ei oletettavasti vaikuta kykyysi ajaa autoa, tai käyttää koneita.
Pergoveris sisältää natriumia
Pergoveris sisältää alle 1 mmol natriumia (23 mg) per annos, eli sen voidaan sanoa olevan ”natriumiton”.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Tämän lääkkeen käyttäminen
- Pergoveris on tarkoitettu annettavaksi pistoksella ihon alle (subkutaanisesti). Minimoidaksesi ihon ärsytyksen valitse joka päivä eri pistospaikka.
- Lääkäri tai sairaanhoitaja näyttää sinulle, kuinka lääke pistetään esitäytetyllä Pergoveris-kynällä.
- Jos he ovat sitä mieltä, että pystyt annostelemaan Pergoveris‑valmistetta turvallisesti, voit itse kotona saattaa lääkkeen käyttökuntoon ja antaa pistoksen.
- Jos annat pistoksen itse, lue”Käyttöohjeet” huolellisesti ja noudata niitä.
Kuinka paljon valmistetta käytetään
Hoito-ohjelma aloitetaan antamalla päivittäin suositeltava annos Pergoveris-valmistetta, joka sisältää 150 kansainvälistä yksikköä (IU) follitropiinialfaa ja 75 IU lutropiinialfaa.
- Vasteestasi riippuen lääkäri voi lisätä päivittäisen annoksen rekisteröityä follitropiinialfavalmistetta Pergoveris‑pistokseesi. Tässä tapauksessa follitropiinialfa‑annosta lisätään yleensä 37,5 ‑ 75 IU:n verran 7 ‑ 14 päivän välein.
- Hoitoa jatketaan, kunnes toivottu vaste on saavutettu, eli kunnes sinulle on kehittynyt ultraäänitutkimuksien ja verikokeiden avulla sopivaksi arvioitu follikkeli.
- Tämä saattaa kestää jopa 5 viikkoa.
Kun olet saavuttanut toivotun vasteen, sinulle annetaan yksi pistos ihmisen koriongonadotropiinia (hCG) 24 ‑ 48 tuntia viimeisen Pergoveris‑pistoksen jälkeen. Paras aika olla sukupuoliyhteydessä on hCG:n pistospäivänä ja sitä seuraavana päivänä. Vaihtoehtoisesti sinulle voidaan tehdä kohdunsisäinen keinohedelmöitys tai käyttää jotakin muuta lääketieteellisesti avustettua lisääntymismenetelmää lääkärin arvion perusteella.
Jos elimistösi reagoi liian voimakkaasti, hoitosi keskeytetään eikä sinulle anneta hCG:tä (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Munasarjojen hyperstimulaatio‑oireyhtymä (OHSS)”). Tässä tapauksessa lääkäri antaa sinulle pienemmän follitropiinialfa‑annoksen seuraavassa hoitojaksossa.
Jos käytät enemmän Pergoveris‑valmistetta kuin sinun pitäisi
Pergoveris‑valmisteen yliannostuksen vaikutuksia ei tunneta, mutta seurauksena saattaa olla OHSS:n ilmaantuminen. Näin käy kuitenkin vain, mikäli hCG:tä annetaan (ks. kohdasta Mitä sinun on tiedettävä ennen valmisteen käyttöä. ”Munasarjojen hyperstimulaatio‑oireyhtymä (OHSS)”).
Jos unohdat käyttää Pergoveris‑valmistetta
Älä käytä kaksinkertaista annosta korvataksesi unohtamasi kerta‑annoksen. Ota yhteyttä lääkäriisi.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Vakavimmat haittavaikutukset
Ota välittömästi yhteyttä lääkäriin, mikäli huomaat jonkin alla mainituista haittavaikutuksista. Lääkäri saattaa pyytää sinua lopettamaan Pergoveris‑valmisteen käytön.
Allergiset reaktiot
Allergiset reaktiot, kuten esimerkiksi ihottuma, ihon punoitus, nokkosihottuma ja kasvojen turvotus johon liittyy hengitysvaikeuksia, voivat joskus olla vakavia. Tämä haittavaikutus on hyvin harvinainen.
Munasarjojen hyperstimulaatio‑oireyhtymä (OHSS)
- Alavatsakipu yhdessä pahoinvoinnin tai oksentelun kanssa. Tämä voi olla munasarjojen hyperstimulaatio‑oireyhtymän (OHSS) oire. Munasarjasi ovat saattaneet ylireagoida hoitoon ja muodostaa suuria nesterakkuloita tai kystia (ks. kohdasta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Munasarjojen hyperstimulaatio‑oireyhtymä (OHSS)”). Tämä haittavaikutus on yleinen. Jos näin käy, lääkärisi on tutkittava sinut mahdollisimman pian.
- OHSS voi muuttua vaikeaksi, jolloin munasarjat ovat selkeästi suurentuneet, virtsantuotanto on vähentynyt, painosi nousee, sinulla on hengitysvaikeuksia ja/tai vatsaasi tai rintakehääsi kerääntyy mahdollisesti nestettä. Tämä haittavaikutus on melko harvinainen (saattaa esiintyä alle 1 henkilöllä 100:sta).
- OHSS:n komplikaatioita, kuten munasarjojen kiertymää tai veren hyytymistä voi ilmetä harvinaisissa tapauksissa (saattaa esiintyä alle 1 henkilöllä 1 000:sta).
Vakavia, yleensä vaikeaan OHSS:ään liittyviä verenhyytymisongelmia (tromboembolisia tapahtumia) voi ilmetä hyvin harvinaisissa tapauksissa. Tämä voi aiheuttaa rintakipua, hengenahdistusta, aivohalvauksen tai sydänkohtauksen. Harvinaisissa tapauksissa näin voi tapahtua myös OHSS:stä riippumatta (ks. kohdasta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Verenhyytymisongelmat (veritulpat)”).
Muita haittavaikutuksia
Hyvin yleisiä (saattaa esiintyä yli 1 henkilöllä 10:sta):
- nestettä sisältävät rakkulat munasarjoissa (munasarjakystat)
- päänsärky
- paikalliset reaktiot pistoskohdassa (kipu, punoitus, kutina, mustelmat, turvotus
ja/tai ärsytys).
Yleisiä (saattaa esiintyä alle 1 henkilöllä 10:sta):
- ripuli
- kipu rinnoissa
- pahoinvointi tai oksentelu
- kipu vatsan tai lantion alueella
- vatsan kouristelu tai turvotus
Hyvin harvinaisia (saattaa esiintyä alle 1 henkilöllä 10 000:sta):
- Astmasi saattaa pahentua
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan(ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55, FI‐00034 Fimea.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
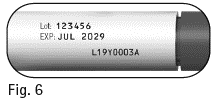
Älä käytä tätä lääkettä etiketissä ja pakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP/Käyt. viim.) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 – 8 °C). Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Kun pakkaus on avattu, esitäytettyä kynää saa säilyttää korkeintaan 28 päivää jääkaapin ulkopuolella (lämpötilassa 25 °C). Älä käytä esitäytettyyn kynään jäänyttä lääkettä 28 päivän jälkeen.
Älä käytä tätä lääkettä, jos huomaat näkyviä muutoksia lääkevalmisteen ulkonäössä, jos neste sisältää hiukkasia tai ei ole kirkasta.
Hävitä käytetty neula pistämisen jälkeen turvallisesti.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Pergoveris sisältää
Vaikuttavat aineet ovat follitropiinialfa ja lutropiinialfa.
- Yksi esitäytetty Pergoveris (450 IU + 225 IU)/0,72 ml -kynä sisältää 450 IU (kansainvälistä yksikköä) follitropiinialfaa ja 225 IU lutropiinialfaa 0,72 ml:ssa, ja sillä voidaan antaa kolme annosta Pergoveris 150 IU/75 IU -valmistetta.
Muut aineet ovat
- Sakkaroosi, arginiinimonohydrokloridi, poloksameeri 188, metioniini, fenoli, dinatriumfosfaattidihydraatti, natriumdivetyfosfaattimonohydraatti ja injektionesteisiin käytettävä vesi. Hyvin pieniä määriä väkevää fosforihappoa ja natriumhydroksidia on lisätty happamuuden (pH-arvon) pitämiseksi normaalina.
Lääkevalmisteen kuvaus ja pakkauskoko (‑koot)
Pergoveris on kirkas, väritön tai hieman kellertävä injektioneste, liuos, joka toimitetaan esitäytetyssä moniannoskynässä.
- Pergoveris (450 IU + 225 IU)/0,72 ml toimitetaan pakkauksessa, joka sisältää 1 esitäytetyn moniannoskynän ja 7 kertakäyttöistä injektioneulaa.
Myyntiluvan haltija
Merck Europe B.V., Gustav Mahlerplein 102, 1082 MA Amsterdam, Alankomaat
Valmistaja
Merck Serono S.p.A, Via delle Magnolie 15 (Zona industriale), 70026 Modugno (Bari), Italia
Tämä pakkausseloste on tarkistettu viimeksi 06-2025.
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu/.
Ohjeet käyttäjälle
Pergoveris
(300 IU + 150 IU)/0,48 ml (450 IU + 225 IU)/0,72 ml (900 IU + 450 IU)/1,44 ml
Injektioneste, liuos, esitäytetty kynä
Follitropiinialfa/lutropiinialfa
Tärkeitä tietoja esitäytetystä Pergoveris-kynästä
- Lue käyttöohjeet ja pakkausseloste, ennen kuin käytät esitäytettyä Pergoveris-kynää.
- Noudata aina näitä käyttöohjeita ja terveydenhuollon ammattilaiselta saamiasi ohjeita, sillä ne saattavat poiketa aiemmista kokemuksistasi. Näiden ohjeiden avulla voidaan ehkäistä hoitovirheitä ja neulanpistosta tai rikkoutuneen lasin aiheuttamasta haavasta johtuvia infektioita.
Esitäytetty Pergoveris-kynä on tarkoitettu vain ihonalaisten pistosten antamiseen.
- Käytä esitäytettyä Pergoveris-kynää vain, jos terveydenhuollon ammattilainen on opastanut sinua käyttämään sitä oikein.
- Terveydenhuollon ammattilainen kertoo sinulle, kuinka monta esitäytettyä Pergoveris-kynää tarvitset.
- Anna pistos itsellesi samaan aikaan joka päivä.
Kynästä on olemassa 3 eri moniannosvaihtoehtoa:
(300 IU + 150 IU)/0,48 ml |
|
(450 IU + 225 IU)/0,72 ml |
|
(900 IU + 450 IU)/1,44 ml |
|
Huomautus:
- Suurin annos, jonka voit asettaa käyttäessäsi vahvuutta (300 IU + 150 IU)/0,48 ml, on 300 IU.
- Suurin annos, jonka voit asettaa käyttäessäsi vahvuuksia (450 IU + 225 IU)/0,72 ml ja (900 IU + 450 IU)/1,44 ml, on 450 IU.
- Voit kääntää annosvalitsinta 12,5 IU kerrallaan, kunnes saavutat oikean annoksen.
Katso pakkausselosteesta lisätietoja suositeltavasta annostelusta ja noudata aina terveydenhuollon ammattilaisen antamia annostusohjeita.
a. Asettaa sinulle määrätyn annoksen (kuva 1). |
Kuva 1 |
| b. Varmistaa, että olet pistänyt koko annoksen (kuva 2). |
Kuva 2 |
| c. Nähdä sen annoksen suuruuden, joka sinun täytyy vielä pistää uudella kynällä (kuva 3). |
Kuva 3 |
- Irrota neula kynästä aina heti pistoksen antamisen jälkeen.
Älä käytä samaa neulaa uudelleen.
Älä jaa kynää ja/tai neuloja muiden henkilöiden kanssa.
Älä käytä esitäytettyä Pergoveris-kynää, jos se on pudonnut, tai jos kynässä on murtumia tai vaurioita, sillä se voi aiheuttaa vahinkoa.
Esitäytetyn Pergoveris-kynän hoitopäiväkirjan käyttö
Käyttöohjeiden lopussa on hoitopäiväkirja. Merkitse pistämäsi määrä päiväkirjaan.
Väärän lääkeannoksen pistäminen saattaa haitata hoitoasi.
- Kirjaa hoitopäivän numero (sarake 1), päivämäärä (sarake 2), pistoksen kellonaika (sarake 3) ja kynän tilavuus (sarake 4).
- Kirjaa lääkärin määräämä annos (sarake 5).
- Tarkista ennen pistämistä, että annos on asetettu oikein (sarake 6).
- Lue pistoksen jälkeen annosikkunassa näkyvä numero.
- Varmista, että olet saanut koko pistoksen (sarake 7) tai merkitse ylös annosikkunassa näkyvä numero, mikäli se ei ole ”0” (sarake 8).
- Anna tarvittaessa pistos toisella kynällä ja valitse annokseksi puuttumaan jäänyt määrä, jonka olet merkinnyt kohtaan ”Toisen pistoksen määrä” (sarake 8).
- Merkitse tämä loppuannos seuraavalle riville kohtaan ”Pistettävä määrä” (sarake 6).
Kun kirjaat hoitopäiväkirjaan päivittäiset pistokset, voit joka päivä varmistaa, että olet saanut koko määrätyn annoksen.
Esimerkki hoitopäiväkirjamerkinnöistä, kun käytössä on (450 IU + 225 IU)/0,72 ml -kynä:
1 Hoitopäivän numero |
2 Päivämäärä |
3 Kellonaika |
4 Kynän tilavuus 300 IU + 150 IU)/0,48 ml (450 IU + 225 IU)/0,72 ml (900 IU + 450 IU)/1,44 ml |
5 Lääkärin määräämä annos |
6 7 8 Annosikkuna |
||
Pistettävä määrä |
Toisen pistoksen määrä
|
||||||
1 |
10.6. |
19.00 |
450 IU + 225 IU |
150 IU/ 75 IU |
150 |
koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos .........uudella kynällä |
2 |
11.6. |
19.00 |
450 IU + 225 IU |
150 IU/ 75 IU |
150 |
koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
3 |
12.6. |
19.00 |
450 IU + 225 IU |
225 IU/ 112.5 IU |
225 |
nulljos "0", koko pistos annettu |
Pistä annos.75..uudella kynällä |
3 |
12.6. |
19.00 |
450 IU + 225 IU |
N/A |
75 |
koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos..........uudella kynällä |
Esitäytettyyn Pergoveris-kynään tutustuminen
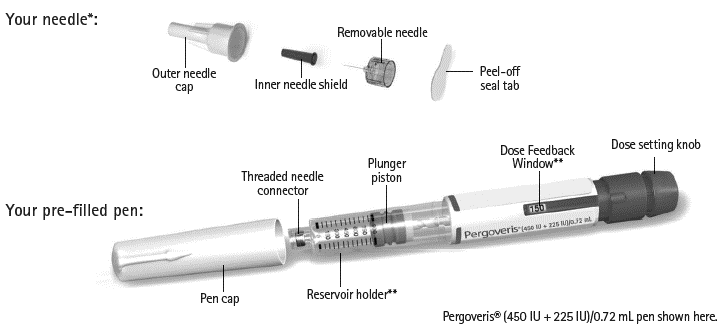
Kynän korkki
Säiliö**
Kuvassa Pergoveris® (450 IU + 225 IU)/0,72 ml ‑kynä
Annosikkuna**
Annosvalitsin
Irrotettava suojapaperi
Sisempi neulansuojus
Ulompi neulansuojus
Mäntä
Kierrekärki neulan kiinnittämistä varten
Esitäytetty kynä:
Irrotettava neula
Neula*:
*Kuvat ovat esimerkkejä. Toimitetut neulat saattavat olla hieman erinäköisiä.
**Annosikkunassa ja säiliössä näkyvät numerot tarkoittavat lääkkeen kansainvälisten yksiköiden (IU) määrää.
Vaihe 1 Tarvittavien välineiden kokoaminen
1.1 Anna esitäytetyn kynän lämmetä huoneenlämpöiseksi vähintään 30 minuuttia ennen käyttöä. Älä lämmitä kynää mikroaaltouunissa tai muulla tavalla. |
Kuva 4 |
1.2. Valmistele puhdas ja tasainen pinta, kuten pöytä tai työtaso, jossa on hyvä valaistus. 1.3 Lisäksi tarvitset (ei sisälly pakkaukseen): alkoholipyyhkeitä ja neulojen keräysastian (kuva 4). 1.4 Pese kädet saippualla ja vedellä ja kuivaa ne hyvin (kuva 5). 1.5 Ota esitäytetty Pergoveris-kynä ulos pakkauksesta kädelläsi. Älä käytä työkaluja, sillä ne voivat vaurioittaa kynää. |
Kuva 5 |
1.6 Varmista, että esitäytetyssä kynässä lukee Pergoveris. |
|
1.7 Tarkista kynän etikettiin merkitty viimeinen käyttöpäivämäärä (kuva 6). Älä käytä esitäytettyä Pergoveris-kynää, jos viimeinen käyttöpäivämäärä on ylittynyt tai jos esitäytetyssä kynässä ei lue Pergoveris. |
Kuva 6 |
Vaihe 2 Pistämiseen liittyvät valmistelut
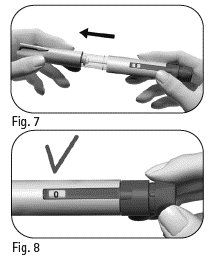
2.1 Poista kynän korkki vetämällä (kuva 7). |
||
2.2 Tarkista, että lääke on kirkasta ja väritöntä ja ettei se sisällä hiukkasia. Älä käytä esitäytettyä kynää, jos lääkkeessä on näkyviä värimuutoksia tai hiukkasia, sillä se voi johtaa infektioon. 2.3 Varmista, että annosikkunaan on valittu ”0” (kuva 8). |
Kuva 7 Kuva 8 |
|
Valitse pistoskohta: |
||
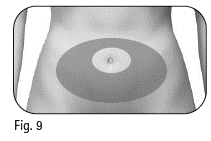
2.4 Terveydenhuollon ammattilainen neuvoo sinulle vatsan alueella sijaitsevat pistoskohdat (kuva 9). Minimoi ihoärsytys valitsemalla eri pistoskohta joka päivä. 2.5 Puhdista pistoskohdan iho alkoholipyyhkeellä. Älä koske tai peitä puhdistettua ihoa. |
Kuva 9 |
|
Vaihe 3 Neulan kiinnittäminen
Kuva 16
Kuva 15
Tärkeää: Varmista, että annat jokaisen pistoksen uudella neulalla. Neulojen uudelleenkäyttö voi aiheuttaa infektioita. |
Kuva 10 |
||||||
3.1 Ota uusi neula. Käytä vain pakkauksen kertakäyttöneuloja. |
|||||||
3.2 Tarkista, että ulompi neulansuojus ei ole vahingoittunut. |
|||||||
3.3 Pidä ulommasta neulansuojuksesta kunnolla kiinni. |
|||||||
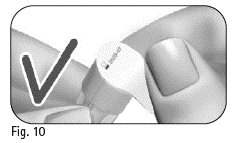
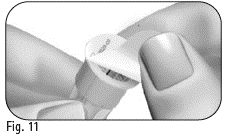
3.4 Tarkista, että ulomman neulansuojuksen irrotettava suojapaperi ei ole vahingoittunut eikä irronnut, ja ettei viimeinen käyttöpäivämäärä ole ylittynyt (kuva 10). |
Kuva 11 |
||||||
3.5 Irrota suojapaperi (kuva 11). |
|||||||
Älä käytä neulaa, jos se on vaurioitunut, jos viimeinen käyttöpäivämäärä on ylittynyt tai jos ulompi neulansuojus tai suojapaperi on vahingoittunut tai irronnut. Vanhentuneiden tai vaurioituneiden neulojen tai neulojen, joiden suojapaperi tai ulompi neulansuojus on vahingoittunut, käyttö voi johtaa infektioon. Pane se neulojen keräysastiaan ja ota uusi neula. |
Kuva 12 |
||||||
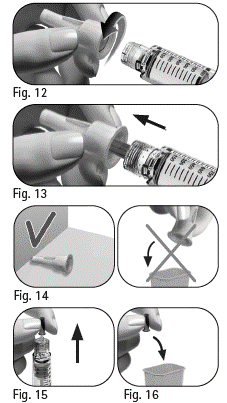
3.6 Kierrä esitäytetyn Pergoveris-kynän kierrekärkeä ulompaan neulansuojukseen niin kauan, että tuntuu lievää vastusta (kuva 12). Älä kiinnitä neulaa liian tiukasti, neulaa voi olla vaikea irrottaa pistoksen jälkeen. |
Kuva 14 Kuva 13 |
||||||
3.7 Irrota ulompi neulansuojus vetämällä sitä varovasti (kuva 13). |
|||||||
3.8 Pistä se sivuun myöhempää käyttöä varten (kuva 14). Älä heitä ulompaa neulansuojusta pois, sillä sen avulla voidaan ehkäistä pistotapaturmia ja infektioita, kun neulaa irrotetaan esitäytetystä kynästä. |
|||||||
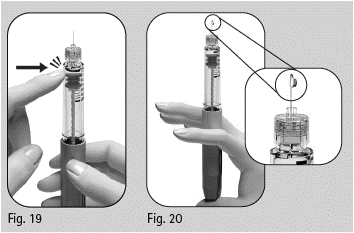
3.9 Pidä esitäytettyä Pergoveris-kynää niin, että neula on ylöspäin (kuva 15). |
|||||||
3.10 Irrota varovasti sisempi suojus ja heitä se pois (kuva 16). Älä aseta sisempää neulansuojusta uudelleen neulan päälle, sillä se voi johtaa pistotapaturmaan ja infektioon. |
|||||||
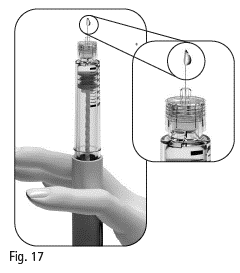
3.11 Tarkista neulankärki huolellisesti nestepisaran (‑pisaroiden) varalta (kuva 17).
|
Kuva 17 |
Jos neulan kärjessä tai kärjen lähettyvillä ei näy pientä nestepisaraa (tai -pisaroita), kun käytät kynää ensimmäisen kerran:
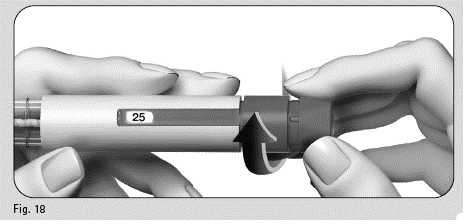
Kuva 18
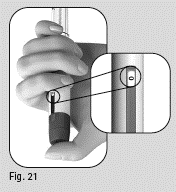
1. Käännä annosvalitsinta kevyesti eteenpäin, kunnes annosikkunassa näkyy arvo ”25” (kuva 18).
Kuva 20 Kuva 21 Kuva 19 |
2. Pidä kynästä kiinni niin, että neula osoittaa ylöspäin.
3. Napauta säiliötä kevyesti (kuva 19).
4. Paina annosvalitsinta niin pitkälle kuin se menee. Neulan kärkeen ilmestyy pieni nestepisara (kuva 20).
5. Tarkista, että annosikkunassa näkyy arvo ”0” (kuva 21).
6. Siirry vaiheeseen 4 Määrätyn annoksen asettaminen.
Jos neulan kärkeen ei ilmesty pientä nestepisaraa, ota yhteys terveydenhuollon ammattilaiseen.
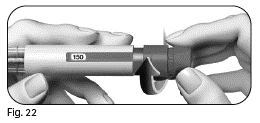
Vaihe 4 Määrätyn annoksen asettaminen
4.1 Käännä annosvalitsinta, kunnes tarvitsemasi annos näkyy annosikkunassa.
|
4.2 Ennen kuin siirryt seuraavaan vaiheeseen, varmista että annosikkunassa näkyy lääkärin määräämä annos kokonaisuudessaan.
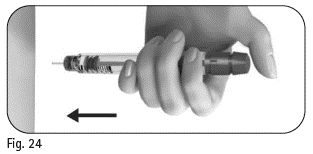
Vaihe 5 Annoksen pistäminen
Tärkeää: Pistä annos terveydenhuollon ammattilaisen neuvomalla tavalla. |
|
5.1 Työnnä koko neula hitaasti ihoon (kuva 24). |
Kuva 24 |
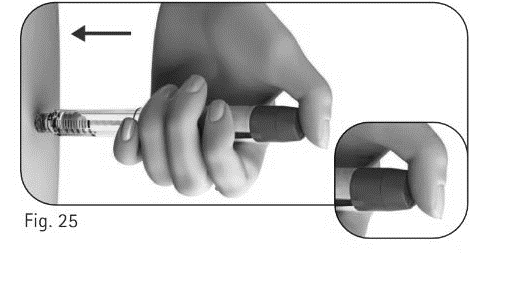
5.2 Laita peukalo annosvalitsimen päälle. Paina annosvalitsin hitaasti niin pitkälle kuin se menee, ja pidä sitä painettuna, kunnes koko pistos on annettu (kuva 25). |
Kuva 25 |
Huomaa: Mitä suurempi annos, sen kauemmin sen pistäminen kestää. |
|
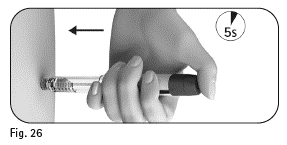
5.3 Pidä annosvalitsin alhaalla vähintään 5 sekuntia ennen kuin poistat neulan ihostasi (kuva 26).
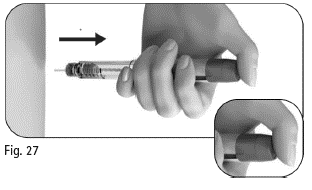
Vähintään 5 sekunnin kuluttua vedä neula ulos ihosta samalla kun pidät annosvalitsinta alas painettuna (kuva 27). Kun olet poistanut neulan ihosta, vapauta annosvalitsin. |
Kuva 26 |
Älä vapauta annosvalitsinta ennen kuin olet vetänyt neulan ulos ihosta. |
Kuva 27 |
Vaihe 6 Neulan poistaminen jokaisen pistoksen jälkeen
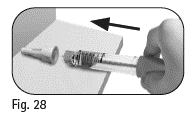
6.1 Aseta ulompi neulansuojus tasaiselle alustalle. |
Kuva 28 |
6.2 Pidä esitäytettyä Pergoveris-kynää tukevasti toisella kädellä ja tipauta neula ulompaan neulansuojukseen (kuva 28). |
|
6.3 Paina suojattua neulaa tukevaa alustaa vasten, kunnes kuulet naksahduksen (kuva 29). |
Kuva 29 |
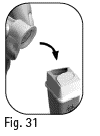
6.4 Tartu ulompaan neulansuojukseen ja irrota neula kiertämällä vastakkaiseen suuntaan (kuva 30). 6.5 Hävitä käytetty neula turvallisesti neulojen keräysastiaan (kuva 31). Käsittele neulaa varoen pistotapaturmien ehkäisemiseksi. |
Kuva 31 Kuva 30 |
Älä käytä samaa neulaa uudelleen tai jaa sitä muiden kanssa. |
Vaihe 7 Pistoksen jälkeen
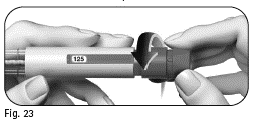
7.1 Tarkista, että olet antanut koko pistoksen:
|
Kuva 32 |
Jos annosikkunassa näkyy ”0”, olet antanut koko pistoksen. Jos annosikkunassa näkyy lukema, on suurempi kuin ”0”, esitäytetty Pergoveris-kynä on tyhjä. Et ole saanut koko määrättyä annosta, ja sinun on suoritettava alla oleva vaihe 7.2. |
|
7.2 Täydennä vajaaksi jäänyttä pistosta (vain tarvittaessa):
|
Kuva 33 |
Vaihe 8 Esitäytetyn Pergoveris-kynän säilyttäminen
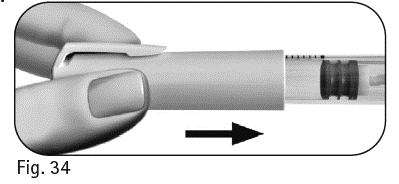
8.1 Laita korkki takaisin kynään infektioiden ehkäisemiseksi (kuva 34). |
Kuva 34 |
8.2 Säilytä kynä alkuperäispakkauksessa turvallisessa paikassa pakkausselosteen ohjeiden mukaisesti. |
|
8.3 Kun kynä on tyhjä, kysy terveydenhuollon ammattilaiselta, miten se hävitetään. |
|
Älä säilytä kynää, jossa on neula, sillä se voi aiheuttaa infektioita. |
|
Älä käytä esitäytettyä Pergoveris-kynää uudelleen, jos se on pudonnut, murtunut tai vahingoittunut, sillä siitä voi seurata vammoja. |
|
Jos sinulla on kysyttävää, ota yhteys terveydenhuollon ammattilaiseen. |
|
Esitäytetyn Pergoveris-kynän hoitopäiväkirja
1 Hoitopäivän numero |
2 Päivämäärä |
3 Kellonaika |
4 Kynän tilavuus (300 IU + 150 IU)/0,48 ml (450 IU + 225 IU)/0,72 ml (900 IU + 450 IU)/1,44 ml |
5 Lääkärin määräämä annos |
6 7 8 Annosikkuna |
||
Pistettävä määrä |
Toisen pistoksen määrä
|
||||||
| / |
: |
nulljos "0", Koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen. Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
| / |
: |
nulljos "0", koko pistos annettu |
nulljos ei "0", tarvitset toisen pistoksen Pistä annos ..........uudella kynällä |
||||
Nämä käyttöohjeet on tarkistettu viimeksi: 06-2025