Pakkausseloste
CELLUVISC ögondroppar, lösning i endosbehållare 1 %
Tilläggsinformation
Celluvisc 1,0 % ögondroppar, lösning i endosbehållare
karmellosnatrium
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
Detta läkemedel är receptfritt. Använd alltid detta läkemedel exakt enligt beskrivning i denna bipacksedel eller enligt anvisningar från apotekspersonal eller sjuksköterska.
- Spara denna information, du kan behöva läsa den igen.
- Vänd dig till apotekspersonalen om du behöver mera information eller råd.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
- Du måste tala med läkare om du inte mår bättre eller om du mår sämre.
I denna bipacksedel finns information om följande
1. Vad Celluvisc är och vad det används för
2. Vad du behöver veta innan du använder Celluvisc
3. Hur du använder Celluvisc
4. Eventuella biverkningar
5. Hur Celluvisc ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Celluvisc är ett tårersättningsmedel och innehåller ett smörjmedel som heter karmellosnatrium. Celluvisc används för behandling av symtom på torra ögon (såsom ömhet, sveda, irritation eller torrhet) som orsakas av att det inte produceras tillräckligt med tårvätska för att hålla ögat fuktigt.
Karmellosnatrium som finns i Celluvisc kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apotek eller annan hälsovårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Vad du behöver veta innan produkten används
Använd inte Celluvisc
- om du är allergisk mot karmellosnatrium eller något av övriga innehållsämnen i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
Varningar och försiktighet
- Om du använder kontaktlinser ska dessa tas ut innan du använder Celluvisc. Kontaktlinserna kan sättas tillbaka 15 minuter efter dosering.
- Om irritation, smärta, rodnad eller synförändringar uppstår, eller om du upplever att dina symtom förvärras, sluta att använda detta läkemedel och kontakta läkare eller apotekspersonal.
- För att undvika förorening eller eventuell ögonskada, låt inte endosbehållarens öppning vidröra ditt öga eller något annat.
Andra läkemedel och Celluvisc
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel, även receptfria sådana.
Om du använder andra ögondroppar, ska du lämna minst 15 minuter mellan dosering av de andra ögondropparna och dosering av Celluvisc.
Graviditet och amning
Celluvisc kan användas under graviditet och amning.
Körförmåga och användning av maskiner
Celluvisc kan orsaka tillfällig dimsyn, som kan typiskt vara i 1–15 minuter. Om du upplever tillfällig dimsyn ska du inte köra bil eller använda maskiner innan synen har klarnat.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Hur produkten används
Celluvisc används okulärt (appliceras på ögats yta). Använd alltid detta läkemedel exakt enligt beskrivningen i denna bipacksedel eller enligt anvisningar från läkare, apotekspersonal eller sjuksköterska. Rådfråga läkare, apotekspersonal eller sjuksköterska om du är osäker.
Rekommenderad dos är 1–2 droppar Celluvisc i det påverkade ögat/de påverkade ögonen vid behov.
Kontrollera att endosbehållaren är oskadad innan användning. Lösningen ska användas omedelbart efter öppnandet.
Tvätta händerna före användning.
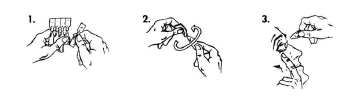
- Dra loss en endosbehållare från remsan.
- Håll endosbehållaren upprätt (med vingen överst) och vrid av vingen.
- Dra försiktigt ned det undre ögonlocket så att det bildas en ficka. Vänd endosbehållaren upp och ner och kläm på den för att trycka ut en droppe i varje öga. Blinka med ögonen några gånger.
Återanvänd inte endosbehållaren även om det finns lösning kvar. Det är mycket viktigt att du kastar endosbehållaren och inte behåller den.
Om du använt för stor mängd av Celluvisc
Överdosering innebär inte några risker. Om du är orolig, tala med läkare eller apotekspersonal.
Om du har glömt att använda Celluvisc
Applicera nästa dos vid behov eller vid den vanliga tidpunkten enligt instruktion från apotekspersonal eller läkare. Använd inte dubbel dos för att kompensera för glömd dos.
Om du har ytterligare frågor om detta läkemedel kontakta läkare, apotekspersonal eller sjuksköterska .
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Följande biverkningar och kliniskt signifikanta ogynnsamma händelser rapporterades under kliniska prövningar:
Vanliga (kan förekomma hos upp till 1 av 10 personer):
- ögonirritation (inklusive brännande känsla och obehag)
- ögonsmärta
- klåda i ögonen
- synstörning.
Data från erfarenhet efter godkännande för försäljning
Följande biverkningar och kliniskt signifikanta ogynnsamma händelser har rapporterats sedan läkemedlet började marknadsföras:
Mindre vanliga (kan förekomma hos upp till 1 av 100 personer):
- allergiska reaktioner (inklusive ögon- eller ögonlockssvullnad)
- dimsyn
- ökad tårproduktion (tårflöde)
- klibbiga ögon
- var och/eller läkemedelsrester i ögonlockskanten
- en känsla av att ha skräp i ögat
- rodnad i ögat/av ögonlocket
- nedsatt syn
- ögonskada på ögats yta på grund av att endosbehållarens spets rört vid ögat under användning.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på endosbehållarens vinge, på foliepåsen och på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25 °C.
Förvara endosbehållarna i påsen och lägg påsen tillbaka i kartongen. Påsen behövs för att skydda mot avdunstning av fukt.
Använd inte detta läkemedel om förpackningen inte ser ut att vara orörd.
Använd inte om lösningen ändrar färg eller blir grumlig.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är karmellosnatrium 10 mg/ml.
- Övriga innehållsämnen är natriumklorid, natriumlaktat, kaliumklorid, kalciumkloriddihydrat och renat vatten.
De innehållsämnen som används i Celluvisc valdes för att passa ihop med tårvätskan som normalt produceras i ögat.
Läkemedlets utseende och förpackningsstorlekar
Celluvisc är en ögondropplösning som är klar, färglös till svagt gul lösning i en liten genomskinlig förpackning (liknande en bubbla, så kallad endosbehållare). Endosbehållaren har en vinge som kan vridas av. Varje endosbehållare innehåller 0,4 ml lösning.
Varje förpackning innehåller 10, 20, 30, 40, 60 eller 90 endosbehållare i foliepåsar.
Varje foliepåse innehåller 10 endosbehållare.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning
AbbVie Oy
Lokvägen 11 T 132
00520 Helsingfors
Finland
Tillverkare
Allergan Pharmaceuticals Ireland,
Castlebar Road,
Westport, Co. Mayo,
Irland
Denna bipacksedel ändrades senast 24.09.2024
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Fimeas webbplats https://www.fimea.fi/.
För att lyssna på eller begära en kopia av denna information i förstorad text, vänligen kontakta ombudet för innehavaren av godkännandet för försäljning.